一元强酸和一元弱酸(学生)
- 格式:doc
- 大小:34.00 KB
- 文档页数:1
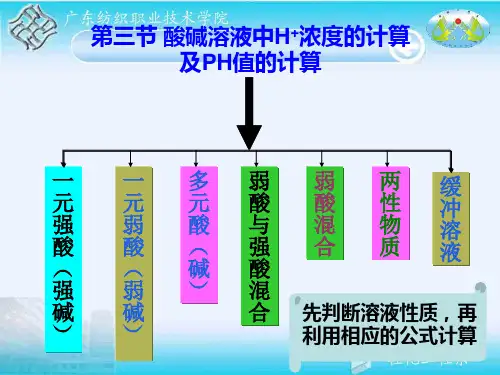


弱电解质的电离平衡考点归纳弱电解质电离平衡是电解质理论的基础,也是中学化学基本理论中的重要组成部分,近几年高考命题中反复考查。
在学生已经学过化学平衡理论并了解电解质在水溶液中发生电离和离子间发生反应等知识的基础上,进一步学习弱电解质的电离平衡。
高考命题的热点主要有影响弱电解质电离平衡因素,通过图象分析弱电解质和强电解质,电离常数和电离度等,为了更好的学习这一部分内容,本文做了详细的总结和归纳,希望对同学们的学习有所启发,达到触类旁通的效果。
一、弱电解质电离平衡1.电离平衡概念一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态,简称电离平衡。
任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质在该条件下的电离程度最大。
2.电离平衡的特征电解质的电离平衡属于化学平衡中的一种形式,具有以下一些特征:“逆”——弱电解质的电离是可逆的,存在电离平衡“动”——电离平衡是动态平衡“等”——v(=v(分子化)≠0离子化)“定”——达到电离平衡状态时,溶液中分子和离子的浓度保持不变,是一个定值“变”——电离平衡是相对的,外界条件改变时,平衡被破坏,发生移动形成新的平衡。
二、影响弱电解质电离平衡的因素(符合勒?夏特列原理)1.内因:弱电解质本身的性质,是决定性因素。
2.外因①温度: 升高温度,由于电离过程吸热,平衡向电离方向移动,电离程度增大。
②浓度: 加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。
因为溶液浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大;所以,稀释溶液会促进弱电解质的电离。
例如:在醋酸的电离平衡CH3COOH CH3COO-+H+A 加水稀释,平衡向正向移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小;B 加入少量冰醋酸,平衡向正向移动,c(CH3COOH)、c(H+)、c(CH3COO-)均增大但电离程度小;③外加相关物质(同离子效应)例如:0.1 mol/L的CH 3COOH溶液CH3COOH CH3COO-+ H+向其中加入CH3COONa固体,溶液中c(CH3COO-)增大,CH3COOH的电离平衡向左移动,电离程度减小,c(H+)减小,pH增大。

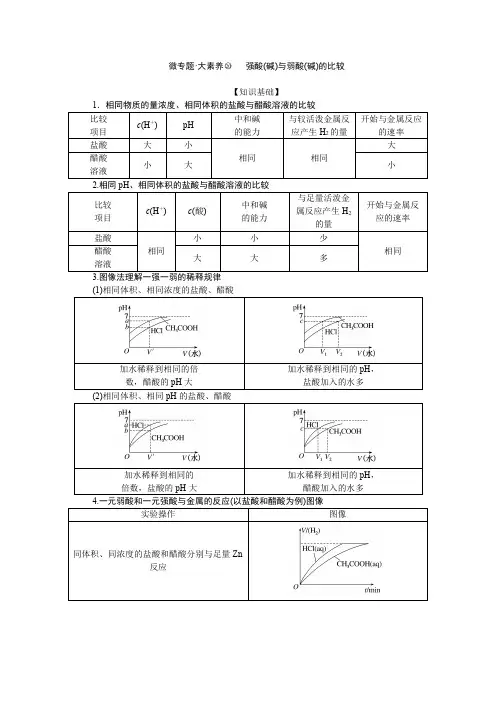
微专题·大素养○20强酸(碱)与弱酸(碱)的比较【知识基础】1.相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较比较项目c (H +)pH 中和碱的能力与较活泼金属反应产生H 2的量开始与金属反应的速率盐酸大小相同相同大醋酸溶液小大小2.相同pH 、相同体积的盐酸与醋酸溶液的比较比较项目c (H +)c (酸)中和碱的能力与足量活泼金属反应产生H 2的量开始与金属反应的速率盐酸相同小小少相同醋酸溶液大大多3.图像法理解一强一弱的稀释规律(1)相同体积、相同浓度的盐酸、醋酸加水稀释到相同的倍数,醋酸的pH 大加水稀释到相同的pH ,盐酸加入的水多(2)相同体积、相同pH 的盐酸、醋酸加水稀释到相同的倍数,盐酸的pH 大加水稀释到相同的pH ,醋酸加入的水多4.一元弱酸和一元强酸与金属的反应(以盐酸和醋酸为例)图像实验操作图像同体积、同浓度的盐酸和醋酸分别与足量Zn反应同体积、同pH的盐酸和醋酸分别与足量Zn反应微点拨“成语法”巧记溶液酸碱性的变化(1)温度恒定时,改变其他条件,溶液中c(H+)和c(OH-)的变化规律遵循“此起彼伏”或“此消彼长”的规律,因为c(H+)·c(OH-)=K w为定值。
如稀释CH3COOH溶液时,c(OH -)随c(H+)减小而增大。
(2)常温时,pH之和为14的强碱溶液与弱酸溶液(或强酸溶液与弱碱溶液)等体积混合,溶液的酸碱性遵循“以弱胜强”的规律,如pH=2的CH3COOH溶液和pH=12的NaOH 溶液等体积混合,溶液显酸性,其实质是弱酸过量。
(3)等浓度、等体积的一元强碱溶液与一元弱酸溶液(或一元弱碱溶液与一元强酸溶液)混合,溶液的酸碱性遵循“恃强凌弱”的规律。
如等浓度、等体积的烧碱溶液与CH3COOH 溶液混合,溶液显碱性,其实质是CH3COOH与NaOH恰好完全反应,CH3COO-发生水解。
5.证明弱电解质的实验方法实验方法结论(1)常温下测定0.01mol·L-1HA的pH若pH>2,则HA为弱酸(2)常温下测NaA的pH若pH>7,则HA为弱酸(3)相同条件下,测等体积、等浓度的HA溶液和盐酸的导电能力若HA溶液的导电能力比盐酸弱,则HA为弱酸(4)测相同pH的HA溶液与盐酸稀释相同倍数前后的pH变化若稀释前后HA溶液的pH变化小,则HA为弱酸(5)测等体积、等pH的HA溶液与盐酸分别与足量Zn反应产生H2的快慢及H2的量若HA溶液与Zn反应过程中产生H2较快且最终生成H2的量较多,则HA为弱酸(6)测等体积、等pH的HA溶液和盐酸溶液中和等浓度NaOH溶液所消耗的NaOH溶液的体积若HA溶液消耗NaOH溶液体积较大,则HA 为弱酸(7)测升高温度后HA溶液pH的变化若溶液的pH明显减小,则HA为弱酸【专题精练】1.下列事实中不能证明CH3COOH是弱电解质的是()A.常温下某CH3COONa溶液的pH=8B.常温下0.1mol·L-1CH3COOH溶液的pH=2.8C.向CH3COOH溶液中加入少量CH3COONa固体,溶解后溶液的pH变大D.0.1mol·L-1的乙酸溶液与同体积0.1mol·L-1的氢氧化钠溶液恰好反应2.25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。

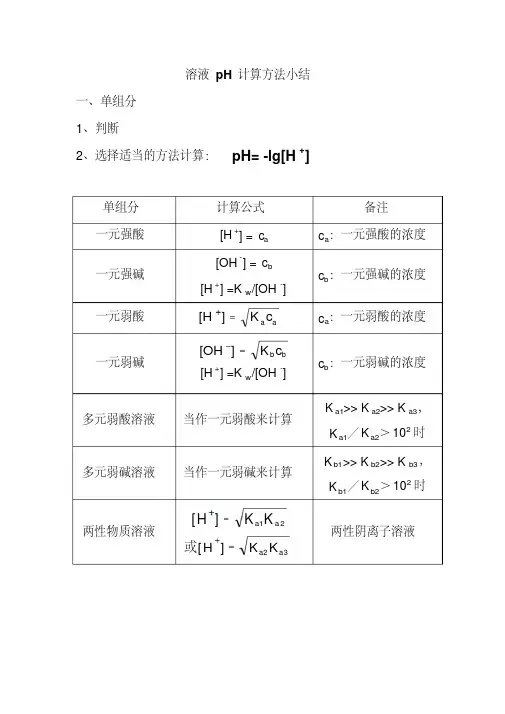

计算一元弱酸或弱碱溶液ph值的新公式PH值计算公式
1. 对于强酸:
PH = -log[H^+]
2. 对于弱酸:
PH = -log[(H^{+})(A^{-})^{Ka}]
3. 对于强碱:
PH = 14 - log[OH^-]
4. 对于弱碱:
PH = 14 + log[(OH^{-}) (B^{+})^{Kb}]
以上是确定一元弱酸或弱碱溶液PH值所用的公式。
弱酸的pH值,需要使用此公式:
PH = -log[(H^{+})(A^{-})^{Ka}], 其中Ka是弱酸的平衡常数;
而弱碱溶液的PH值,需要使用另一个公式:
PH = 14 + log[(OH^{-}) (B^{+})^{Kb}], 其中Kb是弱碱的平衡常数。
为了计算一元弱酸或弱碱溶液的PH值,需要先知晓相应分子式、以及这些分子式形成不同有机物时,酸性和碱性的反应强度(即用平衡常数K表示,如Ka和Kb),才能使用以上公式正确的计算出PH值。
例如一种典型的弱碱,乙醇氮基聚磷酸盐(EDTP),它的平衡常数
Kb为7.4×10-9,此时,我们可以使用公式14 + log[(OH^{-}) (B^{+})^{Kb}]计算,其PH值为9.225。



【学习目标】1、 理解弱电解质电离平衡的建立和电离平衡的特征;2、 掌握影响电离平衡移动的因素;3、 掌握电离平衡常数和电离度的概念,并能用平衡常数讨论弱电解质的电离平衡。
【学习重难点】影响电离平衡移动的因素、电离平衡常数 【课时安排】 1课时 【学习过程】一、弱电解质电离平衡的建立 在一定条件下(如:温度、压强),当弱电解质电离成离子的速率和离子重 新结合成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。
二、电离平衡的特征电离平衡是化学平衡的一种,因此同样具有“ ”、“ ”、“ ”、“ ”的特征。
三、电离平衡常数和电离度1、电离平衡常数是指在一定条件下,弱电解质在溶液中达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值。
HA H + + A -()()()HA c H c c K +⋅=-A注:(1)在此计算公式中,离子浓度都是平衡浓度;(2)电离平衡常数的数值与温度有关,与浓度无关;弱电解质的电离是吸热的,一般温度越高,电离平衡常数越 (填“大”或“小”);(3)电离平衡常数反映弱电解质的相对强弱,通常用K a 表示弱酸的电离平衡常数,用K b 表示弱碱的电离平衡常数。
K a 越大,弱酸的酸性越强;K b 越大,弱碱的碱性越强。
多元弱酸是分布电离的,每一级电离都有相应的电离平衡常数(用K a1、K a2等表示),且电离平衡常数逐级减小。
2、电离度%100⨯=弱电解质的初始浓度已电离的弱电解质浓度α注:弱电解质的电离度与溶液的浓度有关,一般而言,浓度越大,电离度越小 ;浓度越小,电离度越大。
四、影响弱电解质电离平衡移动的因素1、浓度:弱电解质的溶液中,加水稀释,电离平衡正移,电离度增大。
即稀释 (填“促进”或“抑制”)电离。
思考:此规律用电离平衡常数如何解释?2、温度:因为电离是吸热的,因此升温 (填“促进”或“抑制”)电离。
3、加入其它电解质(1)加入与弱电解质电离出的离子相同的离子,电离平衡 移动,电离度 ; (2)加入与弱电解质电离出的离子反应的离子,电离平衡 移动,电离度 。
高中化学所有的强酸,中强酸,弱酸篇一:常见的弱酸、中强酸、强酸、弱碱、强碱常见的弱酸:H2CO3(碳酸)、HF(氢氟酸,较少见)、CH3COOH(也作C2H4O2乙酸,又叫醋酸)、H2S(氢硫酸)、HClO(次氯酸)、HNO2(亚硝酸,较少见)、中学范围内的所有的有机酸(中学不学习有机强酸)、H2SO3也为弱酸常见的中强酸:磷酸,草酸,甲酸常见的强酸:硫酸H2SO4, 盐酸HCl , 硝酸HNO3 ,氢溴HBr, 氢碘酸HI,高氯酸HClO4常见的弱碱:Mg(OH)2、Al(OH)3、Zn(OH)2、F(转载于: 小龙文档网:高中化学所有的强酸,中强酸,弱酸)e(OH)3、Fe(OH)2、Cu(OH)2、NH3.H2O(其中只有NH3.H2O易溶于水。
)常见的强碱:KOH NaOH Ba(OH)2 Ca(OH)2篇二:高中化学三大强酸总结三大强酸一、HCl与盐酸1、物理性质HCl:无色有刺激性气味的气体,极易溶于水(1: 500)。
盐酸:HCl的水溶液,无色,具挥发性。
常见的浓盐酸的质量分数约为37%,物质的量浓度约为12 mol/L,具有强挥发性。
工业盐酸略显黄色(含Fe3+)。
2、化学性质(1)酸性一元强酸HCl=H++Cl-非氧化性酸(2)与NH3反应NH3 +HCl= NH4Cl现象:产生大量白烟应用:用于NH3 和HCl的互检(用蘸有浓氨水或浓盐酸的玻璃棒靠近集气瓶口)3、HCl的实验室制法(1) 制备:NaCl(s) + H2SO4 (浓) NaHSO4 + HCl↑NaCl(s) + H2SO4 (浓) Na2SO4 + HCl↑原理:高沸点酸(难挥发酸)制低沸点酸(易挥发酸)注意:因氯化氢在水中的溶解度大,不能用溶液间的反应来制取。
(2) HCl的收集:向上排空气法;(3) HCl的尾气处理:用水做吸收剂,防倒吸(4) HCl的检验:蘸有浓氨水的玻璃棒靠近集气瓶口(冒白烟)4、Cl- 的检验HNO3酸化的AgNO3原理:Ag+ + Cl- = AgCl↓5、生活中的盐酸:胃酸,胃酸过多吃胃药,含Al(OH)3二、硫酸(重点)1、物理性质无色油状液体(高中无机物中唯一一种无色油状液体),常见的浓硫酸质量分数为98%,物质的量浓度为18.4 mol/L ,沸点为338℃,是一种高沸点难加热微热挥发的酸。
高中化学酸解离度计算题解策略高中化学中,酸解离度计算是一个重要的考点。
掌握解题策略,可以帮助学生提高解题效率,更好地理解和应用相关知识。
本文将介绍一些常见的酸解离度计算题目,并提供解题策略,希望能对高中学生及其家长有所帮助。
一、酸解离度的概念和计算公式酸解离度是指酸分子在溶液中解离成离子的程度,通常用解离度α表示。
对于一元强酸(如HCl),其解离度等于离子浓度与酸的初始浓度之比;对于一元弱酸(如CH3COOH),其解离度等于离子浓度与酸的初始浓度之比的平方。
一般来说,酸解离度的计算公式为:α = [H+]/[HA]其中,[H+]表示氢离子浓度,[HA]表示酸的初始浓度。
二、强酸的解离度计算强酸的解离度计算相对简单,只需根据酸的初始浓度和离子浓度的关系进行计算。
例如,有一瓶浓度为0.1mol/L的HCl溶液,求其解离度。
根据公式,解离度α等于[H+]/[HA],而强酸完全解离,所以[H+]的浓度等于酸的初始浓度,即0.1mol/L。
因此,解离度α等于1。
三、弱酸的解离度计算对于弱酸的解离度计算,需要考虑到酸的解离平衡反应。
例如,有一瓶浓度为0.1mol/L的CH3COOH溶液,求其解离度。
首先,根据公式,解离度α等于[H+]/[HA]的平方。
其次,需要根据酸的解离平衡反应写出平衡常数表达式。
CH3COOH ⇌ CH3COO- + H+平衡常数Kc等于[H+][CH3COO-]/[CH3COOH]。
根据酸解离度的定义,[H+]等于α×[HA],[CH3COO-]等于α×[HA],[CH3COOH]等于(1-α)×[HA]。
将这些代入平衡常数表达式中,可以得到:Kc = α×α×[HA]/[(1-α)×[HA]] = α²/ (1-α)由于酸的解离度很小,即α≪1,可以将1-α近似为1,简化计算公式:Kc ≈ α²根据题目中给出的酸的初始浓度,代入上述公式即可计算出解离度α的近似值。
化学学科教案设计授课班级课时安排3课时授课人课题弱电解质的电离课型复习课教学目标分析大纲要求(1)了解电解质的概念。
了解强电解质和弱电解质的概念。
(2)理解电解质在水中的电离以及电解质溶液的导电性。
(3)理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
知识目标掌握电离平衡及影响因素德育目标培养学生爱党爱国的情操重、难点阐释(1)影响电离平衡的因素(2)电离常数的计算(3)强酸与弱酸的比较学法指导讲练结合教具设计教学过程问题引导二次备课第一课时弱电解质的电离一、掌握电离方程式的书写1.弱电解质(1)一元弱酸,如CH3COOH:(2)多元弱酸,如H2CO3:(3)多元弱碱,如Fe(OH)3:2.酸式盐如NaHSO4:NaHCO3:二、理解电离平衡的建立及其特征1.电离平衡的建立2.电离平衡的特征:逆动等定变[基点小练]1.判断正误(正确的打“√”,错误的打“×”)。
(1)弱电解质溶液中存在溶质分子,而强电解质溶液中不存在溶质分子(√)(2)AgCl的水溶液不导电,而CH3COOH的水溶液能导电,故AgCl是弱电解质,CH3COOH是强电解质(×)(3)由0.1 mol·L-1氨水的pH为11,可知溶液中存在NH3·H2O NH+OH-(√)(4)弱电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度一定相等(×)三、外界条件对电离平衡的影响1.外界条件对电离平衡的影响以CH3COOHH++CH3COO-ΔH>0为例改变条件平衡移动方向n(H+) c(H+) 导电能力Ka 加水稀释→增大减小减弱不变加入少量冰醋酸→增大增大增强不变通入HCl(g) ←增大增大增强不变加入NaOH(s) →减小减小增强不变加入镁粉→减小减小增强不变升高温度→增大增大增强增大2.外界条件对电离平衡影响的四个不一定(1)稀醋酸加水稀释时,溶液中不一定所有的离子浓度都减小。
一元强酸和一元弱酸的比较应用
在学习《电离平衡》时,经常会碰到比较强酸和弱酸的各项指标的大小问题,而一元强酸和一元弱酸的比较问题是最基础的问题,它也是多元强酸和多元弱酸比较问题的理论基础。
所以,有必要把一元强酸和一元弱酸进行详细的对比和分析,找出其中的规律,以便更快更好地解决类似的问题。
现把“同体积、等物质的量浓度的一元强酸和一元弱酸”以及“同体积、H+的物质的量浓度相等(即PH相同)的一元强酸和一元弱酸”进行比较,找出其中的规律。
以盐酸和醋酸为例。
一、总结规律
1、同体积、等物质的量浓度的盐酸和醋酸
2、同体积、H+的物质的量浓度相等(即PH相同)的盐酸和醋酸
二、学以致用
1、形状形同、质量相等的两份锌粒分别加入相同物质的量浓度、相同体积的稀盐酸、稀醋酸(两种酸均足量)中,开始时生成的气体的速率谁大?____ ___ 。
原因是__ _ ___ ____ 。
反应完毕后,两者生成气体的体积谁大?________ 。
原因是________________ 。
2、c(H+)相同的盐酸溶液和醋酸溶液分别和锌反应,若最后锌都已完全溶解,且放出的气体一样多,则下列判断正确的是()。
A、整个反应阶段的平均速率:CH3COOH>HCl
B、反应所需时间:CH3COOH>HCl
C、参加反应的锌的质量:HCl>CH3COOH
D、开始反应速率:HCl>CH3COOH
3、中和c(H+)相同、体积相同的H2SO4 、HCl 和CH3COOH溶液,耗用同一浓度的NaOH 溶液,体积分别为V1、V2和V3 ,则V1、V2和V3的关系正确的是()。
A、V1>V2=V3
B、V3>V2=V1
C、V1>V2>V3
D、V1=V2=V3。