一元强酸有一元弱酸的比较
- 格式:doc
- 大小:43.50 KB
- 文档页数:3

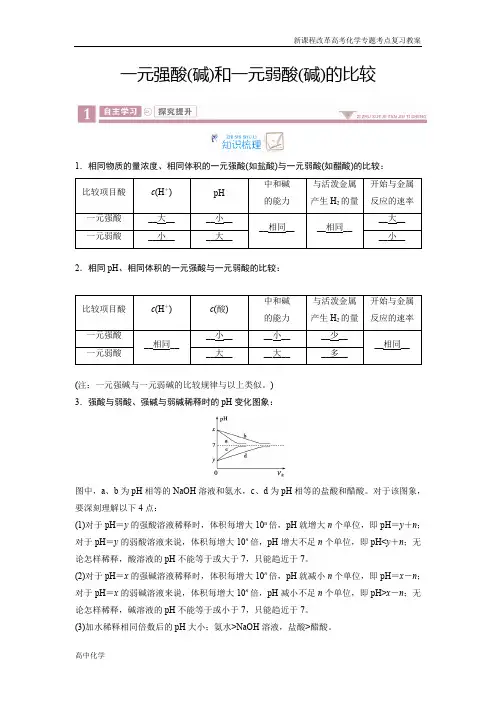
一元强酸(碱)和一元弱酸(碱)的比较1.相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较:比较项目酸c(H+)pH 中和碱的能力与活泼金属产生H2的量开始与金属反应的速率一元强酸__大____小____相同____相同____大__一元弱酸__小____大____小__ 2.相同pH、相同体积的一元强酸与一元弱酸的比较:比较项目酸c(H+)c(酸)中和碱的能力与活泼金属产生H2的量开始与金属反应的速率一元强酸__相同____小____小____少____相同__一元弱酸__大____大____多__(注:一元强碱与一元弱碱的比较规律与以上类似。
)3.强酸与弱酸、强碱与弱碱稀释时的pH变化图象:图中,a、b为pH相等的NaOH溶液和氨水,c、d为pH相等的盐酸和醋酸。
对于该图象,要深刻理解以下4点:(1)对于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n;对于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n个单位,即pH<y+n;无论怎样稀释,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于pH=x的强碱溶液稀释时,体积每增大10n倍,pH就减小n个单位,即pH=x-n;对于pH=x的弱碱溶液来说,体积每增大10n倍,pH减小不足n个单位,即pH>x-n;无论怎样稀释,碱溶液的pH不能等于或小于7,只能趋近于7。
(3)加水稀释相同倍数后的pH大小;氨水>NaOH溶液,盐酸>醋酸。
(4)稀释后的pH 仍然相等,则加水量的多少:氨水>NaOH 溶液,醋酸>盐酸。
4.判断弱酸的三种方法方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L -1的CH 3COOH溶液的pH>1。
方法二;根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH =1的CH 3COOH 加水稀释10倍后,1<pH<2。

弱电解质的电离平衡考点归纳弱电解质电离平衡是电解质理论的基础,也是中学化学基本理论中的重要组成部分,近几年高考命题中反复考查。
在学生已经学过化学平衡理论并了解电解质在水溶液中发生电离和离子间发生反应等知识的基础上,进一步学习弱电解质的电离平衡。
高考命题的热点主要有影响弱电解质电离平衡因素,通过图象分析弱电解质和强电解质,电离常数和电离度等,为了更好的学习这一部分内容,本文做了详细的总结和归纳,希望对同学们的学习有所启发,达到触类旁通的效果。
一、弱电解质电离平衡1.电离平衡概念一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态,简称电离平衡。
任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质在该条件下的电离程度最大。
2.电离平衡的特征电解质的电离平衡属于化学平衡中的一种形式,具有以下一些特征:“逆”——弱电解质的电离是可逆的,存在电离平衡“动”——电离平衡是动态平衡“等”——v(=v(分子化)≠0离子化)“定”——达到电离平衡状态时,溶液中分子和离子的浓度保持不变,是一个定值“变”——电离平衡是相对的,外界条件改变时,平衡被破坏,发生移动形成新的平衡。
二、影响弱电解质电离平衡的因素(符合勒?夏特列原理)1.内因:弱电解质本身的性质,是决定性因素。
2.外因①温度: 升高温度,由于电离过程吸热,平衡向电离方向移动,电离程度增大。
②浓度: 加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。
因为溶液浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大;所以,稀释溶液会促进弱电解质的电离。
例如:在醋酸的电离平衡CH3COOH CH3COO-+H+A 加水稀释,平衡向正向移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小;B 加入少量冰醋酸,平衡向正向移动,c(CH3COOH)、c(H+)、c(CH3COO-)均增大但电离程度小;③外加相关物质(同离子效应)例如:0.1 mol/L的CH 3COOH溶液CH3COOH CH3COO-+ H+向其中加入CH3COONa固体,溶液中c(CH3COO-)增大,CH3COOH的电离平衡向左移动,电离程度减小,c(H+)减小,pH增大。
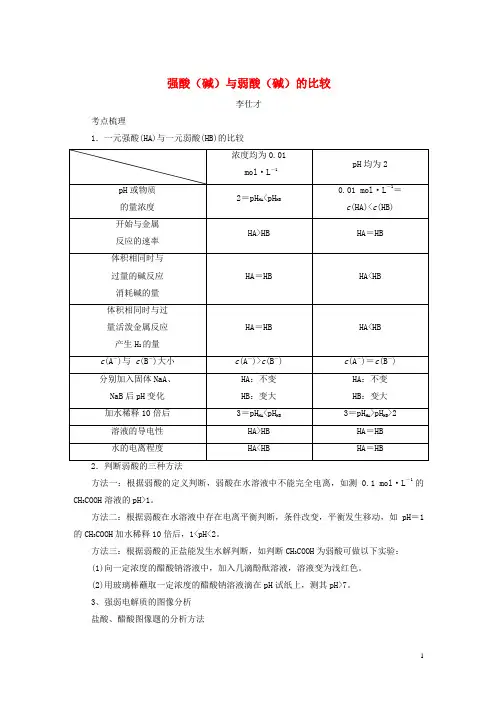
强酸(碱)与弱酸(碱)的比较李仕才考点梳理1.一元强酸(HA)与一元弱酸(HB)的比较方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
方法二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释10倍后,1<pH<2。
方法三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可做以下实验:(1)向一定浓度的醋酸钠溶液中,加入几滴酚酞溶液,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
3、强弱电解质的图像分析盐酸、醋酸图像题的分析方法(1)相同体积、相同浓度的盐酸、醋酸①加水稀释相同的倍数,醋酸的pH大。
②加水稀释到相同的pH,盐酸加入的水多。
(2)相同体积、相同pH的盐酸、醋酸①加水稀释相同的倍数,盐酸的pH大。
②加水稀释到相同的pH,醋酸加入的水多。
(3)不论怎样稀释,酸溶液的pH不能等于或大于7,碱溶液的pH不能等于或小于7,都只能趋近于7。
考向分析:考向一、强酸和弱酸(碱)的判断典例1、下列事实一定能说明HNO2为弱电解质的是()①常温下,NaNO2溶液的pH>7②用HNO2溶液做导电实验灯泡很暗③HNO2不能与NaCl反应④常温下0.1 mol·L-1的HNO2溶液pH=2⑤1 L pH=1的HNO2溶液加水稀释至100 L后溶液的pH=2.2⑥1 L pH=1的HNO2和1 L pH=1的盐酸与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH 溶液多⑦HNO2溶液中加入一定量NaNO2晶体,溶液中[OH-]增大⑧HNO2溶液中加水稀释,溶液中[OH-]增大A.①②③⑦ B.①③④⑤C.①④⑤⑥⑦ D.②④⑥⑧解析:②如果盐酸(强酸)的浓度很小灯泡也很暗;④如果是强酸,pH=1;⑤如果是强酸,加水稀释至100 L后溶液的pH=3,实际pH=2.2,这说明HNO2溶液中存在HNO2H++NO-2,加水平衡右移,使pH<3;⑥依据HNO2+NaOH===NaNO2+H2O、HCl+NaOH===NaCl+H2O可知,[HNO2]大于[HCl],而溶液中[H+]相同,所以HNO2没有全部电离;⑦加入NaNO2,溶液中[OH-]增大,说明化学平衡移动;⑧不论是强酸;还是弱酸,加水稀释,溶液中[H+]均减小,而[OH-]增大。


一元强酸和一元弱酸考点辨析作者:王雪玲柴俊俊来源:《速读·上旬》2014年第09期在中学化学教学过程中对于一元强酸和一元弱酸的考点,如在物质的量浓度的大小、C (H+)的大小、与活泼金属反应的速率、中和碱的能力、加水稀释等考点,对此学生经常搞不清,而强弱电解质的电离是高中化学的重点和难点,也是高考的热点。
现以作为一元强酸和一元弱酸代表的盐酸、醋酸为例对这几个方面进行归纳总结如下:1物质的量浓度相同的盐酸和醋酸性质的比较(1)C(H+)的大小:因为盐酸是全部电离,而醋酸是部分电离。
故盐酸的C(H+)大于醋酸。
(2)与活泼金属反应的速率:在其他条件相同的情况下,活泼金属与酸反应的速率主要取决于溶液中C(H+)的大小。
开始时盐酸的C(H+)大于醋酸,盐酸的反应速率较大,随着反应的进行两者的反应速率都逐渐减小,但醋酸减小的较慢,因为醋酸还有一个促进电离的过程。
故随着反应的进行,醋酸的反应速率逐渐大于盐酸。
(3)中和碱的能力:中和等物质的量的NaOH时,由于物质的量浓度相同,则需盐酸的体积和醋酸的体积相同。
也就是说物质的量相同的盐酸和醋酸其中和等物质的量的碱的能力是相同,至于反应后溶液的酸碱性则是由生成盐的性质来决定的。
(4)产生氢气的量:氢气的量由溶液中n(H+)的大小决定的,所以当溶液的体积相等时,两者产生的氢气量相同。
(5)加水稀释时:当稀释相同倍数后盐酸溶液中C(H+)大于醋酸,当稀释后要使两者C(H+)相同则盐酸中加水量比醋酸中要多。
(考虑物质的量浓度相同时醋酸是部分电离)2 PH相同的盐酸和醋酸的性质比较(1)物质的量浓度:PH相同即C(H+)相同,由于盐酸是全部电离,而醋酸是部分电离,所以盐酸的浓度远小于醋酸。
(2)与活泼金属反应的速率:开始时由于盐酸和醋酸的C(H+)相同,则与活泼金属反应时开始的反应速率是相同的。
但在整个反应过程中醋酸的反应速率减小得较慢,故醋酸的反应速率大于盐酸,即制取相同体积的气体,醋酸的用的时间少。
word格式-可编辑-感谢下载支持
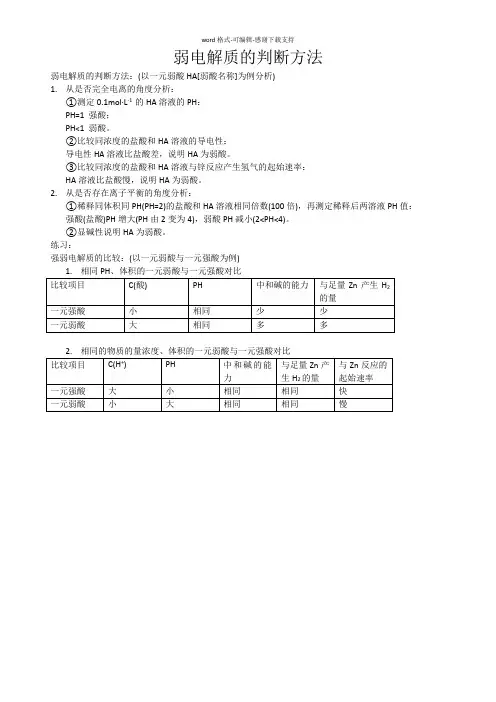
弱电解质的判断方法
弱电解质的判断方法:(以一元弱酸HA[弱酸名称]为例分析)
1.从是否完全电离的角度分析:
①测定0.1mol·L-1 的HA溶液的PH:
PH=1 强酸;
PH<1 弱酸。
②比较同浓度的盐酸和HA溶液的导电性:
导电性HA溶液比盐酸差,说明HA为弱酸。
③比较同浓度的盐酸和HA溶液与锌反应产生氢气的起始速率:
HA溶液比盐酸慢,说明HA为弱酸。
2.从是否存在离子平衡的角度分析:
①稀释同体积同PH(PH=2)的盐酸和HA溶液相同倍数(100倍),再测定稀释后两溶液PH值:
强酸(盐酸)PH增大(PH由2变为4),弱酸PH减小(2<PH<4)。
②显碱性说明HA为弱酸。
练习:
强弱电解质的比较:(以一元弱酸与一元强酸为例)。

2019届高考过关知识点10一元强酸(碱)和一元弱酸(碱)的比较命题点1一元强酸(碱)和一元弱酸(碱)的一般性质比较(1)相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(2)相同pH、相同体积的一元强酸与一元弱酸的比较说明:一元强碱与一元弱碱的比较规律与以上类似。
[对点训练1]相同温度下,关于物质的量浓度、体积均相等的①NaOH溶液,②氨水,说法正确的是()A、[OH-]:①〉②B、pH:①=②C、导电性:①<②D、中和酸的能力:①〉②A[pH:①〉②,导电性:①>②,中和酸的能力:①=②。
][对点训练2] 25 ℃下,在①pH=2的CH3COOH溶液、②pH=2的HCl 溶液、③pH=12的氨水、④pH=12的NaOH溶液中,下列说法正确的是________(填字母)。
A、等体积的①、②分别与足量铝粉反应,生成H2的量:②>①B。
将等体积①②加水稀释至pH=4,加水较多的是②C、若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③D。
将四种溶液分别稀释100倍后,溶液的pH:③〉④>②〉①E、将等体积的③、④加H2O稀释100倍,pH较大的为③F、将等体积的③④加等浓度盐酸中和,所需盐酸的体积相同[答案]CDE[对点训练3]相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是()C[相同体积、相同pH的某一元强酸和一元弱酸中,H+浓度相等,因此刚开始与锌反应的速率是相同的,随着反应的进行,弱酸接着电离,故反应速率较强酸快,排除B、D;又因弱酸的物质的量浓度大于强酸,因此与足量的锌反应生成氢气的量较多,排除A项、]一元弱酸和一元强酸与金属的反应图中,a、b为pH相等的NaOH溶液和氨水,c、d为pH相等的盐酸和醋酸、关于该图像,要深刻理解以下4点:(1)关于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n;关于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n个单位,即pH〈y+n;不管如何稀释,酸溶液的pH不能等于或大于7,只能趋近于7。

一元强酸和一元一元弱酸的比较应用在学习《电离平衡》时,经常会碰到比较强酸和弱酸的各项指标的大小问题,而一元强酸和一元弱酸的比较问题是最基础的问题,它也是多元强酸和多元弱酸比较问题的理论基础。
所以,有必要把一元强酸和一元弱酸进行详细的对比和分析,找出其中的规律,以便更快更好地解决类似的问题。
现把“同体积、等物质的量浓度的一元强酸和一元弱酸”以及“同体积、H+的物质的量浓度相等(即PH相同)的一元强酸和一元弱酸”进行比较,找出其中的规律。
以盐酸和醋酸为例。
一、总结规律1、同体积、等物质的量浓度的盐酸和醋酸H+的物质的量浓度C(H+)酸性强弱中和碱的能力(消耗相同的碱液的多少)与相同的活泼金属反应的起始速率产生H2的总量HCl大强相同大相等CH3COOH小弱小2、同体积、H+的物质的量浓度相等(即PH相同)的盐酸和醋酸溶质的物质的量浓度C(酸)酸性强弱中和碱的能力(消耗相同的碱液的多少)与相同的活泼金属反应过程中的平均速率产生H2的总量HCl小相同弱小少CH3COOH大强大多二、学以致用1、形状形同、质量相等的两份锌粒分别加入相同物质的量浓度、相同体积的稀盐酸、稀醋酸(两种酸均足量)中,开始时生成的气体的速率谁大?____ ___ 。
原因是_________________________ 。
反应完毕后,两者生成气体的体积谁大?________ 。
原因是___________________________ 。
〔答案〕HCl HCl是强电解质完全电离,而CH3COOH是弱电解质部分电离,故盐酸中的c(H+)大于CH3COOH。
相同盐酸和醋酸所提供的H+的物质的量相等且都过量,故产生的H2的体积必定相等。
〔解析〕根据规律1可知:盐酸的速率大,两者生成的气体体积相等。
因为盐酸是强电解质,完全电离,但它们所含有的H+的物质的量相等且均足量。
2、c(H+)相同的盐酸溶液和醋酸溶液分别和锌反应,若最后锌都已完全溶解,且放出的气体一样多,则下列判断正确的是()。

【学习目标】1、 理解弱电解质电离平衡的建立和电离平衡的特征;2、 掌握影响电离平衡移动的因素;3、 掌握电离平衡常数和电离度的概念,并能用平衡常数讨论弱电解质的电离平衡。
【学习重难点】影响电离平衡移动的因素、电离平衡常数 【课时安排】 1课时 【学习过程】一、弱电解质电离平衡的建立 在一定条件下(如:温度、压强),当弱电解质电离成离子的速率和离子重 新结合成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。
二、电离平衡的特征电离平衡是化学平衡的一种,因此同样具有“ ”、“ ”、“ ”、“ ”的特征。
三、电离平衡常数和电离度1、电离平衡常数是指在一定条件下,弱电解质在溶液中达到平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值。
HA H + + A -()()()HA c H c c K +⋅=-A注:(1)在此计算公式中,离子浓度都是平衡浓度;(2)电离平衡常数的数值与温度有关,与浓度无关;弱电解质的电离是吸热的,一般温度越高,电离平衡常数越 (填“大”或“小”);(3)电离平衡常数反映弱电解质的相对强弱,通常用K a 表示弱酸的电离平衡常数,用K b 表示弱碱的电离平衡常数。
K a 越大,弱酸的酸性越强;K b 越大,弱碱的碱性越强。
多元弱酸是分布电离的,每一级电离都有相应的电离平衡常数(用K a1、K a2等表示),且电离平衡常数逐级减小。
2、电离度%100⨯=弱电解质的初始浓度已电离的弱电解质浓度α注:弱电解质的电离度与溶液的浓度有关,一般而言,浓度越大,电离度越小 ;浓度越小,电离度越大。
四、影响弱电解质电离平衡移动的因素1、浓度:弱电解质的溶液中,加水稀释,电离平衡正移,电离度增大。
即稀释 (填“促进”或“抑制”)电离。
思考:此规律用电离平衡常数如何解释?2、温度:因为电离是吸热的,因此升温 (填“促进”或“抑制”)电离。
3、加入其它电解质(1)加入与弱电解质电离出的离子相同的离子,电离平衡 移动,电离度 ; (2)加入与弱电解质电离出的离子反应的离子,电离平衡 移动,电离度 。

电离平衡状态及特征归纳与分析要点一、影响电离平衡的因素。
当溶液的温度、浓度以及离子浓度改变时,电离平衡都会发生移动,符合勒夏特列原理,其规律是:1、浓度:浓度越大,电离程度越小。
在稀释溶液时,电离平衡向右移动,而离子浓度会减小。
2、温度:温度越高,电离程度越大。
因电离过程是吸热过程,升温时平衡向右移动。
3、同离子效应:如在醋酸溶液中加入醋酸钠晶体,增大了CH3COO-浓度,平衡左移,电离程度减小;加入稀HCl,平衡也会左移,电离程度也减小。
4、能反应的物质:如在醋酸溶液中加入锌或NaOH溶液,平衡右移,电离程度增大。
要点诠释:使弱酸稀释和变浓,电离平衡都向右移动,这二者之间不矛盾。
我们可以把HA的电离平衡HA H++A-想象成一个气体体积增大的化学平衡:A(g)B(g)+C(g),稀释相当于增大体积,A、B、C的浓度同等程度地减小即减小压强,平衡向气体体积增大的方向移动,B、C的物质的量增加但浓度减小,A的转化率增大;变浓则相当于只增大A的浓度,v(正)加快使v(正)>v (逆),平衡向正反应方向移动,A、B、C的物质的量和浓度均增大,但A的转化率降低了,A的物质的量分数增大了而B、C的物质的量分数减小了。
A的转化率即相当于弱酸的电离程度。
要点二、电离平衡常数1.概念:在一定条件下,弱电解质的电离达到平衡时,弱电解质电离形成的各种离子的浓度的乘积跟溶液中未电离的分子的浓度的比值是—个常数,这个常数叫做电离平衡常数。
用K表示。
2.数学表达式。
对一元弱酸(HA):HA H++A-。
对一元弱碱(BOH):BOH B++OH-。
3.K的意义:K值越大,表示该弱电解质越易电离,所对应的弱酸(弱碱)越强。
从K a和K b的大小,可以判断弱酸和弱碱的相对强弱,例如弱酸的相对强弱:H2SO3(K a1=1.5×10-2)>H3PO4(K a1=7.5×10-3)>HF(K a=3.5×10-4)>H2S(K a1=9.1×10-8)。
高二化学电离水解知识点整理高二化学电离水解知识点整理高二化学电离水解部分Believeinyourself电离平衡一.相关概念酸碱电解质:熔融状态或水溶液中能导电的化合物盐一部分氧化物一部分有机物:C2H5OH乙醇非电解质:熔融状态或水溶液中都不能导电的化合物C12H22O11蔗糖CCl4四氯化碳强酸:HCl、H2SO4、HNO3、HClO4强电解质2强碱:NaOH、KOH、Ba(OH)绝大多数盐:NaCl、NH4NO3、NH4HCO3电解质弱酸:HNO3、HAc、HClO、HF、H2S、H2SiO3、H3PO4、H2SO3弱电解质弱碱:NH3`H2O少数盐:HgCl2、Pb(CH3COO)2一元强酸与一元弱酸的比较①相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较一元强酸一元弱酸C(H+)大小pH小大中和碱的能力相同与活泼金属反应生成H2相同与活泼金属反应的υ(始)大小②相同pH、相同体积的一元强酸与一元弱酸的比较见下表:一元强酸一元弱酸1C(H+)相同pH小大中和碱的能力小大与活泼金属反应生成H2小大与活泼金属反应的υ(始)相同弱电解质的电离平衡1.概念在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。
2.特征(动态平衡)(1)逆:可逆反应(2)动:动态平衡(3)等v(离子化)==v(分子化)≠0(4)定:平衡时溶液中离子、分子浓度保持不变。
(5)变:条件改变,平衡可能发生移动。
3.影响因素(1)浓度:浓度越大,电离程度越小。
在稀释溶液时,电离平衡向右移动,而离子浓度一般会减小。
(2)温度:温度越高,电离程度越大。
因电离是吸热的,升温平衡向吸热方向(电离方向)移动。
(3)同离子效应:醋酸溶液中加人醋裁钠晶体,平衡左移,电离程度减小,加人稀盐酸亦然。
(4)能反应的离子:醋酸溶液中加人NaOH,平衡右移,电离程度增大。
第2课时 电离平衡常数 强酸与弱酸比较一、电离平衡常数1.概念 在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K 表示。
2.电离平衡常数的表示方法AB A ++B - K =c (A +)·c (B -)c (AB ) (1)一元弱酸、一元弱碱的电离平衡常数。
例如:CH 3COOHCH 3COO -+H + K a =c (CH 3COO -)·c (H +)c (CH 3COOH )NH 3·H 2ONH +4+OH - K b =c (NH +4)·c (OH -)c (NH 3·H 2O )(2)多元弱酸、多元弱碱的电离平衡常数。
多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K 1、K 2等来分别表示。
例如, H 2CO 3H ++HCO -3 K a1=c (HCO -3)·c (H +)c (H 2CO 3); HCO -3H ++CO 2-3 K a2=c (H +)·c (CO 2-3)c (HCO -3)。
多元弱酸各步电离常数的大小比较为K a1≫K a2,因此,多元弱酸的酸性主要由第一步电离决定。
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
3.意义表示弱电解质的电离能力。
一定温度下,K 值越大,弱电解质的电离程度越大,酸(或碱)性越强。
4.电离常数的影响因素(1)内因:同一温度下,不同的弱电解质的电离常数不同,说明电离常数首先由物质的本性所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与温度有关,由于电离为吸热过程,所以电离平衡常数随温度升高而增大。
5.电离常数的计算——三段式法例:25 ℃ a mol·L -1的CH 3COOHCH 3COOH CH 3COO -+H +起始浓度/mol·L -1 a 0 0变化浓度/mol·L -1 x x x平衡浓度/mol·L -1 a -x x x则K a =c (CH 3COO -)·c (H +)c (CH 3COOH )=x 2a -x ≈x 2a注意 由于弱电解质的电离程度比较小,平衡时弱电解质的浓度(a -x ) mol·L -1一般近似为 a mol·L -1。
——————————教育资源共享步入知识海洋————————强酸(碱)与弱酸(碱)的比较李仕才考点梳理1.一元强酸(HA)与一元弱酸(HB)的比较方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。
方法二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释10倍后,1<pH<2。
方法三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可做以下实验:(1)向一定浓度的醋酸钠溶液中,加入几滴酚酞溶液,溶液变为浅红色。
(2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。
3、强弱电解质的图像分析盐酸、醋酸图像题的分析方法(1)相同体积、相同浓度的盐酸、醋酸①加水稀释相同的倍数,醋酸的pH大。
②加水稀释到相同的pH,盐酸加入的水多。
(2)相同体积、相同pH的盐酸、醋酸①加水稀释相同的倍数,盐酸的pH大。
②加水稀释到相同的pH,醋酸加入的水多。
(3)不论怎样稀释,酸溶液的pH不能等于或大于7,碱溶液的pH不能等于或小于7,都只能趋近于7。
考向分析:考向一、强酸和弱酸(碱)的判断典例1、下列事实一定能说明HNO2为弱电解质的是()①常温下,NaNO2溶液的pH>7②用HNO2溶液做导电实验灯泡很暗③HNO2不能与NaCl反应④常温下0.1 mol·L-1的HNO2溶液pH=2⑤1 L pH=1的HNO2溶液加水稀释至100 L后溶液的pH=2.2⑥1 L pH=1的HNO2和1 L pH=1的盐酸与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH 溶液多⑦HNO2溶液中加入一定量NaNO2晶体,溶液中[OH-]增大⑧HNO2溶液中加水稀释,溶液中[OH-]增大A.①②③⑦ B.①③④⑤C.①④⑤⑥⑦ D.②④⑥⑧解析:②如果盐酸(强酸)的浓度很小灯泡也很暗;④如果是强酸,pH=1;⑤如果是强酸,加水稀释至100 L后溶液的pH=3,实际pH=2.2,这说明HNO2溶液中存在HNO2H++NO-2,加水平衡右移,使pH<3;⑥依据HNO2+NaOH===NaNO2+H2O、HCl+NaOH===NaCl+H2O 可知,[HNO2]大于[HCl],而溶液中[H+]相同,所以HNO2没有全部电离;⑦加入NaNO2,溶液中[OH-]增大,说明化学平衡移动;⑧不论是强酸;还是弱酸,加水稀释,溶液中[H+]均减小,而[OH-]增大。
第八章水溶液中的离子平衡第1课时弱电解质的电离平衡知识点一弱电解质的电离平衡及其影响因素1.强、弱电解质(1)概念及分类(2)电离方程式的书写强电解质用“===”连接,弱电解质用“⇌”连接。
(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质分子电离产生离子的速率和离子结合成弱电解质分子的速率相等时,电离过程达到了平衡。
电离平衡建立过程如图所示:①开始时,v(电离)最大,而v(结合)为0。
②平衡的建立过程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离过程达到平衡状态。
(2)电离平衡的特征(3)外界条件对电离平衡的影响以CH3COOH H++CH3COO-ΔH>0为例:改变条件移动方向n(H+)c(H+)c(CH3COO-)电离程度浓度加水稀释正向增大减小减小增大加冰醋酸正向增大增大增大减小同离子效应通入HCl(g)逆向增大增大减小减小加醋酸钠固体逆向减小减小增大减小升高温度正向增大增大增大增大说明①稀醋酸加水稀释时,溶液中不一定所有的离子浓度都减小;②电离平衡右移,电解质分子的浓度不一定减小,离子的浓度也不一定增大;③电离平衡右移,电离程度也不一定增大电解质溶液导电能力取决于自由移动离子的浓度和离子所带电荷数,自由移动离子的浓度越大、离子所带电荷数越多,导电能力越强。
将冰醋酸、浓醋酸和稀醋酸分别加水稀释,其导电能力随加水量的变化曲线如图:知识点二电离平衡常数与电离度1.电离平衡常数(1)概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,用K(弱酸用K a,弱碱用K b)表示。
(2)表达式相同条件下,K 值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
(4)特点①电离常数只与温度有关,与电解质的浓度、酸碱性无关,由于电离过程是吸热的,故温度升高,K 增大。
高三化学知识点:一元弱酸判断方法高三化学知识点:一元弱酸判定方法精品学习高中频道为各位同学整理了高三化学知识点:一元弱酸判定方法,供大伙儿参考学习。
更多各科知识点请关注新查字典化学网高中频道。
一元弱酸,指理想状态下一分子一元弱酸能够电离出一分子氢离子,由因此弱电解质,则无法完全电离。
在中学化学的学习过程中经常遇到一元酸强弱的判定,下面就一元酸(HA)强弱的判定方法归纳。
一、通过pH判定(1)测定已知物质相同浓度的HA和一元强酸的pH,若HA的pH大于同浓度一元强酸的pH,则说明HA为弱酸。
(2)取一定体积的HA溶液,测定其pH,再稀释100倍,若pH增大的程度小于2个单位,则HA为弱酸;若pH增大的程度等于2个单位,则HA 为强酸。
(3)取HA溶液,测其pH,然后加热,若pH变小,则说明HA为弱酸(易挥发和易分解的酸一样不用此法);其原理是加热,能够使电离平稳正向移动。
(4)取HA溶液,测其pH,然后加入NaA固体少许,若pH变大,说明HA为弱酸。
其原理依照勒沙特列原理,电离平稳逆向移动。
二、通过生成气体判定(1)通过生成气体的速率判定取物质的量浓度相同的HA溶液和盐酸,分别加入颗粒大小相同的锌粒,若开始时盐酸中产生的气泡比HA中产生的气泡快,说明HA是弱酸。
(2)通过生成气体的量判定取体积和pH均相同的HA溶液和盐酸,分别加入足量的颗粒大小相同的锌粒,在相同的时刻内,若HA中收集到的气体比盐酸中收集到的气体多,则说明HA为弱酸。
三、通过中和反应判定取相同体积,相同pH的HA溶液与盐酸溶液,分别用氢氧化钠溶液进行中和滴定,假如滴定HA溶液用的氢氧化钠溶液体积大于滴定盐酸的,说明HA为弱酸。
四、通过盐的水解判定看HA对应强碱盐的水溶液的酸碱性,假如NaA溶液的pH7,则说明HA为弱酸。
五、通过导电能力判定分别取相同物质的量浓度的HA溶液和盐酸,测其导电能力,若HA 溶液的导电能力弱于盐酸,则说明HA为弱酸。
一元强酸与一元弱酸的比较
强弱电解质尤其是强酸与弱酸是高中化学很重要的基础知识,在近十年的高考中呈现率是100%,主要考察根据强酸与弱酸的一些性质差异进行有关的判断和推断。
下面就一元强酸与一元弱酸的性质比较进行归纳,以期掌握一强一弱的比较方法和技巧,在解题中能达到事半功倍的效果。
一、一元强酸与一元弱酸的性质差异(以盐酸和醋酸为例)
1.盐酸全部电离,不存在HCl分子,只有H+、Cl-、OH-(极少);醋酸的水溶液中部分电离,存在电离平衡,既含H+、CH3COO-、OH-(极少),还有醋酸分子。
2.pH相同的盐酸和醋酸,醋酸的物质的量浓度大于盐酸。
3.同温度、同浓度的盐酸的导电性强于醋酸溶液。
4.中和同体积、同pH的盐酸和醋酸,醋酸的耗碱量多于盐酸。
5.pH相同、体积也相同的盐酸和醋酸跟足量活泼金属反应时,起始速率相同;在反应过程中,醋酸反应速率减小比盐酸慢,平均反应速率比盐酸快,产生的氢气也是醋酸多。
6.同浓度、同体积的盐酸和醋酸,分别与足量较活泼的金属反应,盐酸产生氢气的速率比醋酸大,但产生氢气的物质的量相等。
7.pH、体积相同的盐酸和醋酸与等物质的量的强碱氢氧化钠发生中和反应后,盐酸反应后溶液呈中性,醋酸反应后溶液呈酸性。
8.同浓度、同体积的盐酸和醋酸与等物质的量的强碱氢氧化钠发生中和反应后,盐酸反应后溶液呈中性,醋酸反应后溶液呈碱性。
9.pH、体积相同的盐酸和醋酸,加水稀释相同倍数时,盐酸的pH增加大,醋酸的pH增加小。
10.稀释浓的醋酸溶液,一般是c(H+)先增大后减小;稀释浓的盐酸,c(H+)一直减小。
11.盐酸和醋酸的溶液中分别加入相应的钠盐固体后,盐酸的pH几乎不变,而醋酸溶液的pH增大。
12.当盐酸与弱碱相互滴定达到滴定终点时,溶液显酸性,应选择酸性变色指示剂(甲基橙);当醋酸与强碱相互滴定时,溶液显碱性,应选择碱性变色指示剂(酚酞)。
二、一元强酸与一元弱酸的判断与推断(以盐酸和醋酸为例)
例.已知酸HA与NaOH溶液混合后溶液呈中性。
①若酸为盐酸,则混合后溶液中各离子的浓度大小顺序是______________;
②若酸为醋酸,则混合时加入等pH的醋酸与NaOH的体积大小是______;
解析:混合后溶液呈中性,则有c(OH-)==c(H+),根据电荷守恒可推出c(Na+) =c(Cl-) ;c(CH3COO-)==c(Na+),生成醋酸钠由于水解本应呈碱性,实际呈中性是由于醋酸多余提供了额外的氢离子,所以醋酸的体积大于氢氧化钠溶液。
例3.取pH等于2的盐酸与醋酸各100 mL分别稀释2倍后。
①若分别加入0.03 g锌粉充分反应,下列叙述正确的是( )
A 醋酸与锌放出氢气多
B 醋酸与锌反应速率快
C 两者产生氢气一样多
D 两者反应速率一样
②若改为加入足量的锌粉,上面叙述正确的是( )
三、总结规律
一元强酸与一元弱酸的比较课后练习题
1、形状形同、质量相等的两份锌粒分别加入相同物质的量浓度、相同体积的稀盐酸、稀醋酸(两种酸均足量)中,开始时生成的气体的速率谁大?____ ___ 。
原因是_________________________ 。
反应完毕后,两者生成气体的体积谁大?________ 。
原因是___________________________ 。
2、c(H+)相同的盐酸溶液和醋酸溶液分别和锌反应,若最后锌都已完全溶解,且放出的气体一样多,则下列判断正确的是()
A、整个反应阶段的平均速率:CH3COOH>HCl
B、反应所需时间:CH3COOH>HCl
C、参加反应的锌的质量:HCl>CH3COOH
D、开始反应速率:HCl>CH3COOH
3、中和c(H+)相同、体积相同的H2SO4 、HCl 和CH3COOH溶液,耗用同一浓度的NaOH 溶液,体积分别为V1、V2和V3 ,则V1、V2和V3的关系正确的是()
A、V1>V2=V3
B、V3>V2=V1
C、V1>V2>V3
D、V1=V2=V3
4、若pH=3的酸和pH=11的碱等体积混合后溶液呈酸性,其原因可能是()。
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液
5、在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是(
A.将pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多
B.盐酸和醋酸都可以用相应的钠盐与浓H2SO4反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
6、甲酸的下列性质中,可以证明它是弱电解质的是()。
A.1mol·L-1甲酸溶液的pH约为2
B.甲酸能与水以任意比例互溶
C.10mL1mol·L-1甲酸恰好与10mL1mol·L-1NaOH溶液完全反应
D.在甲酸钠的溶液滴加酚酞溶液,呈红色
7、将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是()。
[OH-]>[H+]。