环烷烃
- 格式:pdf
- 大小:3.08 MB
- 文档页数:105

有机化学环烷烃在有机化学的广袤领域中,环烷烃是一类具有独特结构和性质的化合物。
它们就像是化学世界里的“小圈圈”,有着自己独特的魅力和价值。
环烷烃,简单来说,就是碳原子通过单键连接形成环状结构的烃类化合物。
与我们熟悉的直链烷烃相比,环烷烃的环状结构赋予了它们一些与众不同的特点。
从结构上看,环烷烃的碳原子排列成环。
环的大小可以不同,常见的有三元环、四元环、五元环等等。
环的大小对环烷烃的稳定性有着重要的影响。
比如,三元环和四元环由于环张力较大,相对来说不太稳定,容易发生开环反应。
而五元环和六元环则相对稳定得多。
稳定性的差异导致了它们在化学反应中的表现各不相同。
以开环反应为例,小环烷烃在一定条件下能够与氢气、卤素等发生开环加成反应。
这是因为小环烷烃的环张力使得它们的化学键相对更容易被打开,从而与其他物质发生反应。
而大环烷烃则相对较难发生这样的反应。
环烷烃的物理性质也有其特点。
一般来说,环烷烃的沸点和熔点比相同碳原子数的直链烷烃要高。
这是因为环状结构使得分子间的接触更为紧密,相互作用增强,从而需要更高的温度来打破这种相互作用。
在实际应用中,环烷烃有着广泛的用途。
在石油化工领域,环烷烃是重要的原料。
通过一系列的化学反应,可以将它们转化为各种有用的化学品,如溶剂、润滑油等。
在医药领域,一些含有环烷烃结构的化合物具有特定的生物活性,被用于药物的研发和制造。
让我们更深入地了解一下环烷烃的命名规则。
对于简单的环烷烃,通常以“环”字开头,然后根据环上碳原子的数目称为“环某烷”。
如果环上有取代基,则要按照一定的顺序为取代基编号,以表明它们在环上的位置。
再来看看环烷烃的同分异构体。
由于环的结构可以有多种变化,所以相同碳原子数的环烷烃可能存在多种同分异构体。
比如,C₅H₁₀就有环戊烷和甲基环丁烷等多种同分异构体。
环烷烃的存在和性质对于我们理解有机化学的整体框架有着重要的意义。
它们不仅丰富了有机化合物的种类,也为我们研究和应用有机化学提供了更多的可能性。



环烷烃的概念环烷烃是一类有机化合物,也被称为脂环烷烃或脂肪环烷烃。
它的分子结构由碳(C)和氢(H)原子组成,其中碳原子形成一个或多个环状结构,每个碳原子上连接着两个氢原子。
环烷烃的普遍化学式为CnH2n,其中n代表碳原子的数量。
环烷烃根据碳原子的环状结构可以分为多个类别,最简单的是环己烷(C6H12),它由六个碳原子组成一个环。
其他常见的环烷烃有环戊烷、环丙烷等。
环烷烃的特点是分子结构中含有一个或多个环状结构,这种环状结构使得环烷烃相对于直链烷烃具有一些特殊的性质。
首先,由于环烷烃分子内部有较大的空间限制,环烷烃的分子难以与其他分子进行反应,使得环烷烃的化学稳定性较高。
此外,环烷烃还具有较高的沸点和熔点,比直链烷烃的物理性质要高。
环烷烃可以通过多种方法合成,最常见的方法是通过烷烃的脱氢反应得到。
例如,环己烷可以由己烷经过加热脱氢反应制得。
此外,环烷烃还可以通过环状化合物之间的反应合成,如环戊烷可以由乙烯和乙烯二聚反应得到。
环烷烃在生活中有广泛的应用。
最典型的例子是石油和天然气中的环烷烃,它们是石油和天然气中最常见的组分之一。
石油和天然气中的环烷烃可以用于生产燃料、润滑剂和化工原料。
此外,环烷烃还可用作溶剂、塑料、橡胶等领域的原料。
但是,环烷烃也存在一些环境和健康方面的问题。
环烷烃是一类挥发性有机物,它们在大气中的存在会对空气质量产生负面影响,形成臭氧、光化学烟雾等污染物。
此外,环烷烃还可能引发健康问题,如呼吸道疾病和神经系统损伤。
总之,环烷烃是一类有机化合物,具有稳定性高、物理性质特殊的特点。
它们在能源、化工和其他领域有着广泛的应用,但也带来环境和健康方面的问题。
对环烷烃的深入研究和合理利用,有助于提高环境质量,推动可持续发展。

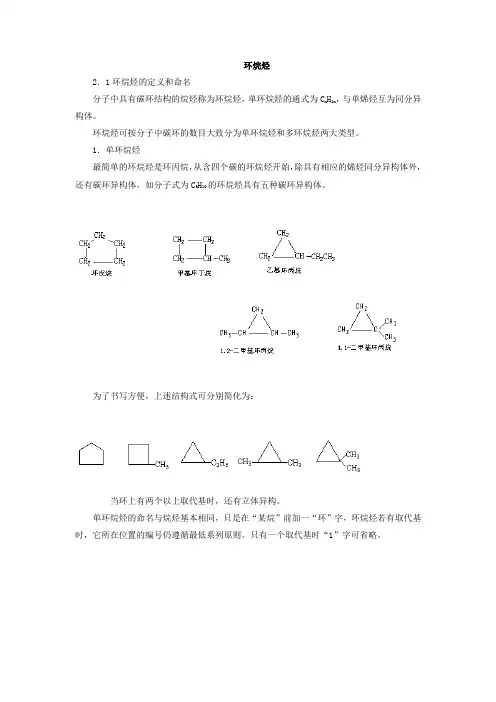
环烷烃2.1环烷烃的定义和命名分子中具有碳环结构的烷烃称为环烷烃,单环烷烃的通式为C n H2n,与单烯烃互为同分异构体。
环烷烃可按分子中碳环的数目大致分为单环烷烃和多环烷烃两大类型。
1.单环烷烃最简单的环烷烃是环丙烷,从含四个碳的环烷烃开始,除具有相应的烯烃同分异构体外,还有碳环异构体,如分子式为C5H10的环烷烃具有五种碳环异构体。
为了书写方便,上述结构式可分别简化为:当环上有两个以上取代基时,还有立体异构。
单环烷烃的命名与烷烃基本相同,只是在“某烷”前加一“环”字,环烷烃若有取代基时,它所在位置的编号仍遵循最低系列原则。
只有一个取代基时“1”字可省略。
当简单的环上连有较长的碳链时,可将环当作取代基。
如:2.多环烷烃含有两个或多个碳环的环烷烃属于多环烷烃。
多环烷烃又按环的结构、位置分为桥环、螺环等。
(1)桥环两个或两个以上碳环共用两个以上碳原子的称为桥环烃,两个或两个以上环共用的叔碳原子称为“桥头碳原子”,从一个桥头到另一个桥头的碳链称为“桥”。
桥环化合物命名时,从一个桥头开始,沿最长的桥编到另一个桥头,再沿次长的桥编回到起始桥头,最短的桥最后编号。
命名时以二环、三环作词头,然后根据母体烃中碳原子总数称为某烷。
在词头“环”字后面的方括号中,由多到少写出各桥所含碳原子数(桥头碳原子不计入),同时各数字间用下角圆点隔开,有取代基时,应使取代基编号较小。
例如:1,2,7-三甲基-双环[2.2.1]庚烷双环[4.4.0]癸烷双环[2.2.1]庚烷(2)螺环脂环烃分子中两个碳环共用一个碳原子的称为螺环烃,共用的碳原子为螺原子。
命名时根据成环的碳原子总数称为螺某烷,编号从小环开始,经过螺原子编至大环,在“螺”字之后的方括号中,注明各螺环所含的碳原子数(螺原子除外),先小环再大环,数字间用下角圆点隔开。
有取代基的要使其编号较小。
例如:5-甲基螺[3.4]辛烷 1,6-二甲基螺[3.5]壬烷2.2环烷烃的物理性质在常温常压下,环丙烷与环丁烷为气体,环戊烷、环己烷为液体。



第二部分:环烷烃2.7环烷烃
主要内容
分类和命名
脂环烃的化学性质
Baeyer张力学说
影响环状化合物稳定性的因素 环状化合物的构象
环己烷的构象
取代环己烷的构象
十氢化萘的构象
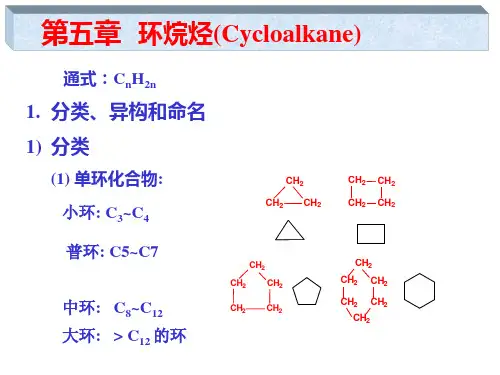
2.7.1 分类
脂环烃的定义:碳原子相互连接成环的烃 多数脂环烃性质和开链的饱和烃及不饱和烃类似
•分类:
饱和脂环烃(环烷烃)
脂环烃环烯烃
不饱和脂环烃
环炔烃
环戊二烯
顺反异构体
顺(Cis ): 相似基团位于环平面的同一边
反(Trans ):相似基团位于环平面的两边
顺-1,2-二甲基环戊烷反-1,2-二甲基环戊烷
环烷烃的分类
单环烷烃--只含一个环的环烷烃
桥环烷烃--共用两个或两个以上
碳原子的多环烷烃环烷烃
螺环烷烃--单环之间共用一个
碳原子的多环烷烃
集合环烷烃--环与环之间用单键
相连的多环烷烃
多环烃是指环之间有共同碳原子的多环化合物。
根据环中共有碳原子的不同可分为:
螺环烃
稠环烃
桥环烃
螺环烃(spiro hydrocarbons):脂环烃中两个碳环共有一个碳原子。
螺〔3,3〕庚环
spiro〔3,3〕heptane
螺环化合物命名时,在螺环化合物的名称前加一个螺(spiro)字,表示类型,用方括号中的阿拉伯数字表示每个环中碳的数目(共有原子除外),数字间用小黑点隔开,并按由小到大的顺序排列,母体名称由环中所含碳原子的总数表示。
3个碳的一边4个碳的一边
螺原子
螺〔3.4〕辛烷
spiro〔3.4〕octane
•编号从螺原子(共用原子)旁的一个碳原子开始,首先沿较小的环编号(如果存在),然后通过螺原子从第二个还编号。
在此编号规则基础上使取代基及官能团编号较小。
CH 3CH 3
1,5-二甲基螺〔3.5〕壬烷
1,5-demethyspiro 〔3.5〕nonane
1
2
345678
9
稠环烃(fused polycyclic hydrocarbons):脂环烃中两个碳环共有两个碳原子。
双环〔4,4,0〕癸烷
十氢化奈(decalin)
桥环烃的命名
1)词头双环(bicyclo)有时也称二环,表示它含有两个环,环数根据一个环状化合物转变成开链化合物时需断开的碳碳键数来确定。
2)公有的碳原子称为桥头碳(1,4),一般是分支最多的碳,两个桥头碳之间可以是碳链,也可以是一个碳键,称为桥。
方括号中由大到小排列的数字表示通过桥头的碳链中的碳数,用黑圆点把它们分开,如:〔3.2.1〕。
3)庚烷表示环中碳原子总数。
4)编号从一桥头开始,沿最长的桥到另一桥头,再沿次长的桥到第一桥头,最后编最短的桥。
在编号的基础上使官能团或取代基编号最小。
6
1
2
3
45
7
2,6,6-三甲基双环〔3.1.1.1〕-2-庚烯
2,6,6-
trimethyl bicyclo〔3.1.1〕-2-heptene
单环烃
双环烃双环和稠环化合物的命名
=
双环烃
双环和稠环化合物的命名
4.4.0双环[]癸烷
44
02424.2.2双环[]癸烷双环和稠环化合物的命名
Spiro[4.5]decane
螺[4.5]
癸烷
Bicyclo[4.3.0]nonane 双环[4.3.0]
壬烷Bicyclo[3.2.1]octane
双环[3.2.1]辛烷
命名
2.7.4 脂环烃的化学性质
•
2.环烷烃的加成开环反应1.自由基取代反应加氢
加卤素
加卤化氢
加水
环丁烷较环丙烷稳定,在较强烈的条件下被氧化,但在常温时甚至在催化剂作用下都不与氢或卤素起开环反应。
反应需要苛刻的条件。
CH2CH2 H C H2
Ni,H2 120℃CH2 H
环丁烷丁烷
环丁烷加氢
五元、六元环较稳定,不易开环。
环丙烷也不易臭氧化。
含三元环的多环化合物氧化时,反应发生在三元环的α位,三元环保
持不变,例如:
环丙烷与烯烃
既类似又有区别,它有抗氧化性,不使高锰酸钾水溶液褪色,可用此性质区分它与不饱和烃。
拜耳(Baeyer)张力学说
•张力学说的基础
(strain theory)
•张力学说的内容
•张力学说的缺陷
为什么环丙烷及环丁烷
易开环,而环戊烷及环
己烷却相对稳定呢?
A.Baeyer 1835-1917 (Germany. )
1885提出了张力学说,1905年获Nobel化学奖
1885年拜耳提出张力学说认为sp3杂化的碳与其它四个原子成键的角度应是109.5º,而三角形的环丙烷键角只能是60º,正方形的环丁烷键角应为90º,它们与正常键角的差分别是49.5º及19.5º,因此成环时需压缩正常键角以适应环的几何形状。
Baeyer张力学说的局限性
根据拜耳张力学说推断:环戊烷与正常键角差别最小为(109.5º-108º=1.5º),应最稳定,环己烷为(109.5º-120º=-10.5º),有一定的张力。
环增大张力也增大,因此大环化合物很难合成。
后来发现,这些结论都是错误的!这些错误的结论是在假设环状化合物是平面结构的基础上得出的。
近代测试结果表明,五碳及其以上的环中碳碳键的夹角都是109.5º,组成环的碳原子不使处在一个平面上,因此它们几乎不存在角张力.
环丁烷(Cyclobutane)•Angle strain due to compression •Torsional strain partially relieved by ring-puckering
环戊烷(Cyclopentane)
•If planar, angles would be 108 , but all hydrogens would be eclipsed.
•Puckered conformer reduces torsional strain.
环烷烃的稳定性
三元、四元环有较高的内能,不稳定
其余环的内能与开链烷烃接近,较稳定
五碳及其以上的环中碳碳间的夹角都是109.5 ,组成环的碳原子不是处在一个平面上,因此它们几乎不存在角张力
比较燃烧一个-CH
–放出的热量可知,放出热量越多,
2
与之相适应的环内能越大,越不稳定
Cycloalkane kJ/mol Per CH
2环丙烷Cyclopropane2,091 697.1环丁烷Cyclobutane2,721 686.2
影响环状化合物稳定性的因素
---环状化合物的构象
•角张力Angle (Baeyer) strain
•扭转张力torsion (bond rotation) energy-Torsional strain
•范德华力Van der Waals energy
•非键原子或基团间偶极和偶极之间的相互作用nonbonded interactions
角张力
任何与正常键角的偏差,降低轨道重叠性而引起的张力
stretch energy
伸展能
角张力
Angle (Baeyer) strain
范德华(Van der Waals)张力
e-+
e-
+两个不成键的原子靠近时,它们之间的吸引力逐渐增强,当原子之间距离等于范德华半径之和,吸引力达到最大。
这种分子中非键原子相互吸引的力是范德华引力的一种。
如果迫使原子进一步接近,则范德华引力立即被范德华斥力所代替,这个斥力称为范德华张力或空间张力。
非键原子或基团间偶极和偶极
之间的相互作用
•氢键、静电相互作用、范德华力。
•环状化合物的稳定构象,是上述四种力共同作用的结果
90º更稳定
扭转张力变小
83º
环丁烷可以通过扭转来减少“角张力”
H H H
H H H H
H 信封式
108º
100º
3 hybridized carbon
has the unstrained angle
环己烷可以通过扭转,使角张力与扭转张力都达到最小
角张力(120º bond angles)
扭转张力
(12 eclipsed C-H bonds)
无角张力
(109.5º 键角)
无扭转张力。