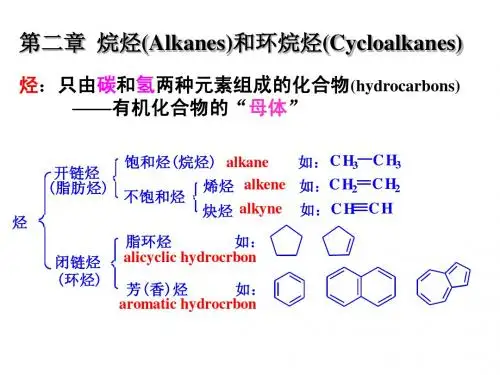
烷烃、环烷烃
- 格式:doc
- 大小:68.50 KB
- 文档页数:6

烷烃与环烷烃区别
一、结构不同
1、烷烃:是开链的饱和链烃(saturated group),分子中的碳原子都以单键相连,其余的价键都与氢结合而成的化合物。
2、环烷烃:含有脂环结构的饱和烃。
有单环脂环和稠环脂环。
含有1个脂环且环上无取代烷基的环烷烃,分子通式为CnH₂n。
二、范围不同
烷烃包括环烷烃,环烷烃是烷烃的一种。
三、性质不同
1、烷烃:低沸点(boiling point)的烷烃为无色液体,有特殊气味;高沸点烷烃为黏稠油状液体,无味;烷烃的物理性质随分子中碳原子数的增加,呈现规律性的变化;烷烃中的氢原子被卤原子(即第七主族元素)取代的反应称为卤化反应(halogenation)。
2、环烷烃:环烷烃有很高的发热量,凝固点低,抗爆性介于正构烃和异构烃之间。
化学性质和烷烃相似。
其中以五碳脂环和六碳脂环的性质较稳定。


鉴别烷烃和环烷烃的方法一、前言烷烃和环烷烃是有机化合物中的两个重要类别,它们在实际应用中具有不同的特性和用途。
因此,正确鉴别烷烃和环烷烃对于化学工作者来说非常重要。
本文将介绍一些常见的鉴别方法。
二、外观1. 环状结构环状结构是环烷烃的一个显著特征。
环状结构使得环烷烃分子相对于线性分子更加紧密,因此其密度更大。
此外,在光学显微镜下观察样品时,环状结构会表现出圆形或椭圆形的形态。
2. 分子大小由于分子量不同,同样数量的分子量下,环状分子比线性分子更大。
因此,在实验中可以通过测量样品的密度或比表面积来区分两者。
三、物理性质1. 沸点由于环形结构使得其相互作用力增强,因此在相同条件下,环形化合物沸点通常较高。
2. 溶解度由于环形结构使得其相互作用力增强,在某些溶剂中(如水),环形化合物的溶解度可能会降低。
四、化学性质1. 氧化反应由于环状结构相对于线性结构更加稳定,因此在氧化反应中,环状分子通常比线性分子更难被氧化。
2. 反应活性由于环状结构使得其相互作用力增强,因此环状分子通常比线性分子具有更高的反应活性。
例如,环烷烃可以通过加氢反应转化为相应的烷基化合物。
五、色谱法色谱法是一种常用的鉴别方法。
在气相色谱中,可以通过样品在某些固定条件下从某个固定位置到达检测器的时间来区分两种不同类型的分子。
由于两者具有不同的物理和化学特征,因此它们在某些条件下会表现出不同的行为。
六、核磁共振法核磁共振是一种非常灵敏和精确的方法。
通过观察样品中不同原子核所发射出来的信号来确定样品中不同类型分子所占比例。
由于两种类型的分子具有不同的原子排列方式,因此它们会表现出不同的核磁共振信号。
七、总结鉴别烷烃和环烷烃的方法有很多种。
在实际应用中,我们可以根据不同的需要选择不同的方法。
总体来说,通过观察样品的外观、物理性质和化学性质,以及使用色谱法和核磁共振法等高级方法,我们可以准确地区分两种不同类型的分子。





烷烃、环烷烃烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的⼀类有机化合物。
烷烃分⼦⾥的碳原⼦之间以单键结合成链状(直链或含⽀链)外,其余化合价全部为氢原⼦所饱和。
烷烃分⼦中,氢原⼦的数⽬达到最⼤值,它的通式为CnH2n+2。
分⼦中每个碳原⼦都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原⼦都是四价的,采⽤sp3杂化轨道,与周围的4个碳或氢原⼦形成牢固的σ键。
连接了1、2、3、4个碳的碳原⼦分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原⼦分别叫做伯、仲、叔氢。
为了使键的排斥⼒最⼩,连接在同⼀个碳上的四个原⼦形成四⾯体(tetrahedro n)。
甲烷是标准的正四⾯体形态,其键⾓为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但⾃然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原⼦可以按规律随意排列,所以烷烃的结构可以写出⽆数种。
直链烷烃是最基本的结构,理论上这个链可以⽆限延长。
在直链上有可能⽣出⽀链,这⽆疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同⼀种烷烃的分⼦式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数⽬会迅速增长烷烃还可能发⽣光学异构现象。
当⼀个碳原⼦连接的四个原⼦团各不相同时,这个碳就叫做⼿性碳,这种物质就具有光学活性。
烷烃失去⼀个氢原⼦剩下的部分叫烷基[1],⼀般⽤R-表⽰。
因此烷烃也可以⽤通式RH来表⽰。
烷烃最早是使⽤习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使⽤。
于是有⼈提出衍⽣命名法,将所有的烷烃看作是甲烷的衍⽣物,例如异丁烷叫做2-⼀甲基丙烷。
现在的命名法使⽤IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前⼗个以天⼲(甲、⼄、丙、丁、戊、⼰、庚、⾟、壬、癸)代表碳数,碳数多于⼗个时,以中⽂数字命名,如:⼗⼀烷。
烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子里的碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2 n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedro n)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基[1],一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
从最近的取代基位置编号:1、2、3...(使取代基的位置数字越小越好)。
以数字代表取代基的位置。
数字与中文数字之间以- 隔开。
有多个取代基时,以取代基数字最小且最长的碳链当主链,并依甲基、乙基、丙基的顺序列出所有取代基。
有两个以上的取代基相同时,在取代基前面加入中文数字:一、二、三...,如:二甲基,其位置以, 隔开,一起列于取代基前面。
异辛烷(2,2,4-三甲基戊烷)的结构式。
异辛烷是汽油抗爆震度的一个标准,其辛烷值定为100。
对于一些结构简单或者常用的烷烃,还经常用俗名。
如,习惯上直链烷烃的名称前面加“正”字,但系统名称中并没有这个字。
在主链的2位有一个甲基的称为“异”,在2位有两个甲基的称为“新”。
这虽然只适合于异构体少的丁烷和戊烷,出于习惯还是保留了下来,甚至给不应该叫“异”的2,2,4-三甲基戊烷也冠上了“异辛烷”的名字。
同分异构体同分异构体简称异构体,是具有相同分子式而分子中原子排列顺序不同的化合物。
有机物中的同分异构体分为构造异构和立体异构两大类。
具有相同分子式,而分子中原子或基团连接的顺序不同的,称为构造异构。
在分子中原子的结合顺序相同,而原子或原子团在空间的相对位置不同的,称为立体异构。
构造异构又分为链异构、位置异构和官能团异构。
立体异构又分为构型异构和构象异构,而构型异构还分为顺反异构和旋光异构。
在高中,我们研究的主要是构造异构。
对于烷烃来说,异构体的数目随着碳原子数目的增加而迅速增加。
下表中列出了几种烷烃从理论上讲存在的异构体数目。
这些异构体的数目是在20世纪30年代初用数学方法推算出来的。
含有1~9个碳原子的烷烃,其实际所得到的异构体的数目与理论推测完全相符,含10个碳原子的烷烃,从理论上推测出来的异构体有一半已经得到,更高级的烷烃只有少数的异构体是已知的。
物理性质烷烃随着分子中碳原子数的增多,其物理性质发生着规律性的变化:1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地,C1~C4气态,C5~C16液态,C17以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于1g/cm^3,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂。
|注意:新戊烷(C(CH3)4)由于支链较多,常温常压下也是气体。
化学性质烷烃性质很稳定,在烷烃的分子里,碳原子之间都以碳碳单键相结合成链关,同甲烷一样,碳原子剩余的价键全部跟氢原子相结合.因为C-H键和C-C单键相对稳定,难以断裂。
除了下面三种反应,烷烃几乎不能进行其他反应。
氧化反应R + O2 → CO2 + H2O 或CnH2n+2 + (3n+1)/2 O2-----------(点燃)---- nC O2 + (n+1) H2O所有的烷烃都能燃烧,而且反应放热极多。
烷烃完全燃烧生成CO2和H2O。
如果O2的量不足,就会产生有毒气体一氧化碳(CO),甚至炭黑(C)。
以甲烷为例:CH4 + 2 O2 → CO2 + 2 H2OO2供应不足时,反应如下:CH4 + 3/2 O2 → CO + 2 H2OCH4 + O2 → C + 2 H2O分子量大的烷烃经常不能够完全燃烧,它们在燃烧时会有黑烟产生,就是炭黑。
汽车尾气中的黑烟也是这么一回事。
取代反应R + X2 → RX + HX由于烷烃的结构太牢固,一般的有机反应不能进行。
烷烃的卤代反应是一种自由基取代反应,反应的起始需要光能来产生自由基。
以下是甲烷被卤代的步骤。
这个高度放热的反应可以引起爆炸。
链引发阶段:在紫外线的催化下形成两个Cl的自由基Cl2 → Cl* / *Cl链增长阶段:一个H原子从甲烷中脱离;CH3Cl开始形成。
CH4 + Cl* → CH3Cl + HCl (慢)CH3Cl + Cl2 → CH2Cl2 + HCl链终止阶段:两个自由基重新组合Cl* 和Cl*, 或R* 和Cl*, 或CH3* 和CH3*.裂化反应裂化反应是大分子烃在高温、高压或有催化剂的条件下,分裂成小分子烃的过程。
裂化反应属于消除反应,因此烷烃的裂化总是生成烯烃。
如十六烷(C16H34)经裂化可得到辛烷(C8H18)和辛烯(C8H16)。
由于每个键的环境不同,断裂的机率也就不同,下面以丁烷的裂化为例讨论这一点:CH3-CH2-CH2-CH3 → CH4 + CH2=CH-CH3过程中CH3-CH2键断裂,可能性为48%;CH3-CH2-CH2-CH3 → CH3-CH3 + CH2=CH2过程中CH2-CH2键断裂,可能性为38%;CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2过程中C-H键断裂,可能性为14%。
裂化反应中,不同的条件能引发不同的机理,但反应过程类似。
热分解过程中有碳自由基产生,催化裂化过程中产生碳正离子和氢负离子。
这些极不稳定的中间体经过重排、键的断裂、氢的转移等步骤形成稳定的小分子烃。
在工业中,深度的裂化叫做裂解,裂解的产物都是气体,称为裂解气。
由于烷烃的制取成本较高(一般要用烯烃催化加氢),所以在工业上不制取烷烃,而是直接从石油中提取。
烷烃的作用主要是做燃料。
天然气和沼气(主要成分为甲烷)是近来广泛使用的清洁能源。
石油分馏得到的各种馏分适用于各种发动机:C1~C4(40℃以下时的馏分)是石油气,可作为燃料;C5~C11(40~200℃时的馏分)是汽油,可作为燃料,也可作为化工原料;C9~C18(150~250℃时的馏分)是煤油,可作为燃料;C14~C20(200~350℃时的馏分)是柴油,可作为燃料;C20以上的馏分是重油,再经减压蒸馏能得到润滑油、沥青等物质。
此外,烷烃经过裂解得到烯烃这一反应已成为近年来生产乙烯的一种重要方法。
英文命名对照n Name Formula Alkyl1 Methane CH4 Methyl2 Ethane C2H6 Ethyl3 Propane C3H8 Propyl4 Butane C4H10 Butyl5 Pentane C5H12 Pentyl6 Hexane C6H14 Hexyl7 Heptane C7H16 Heptyl8 Octane C8H18 Octyl9 Nonane C9H20 Nonyl10 Decane C10H22 Decyl例如,2,2,4-三甲基戊烷2,2,4-trimethylpentane烷烃的主要特征碳原子数名称分子式熔点(摄氏度)沸点(摄氏度)常温下的状态1 甲烷CH4 - 183 161 气态2 乙烷C2H6 - 184 89 气态3 丙烷C3H8 - 188 - 42 气态4 丁烷C4H10 - 138 - 0.5 气态5 戊烷C5H12 - 130 36 液态6 己烷C6H14 - 95 697 庚烷C7H16 - 91 988 辛烷C8H18 - 57 1269 壬烷C9H20 - 54 15110 癸烷C10H22 - 30 17411 十一烷C11H24 26 19612 十二烷C12H26 10 21613 十三烷C13H28 6 234...以上是液态17 十七烷C17H36 22 292 固态18 十八烷C18H38 28 308 固态环烷烃naphthenes;cycloalkanes;cycloparaffins;naphthenic hydrocarbons含有脂环结构的饱和烃。
有单环脂环和稠环脂环。
含有1个脂环且环上无取代烷基的环烷烃,分子通式为CnH2n。
环戊烷、环己烷及它们的烷基取代衍生物是石油产品中常见的环烷烃。
稠环环烷烃存在于高沸点石油馏分中。
环烷烃有很高的发热量,凝固点低,抗爆性介于正构烃和异构烃之间。
化学性质和烷烃相似。
其中以五碳脂环和六碳脂环的性质较稳定。
环烷烃是指分子结构中含有一个或者多个环的饱和烃类化合物。
最简单的脂环烃是环丙烷。
脂环烃是不少重要药物的主要成份。
命名法1.确定主体2.取代基定位稳定性1.角张力 2.扭转张力 3.空间位阻具有脂肪族性质的环烃,分子中含有闭合的碳环,但不含苯环。
脂环烃的结构式常用多边形表示,多边形的每个顶点代表一个碳原子和扣除取代基后使碳原子保持 4 价所需的氢原子。
脂环烃也可含有两个以上的碳环,它们可用多种方式连接:分子中两个环可以共用一个碳原子,这种体系称为螺环;环上两个碳原子之间可以用碳桥连接,形成双环或多环体系,称为桥环;几个环也可以互相连接形成笼状结构。
单环烃的命名是用环字表示环烃,用丙、丁、戊等表示环内碳原子的数目,用烷、烯、炔等表示环内只有单键或有双键、叁键,取代基的表示方法与链烃相同。
双环烃是根据环内碳原子的总数称为双环〔〕某烷(或烯),在方括号内用阿拉伯数字表示联结桥头碳原子的每个碳桥上碳原子的数目,先写大环的碳原子数。