不同金属离子对酶活性的影响
- 格式:doc
- 大小:44.50 KB
- 文档页数:4
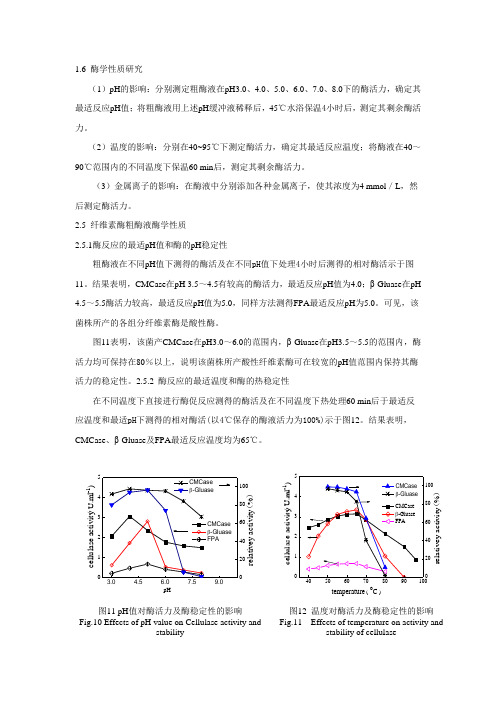
1.6 酶学性质研究(1)pH 的影响:分别测定粗酶液在pH3.0、4.0、5.0、6.0、7.0、8.0下的酶活力,确定其最适反应pH 值;将粗酶液用上述pH 缓冲液稀释后,45℃水浴保温4小时后,测定其剩余酶活力。
(2)温度的影响:分别在40~95℃下测定酶活力,确定其最适反应温度;将酶液在40~90℃范围内的不同温度下保温60 min 后,测定其剩余酶活力。
(3)金属离子的影响:在酶液中分别添加各种金属离子,使其浓度为4 mmol /L ,然后测定酶活力。
2.5 纤维素酶粗酶液酶学性质2.5.1酶反应的最适pH 值和酶的pH 稳定性粗酶液在不同pH 值下测得的酶活及在不同pH 值下处理4小时后测得的相对酶活示于图11。
结果表明,CMCase 在pH 3.5~4.5有较高的酶活力,最适反应pH 值为4.0;β-Gluase 在pH 4.5~5.5酶活力较高,最适反应pH 值为5.0,同样方法测得FPA 最适反应pH 为5.0。
可见,该菌株所产的各组分纤维素酶是酸性酶。
图11表明,该菌产CMCase 在pH3.0~6.0的范围内,β-Gluase 在pH3.5~5.5的范围内,酶活力均可保持在80%以上,说明该菌株所产酸性纤维素酶可在较宽的pH 值范围内保持其酶活力的稳定性。
2.5.2 酶反应的最适温度和酶的热稳定性在不同温度下直接进行酶促反应测得的酶活及在不同温度下热处理60 min 后于最适反应温度和最适pH 下测得的相对酶活(以4℃保存的酶液活力为100%)示于图12。
结果表明,CMCase 、β-Gluase 及FPA 最适反应温度均为65℃。
c e l l u l a s e a c t i v i t y ( U .m l -1)pHr e l a t i v e y a c t i v i t y (%)c e l l u l a s e a c t i v i t y ( U .m l -1)temperature ( o C )r e l a t i v e y a c t i v i t y (%)图11 pH 值对酶活力及酶稳定性的影响Fig.10 Effects of pH value on Cellulase activity andstability 图12 温度对酶活力及酶稳定性的影响 Fig.11 Effects of temperature on activity andstability of cellulase图12表明,温度低于60℃时,CMCase和β-Gluase能保持90%以上的酶活性,酶液在80℃下保温1小时,CMCase仍保持10%的活性,70℃热处理1小时,β-Gluase活性仅损失60%。


2011届本科毕业生毕业论文题目:PH、金属离子在溶菌酶提取过程中对酶活性的影响作者姓名徐萧苟真汪磊指导教师刘秀丽学科专业生物技术系别生命科学与技术学院学号2007221121 20072211022007221115提交论文日期2011年6月2日PH、金属离子在溶菌酶提取过程中对酶活性的影响徐萧苟真汪磊指导老师:刘秀丽(陇东学院生命科学与技术学院甘肃庆阳 745000)摘要:本实验采用盐析法从鸡蛋清中提取溶菌酶,通过在提取过程中施以不同的PH和加入不同的金属离子,来测定其对提取的溶菌酶活性的影响。
结果表明酶活性在PH6.0-6.5最强、且在5-7范围内较稳定;金属离子中Na+、K+对其活性有轻微激活作用。
Mn2+、Mg2+对溶菌酶活性无明显影响,Ca2+、Cu2+、Fe2+、Zn2+使溶菌酶活性下降。
关键词:盐析蛋清溶菌酶;酶活性;影响因素;金属离子;提取;PHPh, Metal Ions In Mind The Enzymes Are Extracts Of The Enzyme ActivityXuxiao gouzhen wanglei(Gansu College of Life Science and Technology, Biotechnology, 07 classes inQingyang 745000)Abstract: Objective To study the extraction process of egg white lysozyme PH, metal ions on enzyme activity levels.Methods: egg white lysozyme in the extraction process or by changing the PH by adding various metal ions the size of the different factors to determine the results of the activity of egg white lysozyme was observed enzyme activities. The results of activity of the strongest in the PH6.0-6.5 and was stable in the range 5.0-7.0; metal ions in the Na +, K + activation of its activity slightly. Mn2 +, Mg2 + had no effect on the activity of lysozyme, Co2 +, Ca2 +, Cu2 +, Fe2 +; Zn2 + is the activity of lysozyme decreased. Conclusion Preliminary results showed that acid extraction of lysozyme as part of the environment and enhance the metal ions for their activity and reduce the effectKeywords :out truffles are an enzyme ;enzyme activity ; factors influencing Metal ion; extraction;pH;0引言溶菌酶(Lysozyme),正式名为N-乙酰基糖胺酶(N-lhexosaminodase),属胞壁质酶(muramidase), 有称N-乙酰胞壁质酶,能选择性地分解微生物的细胞壁而具有杀菌、抗病毒、抗肿瘤细胞等功效,在食品工业、医疗、生物学领域有着广泛的应用[1]。

影响酶活性的条件1.实验原理(1)探究温度对酶活性的影响 ①反应原理②鉴定原理:温度影响酶的活性,从而影响淀粉的水解,滴加碘液,根据是否出现蓝色及蓝色的深浅来判断酶的活性。
(2)探究pH 对酶活性的影响①反应原理(用反应式表示):2H 2O 2――――→过氧化氢酶2H 2O +O 2。
②鉴定原理:pH 影响酶的活性,从而影响氧气的生成速率,可用带火星的卫生香燃烧的情况来检验O 2的生成速率。
2.实验步骤和结果 (1)探究温度对酶活性的影响(2)探究pH对酶活性的影响考点一:“梯度法”探究酶的最适pH(1)设计思路(2)设计方案例一、为了探究某种淀粉酶的最适温度,某同学进行了如图所示的实验操作。
实验步骤如下:步骤①:取10支试管,分为五组。
每组两支试管中分别加入1 mL某种淀粉酶溶液和2 mL 质量分数为5%的淀粉溶液。
步骤②:将每组淀粉酶溶液和淀粉溶液混合并摇匀。
步骤③:将装有混合溶液的五支试管(编号1、2、3、4、5)分别置于15 ℃、25 ℃、35 ℃、45 ℃、55 ℃水浴中。
反应过程中每隔1分钟从各支试管中取出一滴反应液,滴在比色板上,加1滴碘液显色。
回答下列问题:(1)实验原理:淀粉在淀粉酶的催化作用下分解成还原糖;淀粉酶的活性受温度影响;用碘液可检测淀粉,因为淀粉遇碘液变蓝,根据蓝色深浅来推断淀粉酶的活性。
(2)该实验的设计存在一个明显的错误,即步骤②前应__________________________________________________________________________________________________。
(3)在本实验中,各组溶液的pH要保证______________,该实验能否选用斐林试剂检测实验结果?__________,理由是________________________________________________________________________________________________________________________。

金属离子对纤维素酶活力影响的研究
纤维素酶的活性往往受到金属离子的影响,因此研究金属离子对纤维素酶活性的影响及机制十分重要。
研究发现,铝离子,铁离子,锆离子和钴离子与纤维素酶的活性有紧密关系。
一般情况下,金属离子可以抑制纤维素酶活性,铝离子最明显,其抑制作用随金属离子浓度的增加而加强;而钴和锆在低浓度时可以激活纤维素酶活性。
金属离子可以通过多种方式影响纤维素酶的活性,比如直接作用在酶上,导致酶的结构发生改变而影响其活性;另外,金属离子可以与底物(纤维素)结合干扰底物和酶之间的作用,进而影响酶的活性;另外,它还能结合抑制剂,抑制酶的活性;最后,金属离子可以结合酶体,破坏酶体,而导致很大程度上降低酶活性。
综上所述,可以看出,金属离子可以通过多种方式影响纤维素酶活性,因此,为了确保其高效率使用,需要在添加金属离子的前后,注意检测其对纤维素酶活性的影响,确保其最佳活性条件,可以获得最佳不同浓度的金属离子,有利于取得满意的纤维素酶活性结果。

酶促反应影响因素酶促反应影响因素1. 温度:温度高于酶的最适活性温度,会加速酶分子的活性,而酶活性过高则可导致酶烧伤或破坏,从而降低反应的速率,所以保持合适的温度是影响酶促反应的重要因素之一。
2. 酶浓度:酶浓度是影响酶促反应速率的主要因素,它直接影响反应中酶与底物之间的接触次数,当酶浓度增加时,酶与底物越多,接触次数越多,反应速率自然越快,反之,当酶浓度过低时,反应速率就变慢。
3. pH值:pH值也会影响酶促反应,每种酶都有自己最适宜的pH值,若pH值过高或过低,酶活性可能会下降,甚至在一定的极端条件下可能造成酶的解离,因此需要控制反应的pH值。
4. 辅助因子:对于一些特定的酶,还需要加入某些激活剂或辅助因子,才能促进反应,引起酶活性。
例如,维生素是不可缺少的辅助因子,它们可能和一些酶结合形成介质型酶,影响酶促反应的反应速率。
5. 抑制剂:在生理反应过程中,也需要抑制酶的活性,而一些有机分子可以抑制酶的活性,从而降低反应的速率。
抑制剂的效果受其类型、浓度和pH值等影响,如果抑制剂的浓度过高,将会完全抑制酶活性,从而降低反应的速率。
6. 氧化剂和还原剂:氧化剂和还原剂都会影响酶促反应,氧化剂可以促进酶的反应速率,而还原剂则可以降低酶的反应速率。
例如,苯酚可以作为氧化剂加速酶促反应,而过氧化氢则可以作为还原剂,降低酶促反应的速率。
7. 金属离子:一些金属离子也可以影响酶的反应速率,其中锰、铜、铁等离子可能介导酶的正向活性,而硫酸钙、硫酸镁、硫酸铝等离子可能起抑制作用,降低酶的反应速率。
因此,温度、酶浓度、pH值、辅助因子、抑制剂、氧化剂和还原剂以及金属离子等都是影响酶促反应速率的重要因素。
基于此,实验室工作者可以在有效控制这些条件条件的基础上,改善反应的质量和效率,从而获得更佳的实验结果。
影响酶活性的因素文献综述酶是一种活性蛋白质。
因此,一切对蛋白质活性有影响的因素都影响酶的活性。
酶具有蛋白质样的一级、二级、三级、四级结构, 可由温度、离子发射、氧化剂、还原剂、光、酸、碱和有机溶剂, 生物作用等因素对其变性和降解, 酶的变性会引起其催化活性(即在特定的系统和条件下的反应速度) 的丧失, 现代分子学认为变性就是对蛋白质的二、三级结构的破坏, 下面从十一个方面说明影响酶活性的因素。
团,这时,酶与底物结合最容易;当偏高或偏低时,其活动中心只带有一种电荷,就会使酶与底物的结合能力降低。
值是酶催化反应的重要环境条件, 酶是两性化合物, 其上分布着许多梭基和氨基等酸性、碱性基团, 对酸碱度极为敏感, 最适值因酶、底物的不同而异, 过酸和过碱时均会引起酶变性,从而降低酶活性, 导致反应速度下降, 酶反应速度最大的值是最适值,此时酶的活性最大。
、酶的浓度和底物浓度酶与底物浓度的关系,一般来说,当酶的浓度较小,底物浓度大大高于酶,则酶的浓度与反应速度成正比;当底物浓度一定时,酶的浓度继续增加到一定值以后,其反应速度并不加快。
由于上述关系,过大的增加用曲量是不能收到预期效果的。
、金属离子某些金属离子对酶起着活化剂的作用,例如 , ,等离子通常可以显著增加一葡萄糖异构酶的活性, 相反地, 金属离子对酶也可能起抑制作用, 例如同样对葡萄糖异构酶, , , , , 均有不同程度的抑制催化活性的作用, 重金属离子如 , 等,对蛋白质具有变性作用, 故在酶洗液中应竭力避免铜、铁、铝等重金属离子进入, 应尽量在生产中避免使用铜器等设备, 或用赘和剂封锁, 但钾、钠、镁等重金属离子对酶影响不大。
、物理因素许多物理因素和紫外线, 放射线, 超声波等都可能引起酶的失活。
酶在存放中易失活, 一般酶最宜储存温度为。
℃至℃ , 一年内失活率, 冷冻干燥是保存酶制剂的一个好方法, 但也有一些酶经不起冷冻, 如梭肤酶。
在生产操作时, 尤其是搅拌酶溶液时形成的大量泡松散差,性。
酶失活的常见原因酶是生物体内的一种催化剂,在许多细胞生理过程中起着关键的作用。
然而,酶失活是指酶活性的丧失或降低,这可能导致生物体内许多代谢通路受到干扰。
酶失活的常见原因可以归纳为以下几个方面:1. 温度变化:温度变化是酶失活的常见原因之一。
酶在特定的温度范围内活性最高,这个温度范围被称为酶的最适温度。
当温度低于或高于最适温度时,酶的构象和稳定性会发生改变,导致酶活性下降或丧失。
例如,高温可以引起酶的蛋白质结构发生变化,使其无法正确地与底物结合或催化化学反应。
2. pH值变化:pH值变化也是酶失活的常见原因之一。
酶对于特定的pH值有最适活性,在最适pH值下酶的构象和电荷状态最为稳定。
当pH值偏离最适范围时,酶的酶活性会降低或丧失。
例如,过高或过低的pH值可以改变酶的电荷状态,干扰酶与底物之间的结合或催化反应。
3. 金属离子的作用:许多酶活性需要金属离子的辅助。
特定的金属离子可以协助酶与底物的结合或直接参与催化反应。
然而,过高或过低的金属离子浓度会影响酶活性。
例如,金属离子的浓度过高可能导致毒性效应,从而使酶活性下降或丧失。
4. 蛋白质结构的改变:一些蛋白质结构改变也会导致酶失活。
蛋白质的结构对酶的活性至关重要,任何能够引起蛋白质结构改变的因素,如化学物质、热力学变化等,都可导致酶的构象发生改变,从而影响酶的催化活性。
5. 抑制剂的作用:一些物质,称为酶抑制剂,可以与酶结合并降低其活性。
酶抑制剂可通过竞争性抑制、非竞争性抑制或混合性抑制等方式发挥作用。
例如,某些药物或毒素可以与酶结合,阻止底物结合或催化反应,从而导致酶活性的丧失。
除了上述几个常见原因外,酶失活还可能受到其他因素的影响,如氧浓度、离子浓度、辐射和酶自身的突变等。
因此,了解酶失活的原因对于澄清酶催化反应机制、寻找酶特定化合物的作用靶点以及设计和改造酶都是至关重要的。
金属离子对酶活性的影响
实验目的:1、了解金属离子对酶活性的影响;
2、掌握不同金属离子对酶活性作用结果的测量方法
实验原理:
酸性磷酸酯酶广泛分布于动物和植物中,植物的种子、霉菌、肝脏和人体的前列腺中。
它对生物体核苷酸、磷蛋白和磷脂的代谢,骨的生成和磷酸的利用,都起着重要作用。
磷酸酶是一种能够将对应底物去磷酸化的酶,通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基。
磷酸酶的作用与激酶的作用正相反,激酶是磷酸化酶,可以利用能量分子,如ATP,将磷酸基团加到对应底物分子上。
本实验选用绿豆芽作材料,从中提取酸性磷酸酯酶。
以人工合成的对硝基苯磷酸酯(NPP)作底物,水解产生对硝基苯酚和磷酸。
在碱性溶液中,对硝基酚盐离子在405nm处光吸收强烈,而底物没有这种特性。
凡是能提高酶活性的物质统称为酶的激活剂。
无机离子和一些金属离子对酶有激活作用,可以作为酶的激活剂。
其中钾离子是酸性磷酸酯酶的一种激活剂,它在酶与底物之间起了桥梁作用,形成了酶—金属离子—底物三元复合物,从而更有利于底物与酶的活性中心部位的结合。
而氯离子和钠离子对酸性磷酸酯酶的活性
没有什么影响.一些重金属离子如铜离子,对酶活性具有抑制作用。
实验用品:
1、仪器:恒温水浴箱、试管架、试管、分光光度计、
比色皿、吸头、滴管、移液枪、移液管
2、试剂:1.2mmol/L NPP 100ml 、0.3mol/L NaOH
250ml 、酸性磷酸酯酶、pH5.0的柠檬酸缓冲液
1000ml 、2mmol/L FeSO4 、2mmol/LCuSO4、
MnCl22mmol/L 、MgSO42mmol/L、 KCl 2mmol/L EDTA、实验步骤:
调零FeSO
4
CuSO
4
MnCl
2
MgSO
4 EDTA KCl
空白
对照
0 1 2 3 4 5 6 7
NPP
(ml) 1 1 1 1 1 1 1 1
酶液
(ml) 1 1 1 1 1 1 1 1 金属离
子(m
l) 1 1 1 1 1 1 1 1
NaOH(m
l) 3 3 3 3 3 3 3 3 注:反应均在37度水浴箱中进行,0号管先加入1.0mlNPP后保温15分钟,然后加入NaOH 3ml,混匀后再加
酶液1ml,在波长405nm处观察OD值,以0号管调零
实验结果
调零FeSO
4
CuSO
4
MnCl
2
MgSO
4 EDTA KCl
空白
对照
试管号0 1 2 3 4 5 6 7
OD
(abs)0 0.68
4
0.30
9
1.26
2
0.35
7
0.34
1
0.34
2
0.28
4
由实验数据得到的图标如下:
实验作业:
以各金属离子为横坐标,A405纵坐标,绘制不同金属离子与酶活力曲线,观察金属离子与酶活力的关系,分析哪些是酶活性激活剂,哪些是酶活性抑制剂。
结果分析:通过实验组与对照组的OD值对比可知,保证在适宜的温度、pH等外界条件下,再加入1ml 2mmol/L浓度的各种金属离子溶液,对酸性磷酸酯酶的活力均有激活作用。
它们对酸性磷酸酯酶激活作用的强度由大到小依次为:MnCl2、FeSO4、MgSO4KCl、EDTA、CuSO4。
可以看出,重金属对这种酶的激活作用比较强。