分子球棍模型 演示文稿1
- 格式:ppt
- 大小:4.67 MB
- 文档页数:67
![球棍模型[宝典]](https://img.taocdn.com/s1/m/a9e49b7a26d3240c844769eae009581b6bd9bde0.png)
球棍模型[宝典]2 己烷 C H: 碳原子以 sp 杂化与相邻两个碳原子碳二茂铁 Fe(C H ): 上下环戊烯阴离子各以六个π 61255233环s骨架,与2个H 成 C-H 键。
电子参与成键,与Fe对称性匹配的 dp 轨道形成六个分子轨道,Fe其余的三个价轨道为非键的孤对电子占据。
2-3 BH: 12 个 B 形成封闭的三角二十面体,每个 B CH: 每个 C 以 sp杂化与相邻的 3 个 C 、 1 个 12122020还与 1 个 H 形成 B-H 键。
H 形成 s 键,整个碳笼为正十二面体。
2 C: 每个 C 以 sp杂化与相邻的3 个 C 形成球形石墨层内 C 以共价键与相邻的 3 个 C 形成平面骨60架,层之间为范德华力。
多面体 s 骨架( 12 个五边形与 20 个六边形),还有1 个垂直于曲面的 p 轨道与其他 p 轨道形成 1 个离域的大 p 键。
3- 金剛石:为 A4 结构,每个 C 以 sp 杂化与相邻的 NaCl 晶体属面心立方点阵, Na+与Cl的配位数均为,,-4 个 C 形成四面体配位,晶胞中有 8 个 C 原子。
6。
Cl作立方最密堆积,Na填在Cl形成的八面体空隙,--中。
每个晶胞含有4个Cl和4个Na,Cl位于晶胞顶点,与面心位置,Na位于体心与棱心位置。
立方 ZnS 晶体中, S 原子作立方最密堆积, Zn 原六方 ZnS 晶体中, S原子作六方最密堆积, Zn 原子填在一半的四面体空隙中,形成立方面心点阵,晶胞子填在一半的四面体空隙中,形成六方点阵,晶胞中含中含个 S 原子 4 个 Zn 原子; 个 S 原子 4 个 Zn 原子。
,-4 CaF晶体属立方面心点阵, F作简单立方堆积, Ca 金红石( TiO)为简单四方结构 ,Ti处在略为变形222,,-4数目比 F少一半,填了一半的立方体空隙,每一个 Ca的氧八面体中,即氧离子作假六方堆积, Ti填在它的2,,,--42-4由八个 F配位,而每个 F有 4 个 Ca配位,每个准八面体空隙中, Ti配位数为 6 , O与 3 个 Ti2,,,-4CaF晶胞有 4 个 Ca和 8 个 F原子。
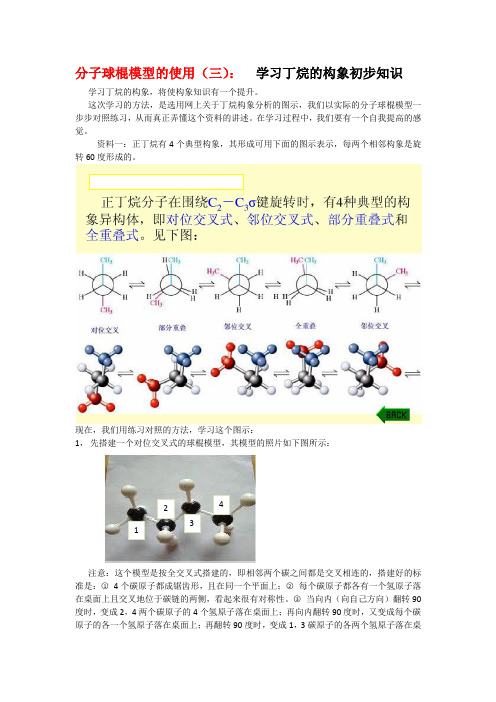
分子球棍模型的使用(三): 学习丁烷的构象初步知识 学习丁烷的构象,将使构象知识有一个提升。
这次学习的方法,是选用网上关于丁烷构象分析的图示,我们以实际的分子球棍模型一步步对照练习,从而真正弄懂这个资料的讲述。
在学习过程中,我们要有一个自我提高的感觉。
资料一:正丁烷有4个典型构象,其形成可用下面的图示表示,每两个相邻构象是旋转60度形成的。
现在,我们用练习对照的方法,学习这个图示:1, 先搭建一个对位交叉式的球棍模型,其模型的照片如下图所示:注意:这个模型是按全交叉式搭建的,即相邻两个碳之间都是交叉相连的,搭建好的标准是:○1 4个碳原子都成锯齿形,且在同一个平面上;○2 每个碳原子都各有一个氢原子落在桌面上且交叉地位于碳链的两侧,看起来很有对称性。
○3 当向内(向自己方向)翻转90度时,变成2,4两个碳原子的4个氢原子落在桌面上;再向内翻转90度时,又变成每个碳原子的各一个氢原子落在桌面上;再翻转90度时,变成1,3碳原子的各两个氢原子落在桌1234面上;再翻转90度时还原为开始的状态。
每次翻转都调整到如上面的氢原子落在桌面上则是搭建准确了的。
这一步的搭建准确是很重要的,在接下来的转动中就很符合图中所示了。
图中1,4两个碳及其氢换成其他的颜色,能更好地表示位置区分,不换也可以,只要标记出碳3的一个氢原子能看到转动时的角度就行了。
2,这个图的上面一排是纽曼式投影,纽曼式投影的方法是:右手拿着碳2,让碳链与身体平行,眼睛顺着C2-C3键看去,让C2,C3两原子重合,这时看到各原子在空间的位置就是纽曼式投影的结果。
这个图的下面一排是纽曼式投影对映的球棍模型的照片。
3,现在我们从左边一个“对位交叉”图看起:右手拿着碳2,让碳链与身体平行,眼睛顺着C2-C3键看去,让C2,C3两原子重合,一直看到各原子在空间的位置很像左边这个图的样子为止。
这一步很重要,弄清楚怎样拿模型,怎样看模型,把对位交叉式看懂了,其余的就好办了,一点不要含糊,这就弄懂什么叫纽曼式投影了。



第1篇一、实验目的1. 了解球棍模型的基本原理和构建方法。
2. 培养学生运用球棍模型进行化学分子结构研究的能力。
3. 提高学生对化学分子三维空间结构的认识。
二、实验原理球棍模型是一种空间填充模型,用于表现化学分子的三维空间分布。
在球棍模型中,线代表共价键,可连结以球型表示的原子中心。
通过构建球棍模型,可以直观地展示分子的三维结构,有助于理解分子间的相互作用和化学性质。
三、实验材料1. 原子球:碳、氢、氧、氮等原子球。
2. 共价键棒:不同长度的棒状物,代表不同类型的共价键。
3. 球棍模型底座:用于固定球棍模型。
4. 实验指导书。
四、实验步骤1. 确定分子结构:根据实验指导书,了解所要构建的化学分子的原子组成和键的类型。
2. 选择原子球:根据分子结构,选择相应数量的原子球。
3. 构建共价键:用共价键棒连接原子球,形成分子的基本骨架。
4. 调整模型:根据分子的空间结构,调整原子球的位置和共价键的长度。
5. 固定模型:将球棍模型放置在底座上,确保模型稳定。
6. 检查模型:检查模型是否符合实验指导书中的分子结构要求。
五、实验结果与分析1. 实验结果:成功构建了CH4、C2H4、C2H2等化学分子的球棍模型。
2. 分析:(1)CH4分子球棍模型:CH4分子为正四面体结构,碳原子位于正四面体的中心,四个氢原子位于正四面体的四个顶角。
球棍模型中,碳原子用黑色球表示,氢原子用白色球表示,碳氢共价键用黑色棒表示。
(2)C2H4分子球棍模型:C2H4分子为平面结构,两个碳原子位于平面中心,四个氢原子分别位于两个碳原子的两侧。
球棍模型中,碳原子用黑色球表示,氢原子用白色球表示,碳氢共价键用黑色棒表示。
(3)C2H2分子球棍模型:C2H2分子为直线型结构,两个碳原子位于直线两端,两个氢原子分别位于两个碳原子的中间。
球棍模型中,碳原子用黑色球表示,氢原子用白色球表示,碳氢共价键用黑色棒表示。
六、实验总结1. 通过本次实验,掌握了球棍模型的构建方法,提高了对化学分子三维空间结构的认识。

分子球棍模型的使用(四):环已烷构象的初步知识 下面是作者搭建模型照片:左面一张是船式构象照片,右面一张是椅式构象照片:(一) 按照上述照片,我们先分析两种构象的结构特点,然后搭建模型:在船式结构中:○11,2,3和4,5,6这两组碳原子相互间成交叉排列;1和6、 3和4[这两组碳原子成重叠排列;(碳原子的编号可以改变)○21,3,4,6 这四个碳原子在同一个平面上,位于“船身”2,5这两个碳原子在另一个平面上,位于“船头”和“船尾”○31和6的氢原子相重叠、3和4的氢原子相重叠;2和5各有一个氢原子相距很近。
在椅式结构中:○1 6个碳原子相邻排列都是交叉式;有三个碳原子是相间地直立的,另三个是相间地倒立的;六个a 键相间地向上或向下,六个e 键相间地上倾或下倾;○2有三个碳原子在同一平面,另三个在另一平面上,但六个碳原子是等同的,翻转180度就成了完全相同的构象。
(二)模型搭建好后,是否符合要求,要按照下面进行调整:(1)船式模型的调整: ○1将船式模型放置如上面左图所示,这时,1,6,3,4四个碳向下倾的四个氢原子应能全部落在桌面上,否则要进行调整;○2将船式模型放置如上面左图所示,再向前翻动时4,5,6三个碳向下倾的氢原子同时落在桌面上;同样,向后翻动1,2,3三个碳向下倾的氢原子也同时落在在桌面上,否则要进行调整; 16 5432○3将船式模型放置如上面左图所示,再向左翻动时至1,6两个碳的四个氢原子应同时落在桌面上;同样,当向右翻动时,3,4两个碳四个氢原子应同时落在桌面上,否则要进行调整。
(2)椅式构象的调整:按照上面椅式构象的结构特点进行调整就行了。
(三)两种结构相互翻转的方法:(1)由船式变为椅式的操作:船头碳2不动,将船尾碳5向环外下翻成倒立碳原子就基本上成型了,再稍加调整就成为椅式构象了。
(2)由椅式变为船式的操作:将任意两个相对的碳原子向内压陇,放开后再作调整就行了。
二,环已烷构象的表示方法:1,下面所表示的是两种构象的锯架式透视法,在椅式画法中,每个键都有着对应的平行关系,a键是很清楚的平行了,每个e键都可以找到和它相互平行的N个e键;在船式画法中,每个键都有着对应的对称关系,中间那条红虚线就是各个键相互的对称轴,只要有一个键找不到与之对称的键,这个图就明显的错了。
实践活动——搭建球棍模型认识有机分子的结构特点一、活动目标1.加深对有机化合物分子结构的认识2.初步了解使用模型研究物质结构的方法二、活动背景有机化合物广泛存在于社会生活、工农业生产和科学研究等各个领域,有机物的大量使用丰富了人们的盛产生活,提高了人类生存质量,有机物在人类生活在扮演了非常重要的角色,在材料,医药,农业,建筑等方面举足轻重,有机化学的学习在其它交叉学科都有较强的基础性,构建有机物结构分析模型,可以在教学中落实有机化学学科思想,帮助学生形成分析有机物的思路和方法。
三、活动形式每组4-6人,自愿组合,推选一名为组长。
四、活动过程1、材料:橡皮泥、黏土、泡沫塑料、牙签、小木棍等2、搭建球棍模型:(1)搭建甲烷分子的球棍模型。
甲烷分子的球棍模型:(2)搭建乙烷、乙烯和乙炔分子的球棍模型,比较三者的立体结构。
乙烷、乙烯和乙炔分子的球棍模型分别为:五、思考1、通过以上有机物分子球棍模型的搭建,归纳碳原子的成键特征和各类烃分子中的化学键类型。
答案:每个碳原子形成4个共价键;烷烃中含有碳碳单键及碳氢键,烯烃中含有碳碳双键及碳氢键,可能有碳碳单键,炔烃中含有碳碳三键及碳氢键,可能有碳碳单键。
2、根据二氯甲烷的结构式推测其是否有同分异构体,并通过搭建球棍模型进行验证,体会结构式与分子立体结构之间的关系。
答案:二氯甲烷可看作是甲烷中的2个氢原子被2个氯原子所代替的产物,与甲烷的结构相似,故其不存在同分异构体。
3、分子中含有4个碳原子的烃可能有哪些结构?尝试用球棍模型进行探究。
答案:分子中含有4个碳原子的烃可能有CH3CH2CH2CH3、六、展示、评价成果1、结合实践,从化学键、最外层电子数的角度解释论证“碳四价”原则2、小组间互评、教师评价。
3.2化学变化的本质(微观解释)--球棍模型展开全文3.2 分子是保持物质化学性质的最小粒子由分子构成的物质在发生物理变化的时候,分子本身没有发生变化,比如物质在发生三态变化的时候,只是分子的间隔发生了变化,比如物质的固态、液态、气态我们可以这样理解:1化学变化的本质1.我们已经知道了物理变化的本质,那么化学变化的本质是什么呢?我们写一写碳燃烧反应式,画一下碳燃烧过程的球棍模型:起始状态和终了状态就是化学反应式的前后,注意中间的状态。
同样地,我们尝试写一下过氧化氢分子分解的过程:最终,许多的水分子聚集成水这种物质,许多的氧分子聚集成氧气这种物质。
之前我们已经知道,化学变化和物理变化的区别是,化学变化有新物质生成,其实就是原来的分子变成了别的分子。
通过这几个球棍模型,我们可以分析出化学变化的本质:分子分解为原子,原子重新组成新分子。
在化学变化中,分子的种类变了,而原子的种类、个数都没变。
(如同乐高积木,就是那些积木,开始能拼成个房子,后来拆了,又组成个卡车)更直白一点说,化学变化就是那些个原子原来是这种分子的一部分,后来打散了,又组合成了别的分子。
翻来覆去就是那些原子,只不过是这样组还是那样组。
综上我们可以得出推论:此反应中,分子的种类变了,分子的个数没变,原子的种类和个数都没有变。
总结:由分子构成的物质,分子是保持其化学性质的最小粒子;化学变化的本质是分子分解为原子,原子又重新结合成新分子。
2分子是保持其化学性质的最小粒子由分子构成的物质,发生化学变化的时候,原来的分子会变成别的分子。
比如过氧化氢制取氧气的时候,分子分解的过程:开始是过氧化氢分子,后来就变成了水分子和氧分子。
反应物和生成物是完全不同的两种分子。
原分子的化学性质不再保持,因为原分子变成别的了。
所以,由分子构成的物质,分子是保持其化学性质的最小粒子。
比如氮气,保持其化学性质的最小粒子就是氮气分子,N2。
比如水,保持其化学性质的最小粒子是水分子,H2O。