第十三章 代羧酸
- 格式:doc
- 大小:729.00 KB
- 文档页数:8
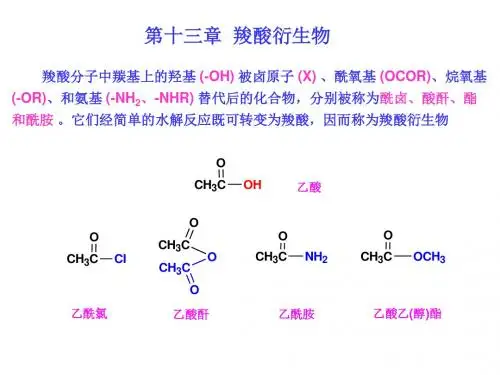




第十三章 取代羧酸碳链或碳环上的氢被其他原子或基团取代所生成的化合物,称为取代羧酸。
常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等,它们无论在有机合成或生物代谢中,都是十分重要的。
第一节 羟基酸的分类、命名和来源定义:分子中同时含有羟基和羧基得化合物叫做羟基酸。
一、 分类羟基酸可以分为醇酸和酚酸两类,羟基连接在碳链上的叫做醇酸;羟基连接在芳环上的叫做酚酸。
二、 命名羟基酸的命名常根据它的来源而采用俗名,也可以把它们看成是羧酸的羟基取代物来命名。
根据分子中羟基和羰基的相对位置,有α、β、γ……等羟基酸,或按系统命名编号,羧基碳原子编号为1,选择含羟基和羧基的最长碳链为主链。
如:COOH CH 2CH COOHCOOH CH CH COOHOH OH OH CH 3CH OHCOOHCOOHOH2-羟基丙酸(乳酸)羟基丁二酸(苹果酸)2,3-二羟基丁二酸 (洒石酸)2,3-二羟基丁二酸 (洒石酸)三、 来源羟基酸有的可用生物化学法制备,如乳酸。
化学合成法可从含羟基的化合物中引入羧基或含羧基的化合物中引入含羟基,或同时引入羟基或羧基。
1、卤代酸水解:ClCH 2COOHH 2OHOCH 2CH 2COOHH +2、氰醇水解:HOCH 2CH 2ClNaCNHOCH 2CH 2HOCH 2CH 2COOH3、Reformatsky 反应:R CHO +BrCH 2COOC 2H Zn R CHCH 2COOC 2H 5R CHCH 2COOC 2H 5OHR CHCH 2COOH OHH 2O H +4、LDA 法:CH 3C O H 2OH+LDA COOC 2H 5C OCOOC 2H 53)2C C OCOOC 2H 5(CH 3)2C第二节 羟基酸的性质羟基分子中含有羟基和羧基,两者都能和水形成氢键,所以羟基酸一般比相应的酸易溶于水。
羟基酸具有醇与酸的典型反应性能,并且由于羟基和羧基的相互影响,又表现出一些为羟基酸特有的性质。



第十三章羧酸1. 羧酸的分类自然界存在的脂肪中,含有大量的高级的一元饱和羧酸,因此一元饱和羧酸亦称为脂肪酸。
羧酸在自然界广泛存在,而且对人类生活非常重要,如食用的醋,就是2%的醋酸;日常使用的肥皂,是高级脂肪酸的钠盐;食用的油,是羧酸甘油脂。
2. 羧酸的物理性质低级脂肪酸是液体,可溶于水,具有刺鼻的气味。
中级脂肪酸也是液体,部分地溶于水,具有难闻的气味。
高级脂肪酸是蜡状固体。
无味,在水中溶解度不大。
羧酸沸点高,是因为羧羰基氧的电负性较强,使电子偏向氧,可以接近质子,所以能形成二缔合体。
所有的二元酸都是结晶化合物。
在脂肪二元酸中,单数碳原子的二元酸比少一个碳的双数碳原子的二元酸溶解度大、熔点低,因为单数的二元酸,-COOH 在同一侧。
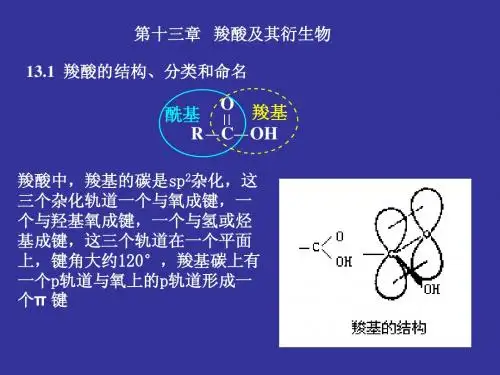
(P 132类比烷烃)3. 羧酸及羧酸盐的结构在羧酸分子中,羧基碳原子以sp 2杂化轨道分别与烃基和两个氧原子形成3个σ键,这3个σ键在同一个平面上,剩余的一个p 电子与氧原子形成π键,构成了羧基中C=O 的π键,但羧基中的-OH 部分上的氧有一对未共用电子,可与π键形成p-π共轭体系。
由于p-π共轭,-OH 基上的氧原子上的电子云向羰基移动,O-H 间的电子云更靠近氧原子,使得O-H 键的极性增强,有利于H 原子的离解。
所以羧酸的酸性强于醇。
当羧酸离解出H沸点:羧酸>醇>醛酮>烃/醚 羧酸:氢键、二缔合体 醇:氢键醛酮:偶极矩大烃/醚:无氢键、偶极矩小后,p-π共轭更加完全,键长发生平均化,-COOˉ基团上的负电荷不再集中在一个氧原子上,而是平均分配在两个氧原子上。
4.羧酸的反应——主要在羧基和α-H上进行(1)酸性羟基氧上的孤电子对可以通过与碳氧双键的共轭,使氧上的电子云向碳氧双键转移,这样的结果是:①使氢氧键之间的电子云进一步向羟基氧原子转移,使氢正离子更易离去;②使形成的羧酸根负离子因电荷分散而更加稳定。
在这样的离域体系中,负电荷分散在两个氧上,形成一个具有4电子三中心的离域π分子轨道,即连个碳氧键的键长相等,为等价的。
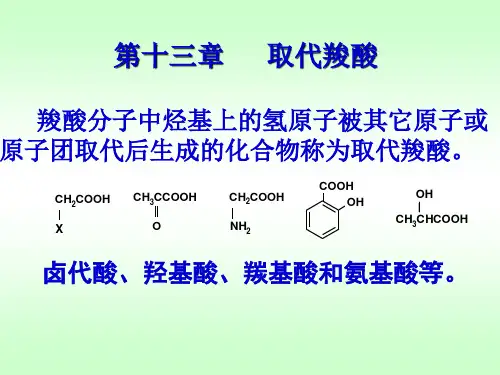
第十三章 取代羧酸碳链或碳环上的氢被其他原子或基团取代所生成的化合物,称为取代羧酸。
常见的取代羧酸有卤代酸、羟基酸、羰基酸和氨基酸等,它们无论在有机合成或生物代谢中,都是十分重要的。
第一节 羟基酸的分类、命名和来源定义:分子中同时含有羟基和羧基得化合物叫做羟基酸。
一、 分类羟基酸可以分为醇酸和酚酸两类,羟基连接在碳链上的叫做醇酸;羟基连接在芳环上的叫做酚酸。
二、 命名羟基酸的命名常根据它的来源而采用俗名,也可以把它们看成是羧酸的羟基取代物来命名。
根据分子中羟基和羰基的相对位置,有α、β、γ……等羟基酸,或按系统命名编号,羧基碳原子编号为1,选择含羟基和羧基的最长碳链为主链。
如:COOH CH 2CH COOHCOOH CH CH COOHOH OH OH CH 3CH OHCOOHCOOHOH2-羟基丙酸(乳酸)羟基丁二酸(苹果酸)2,3-二羟基丁二酸 (洒石酸)2,3-二羟基丁二酸 (洒石酸)三、 来源羟基酸有的可用生物化学法制备,如乳酸。
化学合成法可从含羟基的化合物中引入羧基或含羧基的化合物中引入含羟基,或同时引入羟基或羧基。
1、卤代酸水解:ClCH 2COOHH 2OHOCH 2CH 2COOHH +2、氰醇水解:HOCH 2CH 2ClNaCNHOCH 2CH 2HOCH 2CH 2COOH3、Reformatsky 反应:R CHO +BrCH 2COOC 2H Zn R CHCH 2COOC 2H 5R CHCH 2COOC 2H 5OHR CHCH 2COOH OHH 2O H +4、LDA 法:CH 3C O H 2OH+LDA COOC 2H 5C OCOOC 2H 53)2C C OCOOC 2H 5(CH 3)2C第二节 羟基酸的性质羟基分子中含有羟基和羧基,两者都能和水形成氢键,所以羟基酸一般比相应的酸易溶于水。
羟基酸具有醇与酸的典型反应性能,并且由于羟基和羧基的相互影响,又表现出一些为羟基酸特有的性质。
这些性质又和羟基和羧基的相对位置有关。
一、 物理性质1、多为结晶固体,或为糖浆状液体。
2、由于分子中同时含羟基和羧基两个极性基团,可形成氢键,水溶性较大。
二、 化学性质醇酸既具有醇和羧酸的一般性质,如醇羟基可以氧化、酰化、酯化;羧基可以成盐、成酯等,又由于羟基和羧基的相互影响,而具有一些特殊的性质。
1、酸性:由于羟基的吸电子性,其酸性比羧酸强。
增强的程度与羟基在烃基的位置有关。
(1)醇酸的-OH 在烃基上的位置,距-COOH 越近,酸性越强。
CH 3CH 2COOH < OHCH 2CH 2COOH < CH 3CHOHCOOHpK a 3.86 4.51 4.88 (2)酚酸:邻羟基苯甲酸可形成分子内氢键而使酸性增强COOHOHCOOH COOHCOOHOH>>>OH2、脱水:(1)α-羟基酸——两分子间相互酯化,生成交酯。
R CH C OH OH OOH CHR C OHO R C O OCO OCHR +2H 2O(2)β-羟基酸——分子内脱水形成α,β- 不饱和酸+H 2O△RCH H C OHHCOOHRC H C HCOOH(3)γ或δ羟基酸--发生分子内的酯化,产物叫内酯OH OH OOO+H 2OOH OH OOO +H 2O γ-丁内酯δ-戊内酯3、氧化:α-羟基酸中的羟基比醇羟基容易氧化。
土伦试剂与醇不发生反应,但能把α-羟基酸氧化为α-羰基酸。
CH 3CHCOOH32+CH 3CCOOH-CO 2CH 3C HRCHCH 2COOH OHAg(NH )+RCCH 2COOH -CO 2C R CH 34、脱羧——可用于从高级羧酸合成减少一个碳原子的醛酮稀R CH OHCOOHRCHO HCOOHH 2SO 4+RCH 2COOHRCCOOH -CO 2C R H Br 2RCCOOH H 3O +第三节 重要的羟基酸酸一、乳酸乳酸:为无色粘稠液体,有很强的吸湿性和酸味,溶于水、乙醇、甘油和乙醚,不溶于氯仿和油脂。
(1)结构: H 3C HC COOH(2)存在:酸牛奶(外消旋)、蔗糖发酵(左旋的)、肌肉中(右旋的)。
(3)用途:具有很强的吸湿性;工业上作除钙剂(钙盐不溶于水);食品工业中作增酸剂;钙盐可补钙。
二、苹果酸苹果酸:为针状结晶,易溶于水和乙醇,微溶于乙醚。
苹果酸在酶的催化下生成草酰乙酸。
(1)结构:HOCH COOH CH 2COOH(2)存在:未成熟的果实内;植物的叶子中;自然界中存在的是左旋体。
(3)用途:制药和食品工业,在食品工业中用作酸味剂。
三、酒石酸洒石酸:是透明棱形晶体,有很强的酸味,易溶于水。
(1)结构:H HC HOCOOH COOH HO(2)存在:多种水果中;或以盐的形式存在于水果中。
(3)用途:可用作酸味剂,常用于配制饮料,其锑钾盐有抗血吸虫作用。
四、柠檬酸柠檬酸:为无色结晶,含一分子结晶水,易溶于水、乙醇和乙醚,有强酸味。
(1)结构:CH C HO COOH COOH HOH 2CCOOH(2)存在:多种植物的果实中;动物组织与体液中,为无色晶体。
(3)用途:食品工业的调味品(有酸味),也用于制药业。
五、水杨酸水杨酸:为无色针状结晶,微溶于冷水,易溶于乙醇、乙醚和热水。
(1)结构:OHCOOH(2)来源:采用工业合成法——Kolbe-Schmidt 反应2加压OCOONaOH COONaH +OHCOOHH重排(3)性质:它具有酚和羧酸的一般性质,如易被氧化、遇三氯化铁显紫红色,酸性比苯甲酸强等。
其在醋酸溶液中和乙酐共热,则生成乙酰水杨酸,俗称“阿斯匹林”。
(4)用途:乙酰水扬酸即阿司匹灵有解热、镇痛作用,能抑制血小板凝聚,防止血栓的形成。
六、没食子酸没食子酸:又称五倍子酸。
纯粹的没食子酸为白色结晶性粉末,能溶于水、乙醇和乙醚。
(1)结构:COOHOHHOOH(2)存在:为无色晶体,以丹宁形式存在于许多植物中。
(丹宁是一种天然产物) (3)性质:没食子酸有较强还原性,极易被氧化,露置在空气中能迅速氧化呈暗褐色。
(4)用途:可用作抗氧剂的影像显影剂。
没食子酸与三氯化铁产生蓝黑色沉淀,可用来制造墨水。
第四节 羰基酸的分类、命名定义:分子中既含有羰基,又含有羧基的化合物称为羰基酸。
如丙酮酸、3-丁酮酸等。
一、 分类根据所含的是醛基还是酮基,将其分为醛酸(羰基在碳链的一端)和酮酸(羰基在碳链的当中)。
根据羰基和羧基的相对位置不同,又可以把它们分为、、等醛酸或酮酸。
二、 命名基酸的命名与醇酸相似,以羧酸为母体,羰基作为取代基,羰基的位次用阿拉伯数字或用希腊字母表示。
如:H C OCOOHH C OCH 2COOHCH 3C OCOOHCH 3C OCH 2COOH乙醛酸 β-丙醛酸 丙酮酸 3-丁酮酸(β-丁酮酸)三、 性质:1. 羰基酸具有羰基和羧酸的典型反应。
2. 酮酸的特性反应(1)α-与稀硫酸共热时,脱羧生成醛。
(2)β-酮酸受热易脱羧生成酮。
第五节 重要的羰基酸 一、 乙醛酸乙醛酸,为无色糖浆状液体,易溶于水。
存在于未成熟的水果和动物组织中。
1、康尼扎罗反应:CHOCOOH CH 2OH COONa COONa +2NaOH2、水合:CHOOHH C O COOHH 2OHOHO二、 丙酮酸丙酮酸,是动植物体内碳水化合物和蛋白质代谢的中间产物。
为无色有刺激性气味的液体,可与水混溶,酸性比丙酮和乳酸都强。
1、 制备:H 3C HC COOHH 3C C COOH2、 性质:H 3C C COOHH 2SO 4CH 3CHO +CO 2三、 乙酰乙酸乙酰乙酸:又称β-丁酮酸。
是有机体内脂肪代谢的中间产物。
糖尿病患者脂肪的新陈代谢不能正常进行,在尿中排泄出丙酮和乙酰乙酸来,在病理学上叫做丙酮体。
1、 乙酰乙酸的结构:CH 3COCH 2COOH 是β—酮酸。
2、 β—酮酸的共性--受热脱羧:CO 2H 3C C CH 2COOH+△3C C CH 3四、 乙酰乙酸乙酯乙酰乙酸乙酯是一种无色液体,在有机合成上又重要意义。
1、 结构:H 3C C CH 2COOCH 2CH 3O2、 制备:工业上用乙烯酮二聚制备;实验室用Claisen (克莱森)酯缩合,两分子乙酸乙酯在EtONa作用下起缩合反应制备 。
CH 3C O OC 2H 5+CH 3C O OC 2H 5C 2H 5ONa CH 3C O CH 2C OOC 2H 53、 性质:(1) 与金属Na 反应放出H2生成钠盐,说明含活泼H 。
(2) 与Br2/CCl4溶液反应褪色,说明含不饱和键。
(3) 与FeCl3溶液呈紫色反应 ,说明含C=C-OH 烯醇式结构。
(4) 与羟胺、苯肼等生成苯腙,说明含C=O 。
(5) 与HCN 、NaHSO3等反应。
4、 互变异构:H 3C O H 2C COOEtH 3C C HCO OEtOH 室温92.5 %酮式7.5%烯醇式生成的烯醇式稳定的原因:1°形成共轭体系,降低了体系的内能。
2°烯醇结构可形成分子内氢键(形成较稳定的六元环体系)。
5、 与亚甲基活泼H 的反应:H 3C C O C H 2C OOEtEtONaH 3C C O H C C O OEt -Na +RXH 3C O CH C O OEtEtONa R`XH 3C C O C C OOEtR`注意:*RX 一般不宜用30RX 和乙烯式卤代烃,最好用10RX 。
*如在亚甲基上引入两个取代基,通常第一次引入较大的基团。
6、 酮式分解和酸式分解:H 3C C OH C CORCH 3COCH 2R RCH 2COOH 酮式分解酸式分解酮式分解酸式分解(1)酮式分解:乙酰乙酸乙酯受稀碱(5%-10%)作用,发生皂化,加热则脱羧生成酮。
(2)酸式分解;乙酰乙酸乙酯用强碱(40%-50%)溶液,加热所得到的主要产物是酸。
7、 乙酰乙酸乙酯在合成中的应用:由于乙酰乙酸乙酯的上述性质,我们可以通过亚甲基上的取代,引入各种不同的基团后,再经酮式分解或酸式分解,就可以得到不同结构的酮或酸:a. 合成甲基酮. b. 合成二元酮. c. 合成一元酸. d. 合成二元酸. e. 合成酮酸。
H 3O +CH 3C O CH 2C O OC 2H 51) EtONa2225CH 3C O CH C OOC 2H 52COOC 2H 5CH 3C O CH 2CH 2COOC 2H 5CH 3C OCH 2CH 2COOH CH 3COOH + HOOCCH 2CH 2COOH与酰氯或酸酐反应,可合成β-二酮等:10%NaOHCH 3C O CH 2C OOC 2H 51) EtONa CH 3C O CH C OOC 2H 5COR40%NaOHRC OCH 2COOH CH 3C O CH 2C O R-二酮10%NaOHCH 3C O CH 2C O OC 22CH 3C O CH C OOC 2H 5CH 2COR40%NaOHCH 3C O CH 2C OR CH 2C O RCH 2CH 2COOH2,4-二酮五、 丙二酸酯的合成和应用1、 制备:ClCH 2232COONa NaCN 2COOH C 2H 5OH+2(COOC 2H 5)22、在合成中的应用:a. 合成一元酸; b. 合成二元酸; c. 合成环状化合物酸3、 化学性质: (1)、合成增加两个碳的羧酸:2) 2 R-XCH 2(COOC 2H 52R 2C(COOC 2H 5)H 3O +2R 2CH 2COOHCH 2(COOC 2H 5)2CH(COOC 2H 5)2R H 3O +2CH 2COOH R(2)、合成二元羧酸:1) EtONa 2) BrCH 2CH 2Br CH 2(COOC 2H 5)CH(COOC 2H 5)H 3O -CO 22H 5)CHCH 2COOH2COOH1) EtONa CH 2(COOC 2H 5)2RC(COOC 2H 5)2H 3O +-CO 2225CH(COOC 2H 5)2R 2COOC 2H 5CH 2COOHR 2COOH(3)、合成环状羧酸:1) 2 EtONa22CH 2(COOC 2H 5)2H 3O +-CO 2COOHCOOC 2H 5COOC 2H 5(4)、迈克尔加成--Michael addition :EtOHCH 2(COOC 2H 5)2H 3O +-CO 2O+OCH(COOC 2H 5)OCH 2COOH历程:CH 2(COOC 2H 5)EtONaCH(COOC 2H 5)OCH(COOC 2H 5)2EtOHOHCH(COOC 2H 5)2OCH(COOC 2H 5)2其他具有显著酸性氢的化合物也能发生迈克尔加成:OCH 3CH 3H +HC C OPhCH 2EtOK OCH 3CH 3CH 2CH 2C O Ph(5)、鲁宾逊(Robinson)关环:+OCH 3CH CH 2O OCH 3OOHO +C OCH 3CH CH 2O OCH 3羟醛缩合OOCH CH 3CH 3CH 3(6)、Knoevenagel 缩合反应:CH 2(COOC 2H 5)CHO+CH C(COOEt)CH CHCOOHCH 2(COOC 2H 5)+CHO O。