第十三章羧酸
- 格式:ppt
- 大小:536.50 KB
- 文档页数:19



![[工学]第十三章--羧酸及其衍生物PPT课件](https://uimg.taocdn.com/b7c4094d53d380eb6294dd88d0d233d4b04e3f5c.webp)





第十三章羧酸1. 羧酸的分类自然界存在的脂肪中,含有大量的高级的一元饱和羧酸,因此一元饱和羧酸亦称为脂肪酸。
羧酸在自然界广泛存在,而且对人类生活非常重要,如食用的醋,就是2%的醋酸;日常使用的肥皂,是高级脂肪酸的钠盐;食用的油,是羧酸甘油脂。
2. 羧酸的物理性质低级脂肪酸是液体,可溶于水,具有刺鼻的气味。
中级脂肪酸也是液体,部分地溶于水,具有难闻的气味。
高级脂肪酸是蜡状固体。
无味,在水中溶解度不大。
羧酸沸点高,是因为羧羰基氧的电负性较强,使电子偏向氧,可以接近质子,所以能形成二缔合体。
所有的二元酸都是结晶化合物。
在脂肪二元酸中,单数碳原子的二元酸比少一个碳的双数碳原子的二元酸溶解度大、熔点低,因为单数的二元酸,-COOH 在同一侧。
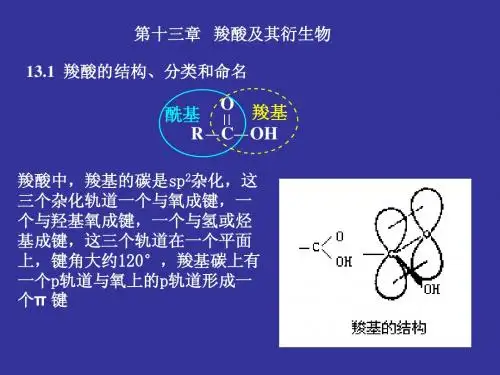
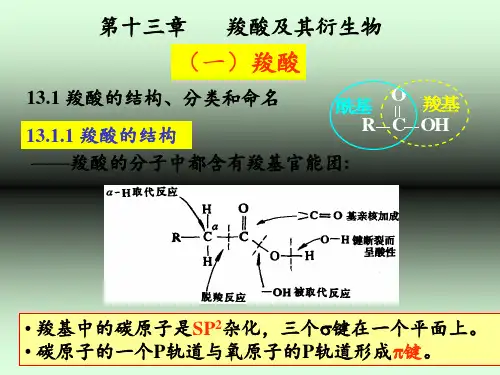
(P 132类比烷烃)3. 羧酸及羧酸盐的结构在羧酸分子中,羧基碳原子以sp 2杂化轨道分别与烃基和两个氧原子形成3个σ键,这3个σ键在同一个平面上,剩余的一个p 电子与氧原子形成π键,构成了羧基中C=O 的π键,但羧基中的-OH 部分上的氧有一对未共用电子,可与π键形成p-π共轭体系。
由于p-π共轭,-OH 基上的氧原子上的电子云向羰基移动,O-H 间的电子云更靠近氧原子,使得O-H 键的极性增强,有利于H 原子的离解。
所以羧酸的酸性强于醇。
当羧酸离解出H沸点:羧酸>醇>醛酮>烃/醚 羧酸:氢键、二缔合体 醇:氢键醛酮:偶极矩大烃/醚:无氢键、偶极矩小后,p-π共轭更加完全,键长发生平均化,-COOˉ基团上的负电荷不再集中在一个氧原子上,而是平均分配在两个氧原子上。
4.羧酸的反应——主要在羧基和α-H上进行(1)酸性羟基氧上的孤电子对可以通过与碳氧双键的共轭,使氧上的电子云向碳氧双键转移,这样的结果是:①使氢氧键之间的电子云进一步向羟基氧原子转移,使氢正离子更易离去;②使形成的羧酸根负离子因电荷分散而更加稳定。
在这样的离域体系中,负电荷分散在两个氧上,形成一个具有4电子三中心的离域π分子轨道,即连个碳氧键的键长相等,为等价的。