制剂处方工艺资料要求解读
- 格式:ppt
- 大小:209.00 KB
- 文档页数:1

口服固体制剂处方工艺变更的技术要求及案例分析口服固体制剂是指通过口腔摄取入体的固体剂型,如片剂、胶囊、颗粒、颗粒包衣等。
在药品生产中,由于药品本身性质、市场需求或生产工艺的改进等原因,可能需要对口服固体制剂的处方工艺进行变更。
下面将探讨口服固体制剂的处方工艺变更的技术要求及案例分析。
技术要求:1.药品质量保持稳定:任何工艺变更都不能对药品的质量造成负面影响。
当工艺变更时,应确保药品的质量指标能够得到维持或提高,如药物的含量一致性、释放速率、溶解度、溶出度等。
3.注重可操作性:工艺变更后,工艺流程应尽可能简化,以提高生产效率。
同时,在实际操作中也应考虑到人工误操作的可能性,减少人为因素对制剂质量的影响。
4.严格的验证和验证:对于工艺变更,应进行验证和验证来确保制剂质量的稳定性和一致性。
验证过程应包括物理化学测试、溶出度和生物等效性测试,以评估新的制剂工艺对药品质量的影响。
5.严格的记录和追溯:所有工艺变更都应有详细的记录,包括变更的原因、实施的工艺流程和验证结果等。
这些信息应该在需要时能够追溯,以确保药品的可追溯性和质量的连续性。
案例分析:一家制药公司生产一种口服胶囊剂,近期市场需求增加,需要提高生产效率。
为此,公司决定对胶囊剂的处方工艺进行变更,以增加生产速度并减少产品变异性。
首先,公司对现有工艺流程进行了仔细审查,并确定了可以进行改进的几个关键步骤。
在原有工艺流程中,胶囊壳和药物粉末是分别加工的,并且存在一定的分离问题。
为了改善这一问题,公司决定采用直接填充法,即在填充胶囊壳之前,将胶囊壳和药物粉末一起加工和混合。
在工艺变更过程中1.药品质量保持稳定:通过工艺变更后,药品的含量一致性和整体质量应保持稳定。
公司进行了多批次的生产和测试,以确保药物粉末的均匀性和含量一致性。
3.注重可操作性:新工艺流程应尽可能简化,并且考虑到操作人员的实际操作。
公司提供了详细的操作指南,并对工艺变更进行了培训,以确保操作人员正确执行新的工艺流程。





化学药品制剂处方工艺变更研究技术要求及案例分析主要内容:⏹制剂处方中辅料变更研究总体考虑⏹制剂处方中辅料变更研究分类⏹制剂生产工艺变更研究⏹化学药品注射剂处方工艺变更研究注意事项⏹制剂处方工艺变更不批准原因及分析⏹总结一、制剂处方中辅料变更研究总体考虑制剂处方中已有药用要求的辅料变更分类变更辅料来源、型号及级别变更辅料用量变更辅料种类变更关联可能涉及上述多种情况的变更,需考虑进行各自相应的研究工作,但研究工作总体上应按照技术要求较高的类别进行⏹制剂处方发生变更后,需更具变更的情况进行相应的研究工作,评估变更对药品的安全性、有效性和质量可控性的影响⏹研究工作应根据以下方面综合进行变更的具体项目变更对药品的影响程度制剂的特性....................研究工作重点关注的方面辅料的性质是否影响制剂药物溶出/释放的关键性辅料非释药控制性辅料:如:填充剂、助流剂等释药控制性辅料:缓释材料种类或用量:调节渗透泵等药物释放物质种类或用量,经皮给药制剂中促渗剂种类或用量表面活性剂:如吐温-80等**影响药物稀释行为,进而可能影响人体生物利用度研究工作重点关注的方面生产过程乳剂乳化过程原料药加入顺序...............研究工作重点方面制剂特点不同特性制剂,处方、工艺变更对质量、疗效和安全性造成的影响释缓、控缓制剂一般需要在较长时间内缓慢释放,生产、质控较普通制剂难度大一般认为缓控释剂工艺处方变更对产品影响较普通制剂大,对生物利用度造成的影响很难通过体外研究工作分析和预测,可能需要人体生物利用度研究证明研究工作重点方面药物生物学性质治疗窗窄的药物,处方变更可能会对药品安全性和有效性造成显著影响,需要进行全面、严格的研究工作来支持比恩更的合理性药物药代动力学特点在临床治疗剂量范围内药物的药代动力学呈线性关系,且吸收完全药物为非线性动力学模式,处方工艺变更带来的微小变化可能造成体内血药水平显著波动,需进行全面研究研究工作重点方面研究用样品变更研究发生于产品已经获准上市后阶段,研究验证工作需采用中试以上规模的样品变更研究前后质量比较研究(如溶出度、释放度等)一般采用变更前3批生产规模样品和变更后1-3批样品进行二、制剂处方中辅料变更研究分类辅料变更分类Ⅱ类变更,属于中等变更,需通过相应的研究工作证明变更对产品品质不产生影响Ⅲ类变更,属于较大变更,需通过相应的研究工作证明变更对产品品质不产生负面影响辅料变更分类Ⅱ类变更:有限定条件,一般可以通过药学研究证明变更对产品质量不产生影响,不需要进行体内研究变更辅料来源、型号及级别变更辅料用量变更辅料种类变更辅料来源、型号及级别(Ⅱ类变更)变更条件:辅料种类、功能和特性没有改变例如:植物源性或合成辅料替代动物源性辅料:玉米淀粉代替小麦淀粉,微晶纤维素PH200代替微晶纤维素PH101等(注意:辅料特性与功能变更的不属于此类的变更范围,例如淀粉变更为预胶化淀粉、羚甲基淀粉钠等)变更辅料来源、型号及级别(Ⅱ类变更)此类变更可能引起颗粒粉流动性,含量均匀度或重量变异、药物溶出度等方面的变化,需更具变更的具体情况进行相应的研究验证工作此类变更一般认为不会对药物质量产生显著影响。

制剂处方工艺开发研究的流程和关键点解读制剂处方工艺开发是药物研发和生产的重要环节,它涉及到药物的合理配方设计、工艺流程优化和质量控制等多个方面。
本文将对制剂处方工艺开发的流程和关键点进行解读。
制剂处方工艺开发的流程通常包括以下几个步骤:1. 药物特性评估:首先需要对所研发的药物进行全面的特性评估,包括药物的物理化学性质、药动学特点、药物相容性等。
这些评估结果对后续的工艺开发和质量控制有重要指导意义。
2. 配方设计:基于药物特性评估的结果,设计切实可行的药物配方。
合理的配方应该考虑到药物的溶解度、稳定性、可制备性等方面。
常见的配方成分包括活性药物、辅料、流变剂、溶剂等。
3. 工艺流程开发:根据配方,开发适合的工艺流程。
该流程应该考虑到工艺条件、操作步骤、加工设备等因素。
在制剂过程中,需要注意的关键点包括溶解、混合、过滤、清洗、干燥等环节。
4. 质量控制方法开发:制剂处方工艺开发的关键之一是开发适用的质量控制方法。
这些方法可以包括理化指标测定、微生物检测、稳定性测试等。
质量控制方法的开发应该满足相关法规和标准的要求,并保证对药物质量的全面评估。
5. 试验批生产:在工艺流程和质量控制方法开发完成后,进行试验批生产。
通过验证试验批的质量指标,判定工艺流程和质量控制方法的可行性和可靠性。
关键点解读:制剂处方工艺开发的关键点有以下几个方面:1. 药物特性的准确评估:对药物特性进行准确的评估,为后续配方设计和工艺流程开发提供可靠依据。
2. 合理的配方设计:根据药物的特性和要求,设计合理的配方,确保药物的稳定性和可制备性。
3. 工艺流程的优化:优化工艺流程,确保流程的合理性、高效性和可扩展性。
关注关键环节,如溶解、混合、过滤等,确保工艺操作的准确性和稳定性。
4. 质量控制方法的可靠性:开发可靠的质量控制方法,确保准确、全面地评估药物的质量。
这些方法应符合法规和标准的要求,并具备良好的重复性和可操作性。
5. 试验批生产的验证:通过试验批生产,验证工艺流程和质量控制方法的可行性和有效性。
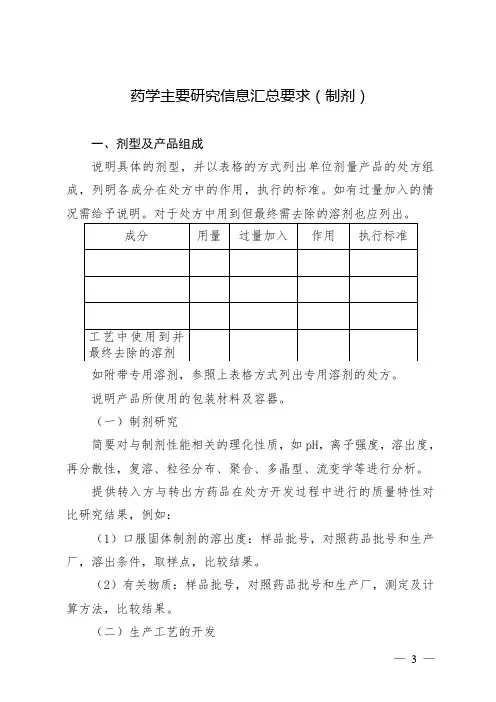
药学主要研究信息汇总要求(制剂)一、剂型及产品组成说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
如附带专用溶剂,参照上表格方式列出专用溶剂的处方。
说明产品所使用的包装材料及容器。
(一)制剂研究简要对与制剂性能相关的理化性质,如pH,离子强度,溶出度,再分散性,复溶、粒径分布、聚合、多晶型、流变学等进行分析。
提供转入方与转出方药品在处方开发过程中进行的质量特性对比研究结果,例如:(1)口服固体制剂的溶出度:样品批号,对照药品批号和生产厂,溶出条件,取样点,比较结果。
(2)有关物质:样品批号,对照药品批号和生产厂,测定及计算方法,比较结果。
(二)生产工艺的开发汇总研发过程中代表性批次的样品情况,包括:批号、生产时间及地点、批规模、用途(如用于稳定性试验,用于生物等效性试验等)、分析结果(例如有关物质、溶出度以及其他主要质量指标)。
示例如下:批分析汇总包装材料/容器注明详细参见的申报资料项目表“3.药学研究资料”中资料的项目和页码。
注1:关于包材类型,需写明结构材料、规格等。
例如,五层共挤膜输液袋,规格为内层:改性乙烯/丙烯聚合物;第二层:聚乙烯;第三层:聚乙烯;第四层:乙烯甲基丙烯酸酯聚合物;第五层:多酯共聚物。
聚丙烯输液瓶,规格为250ml。
铝塑泡罩包装,组成为: 3.2.PVC/铝、3.2.PVC/3.2.PE/3.2.PVDC/铝、3.2.PVC/3.2.PVDC/铝。
复合膜袋包装,组成为:聚酯/铝/聚乙烯复合膜袋、聚酯/低密度聚乙烯复合膜袋。
注2:表中的配件一栏应包括所有使用的直接接触药品的包材配件。
如:塑料输液容器用组合盖、塑料输液容器用接口等。
(三)相容性简述制剂和附带溶剂或者给药装置的相容性。
注明详细参见的申报资料项目表“3.药学研究资料”中资料的项目和页码。
二、生产(一)生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。


化学药物制剂处方及工艺研究申报资料技术要求及案例分一、技术要求:1.药物制剂处方的合理性:申报资料中应明确药物制剂的处方,并说明组分及其含量的合理性、配伍性、稳定性等。
2.工艺流程的合理性:申报资料中需详细描述工艺流程,并说明每一步的条件(温度、压力、pH值等)、反应机理、产物纯度等。
3.原材料的选择与质量要求:申报资料中需说明所使用的原材料的选择及其质量要求,包括药物活性成分、辅料、溶剂等,以及其供应商、采购标准等信息。
4.产品质量控制的技术要求:申报资料中需阐明产品的质量控制方法,包括物理性质、理化性质、药代动力学、稳定性等指标的测试方法及标准。
5.安全性评价与相关监测:申报资料中应详细描述药物制剂的毒理学研究,包括急性毒性、亚急性毒性、慢性毒性、致癌性、致突变性、致畸性等评价结果,并给出相关监测结果及安全性评价。
6.环境影响评价:申报资料中应对药物制剂的环境影响进行评价,包括制剂废水、废气的处理方法及标准,对环境的影响评价结果等。
7.合理性与可行性的论证:申报资料中应对药物制剂的合理性及可行性进行详细论证,包括市场需求及竞争情况、技术优势、经济效益等方面的论述。
二、案例分析:申请人申报了一种新型口服抗病毒药物制剂的研究项目,以下是其中的技术要求和案例分析:1.药物制剂处方的合理性:新制剂处方中加入了一种新型抗病毒活性成分,并对配方中各组分进行了合理、科学的配比,以提高疗效和降低副作用。
2.工艺流程的合理性:申报资料详细描述了药物制剂的工艺流程,包括固体制剂的粉碎、混合、制粒以及液体制剂的溶解、调整pH值、灭菌等步骤。
通过合理的工艺控制,保证了产品的质量和稳定性。
3.原材料的选择与质量要求:申报资料中说明了所使用的原材料的选择原则,包括药物活性成分的纯度要求、辅料的稳定性等。
在申报中还提供了原材料供应商、供应质量标准的相关证明文件。
4.产品质量控制的技术要求:申报资料中给出了产品的质量控制方法,包括物理性质、理化性质、含量测定等指标的测试方法及标准。

化学药物制剂处方及工艺研究引言化学药物制剂是指将化学药物以一定的剂型和工艺进行加工和制备,以便更好地满足临床应用的需求。
处方和工艺的研究是化学药物制剂研发的重要环节,对于保证药物的质量、疗效以及患者的安全具有重要意义。
本文将讨论化学药物制剂处方及工艺研究的主要内容和方法。
一、处方研究处方研究是化学药物制剂研究的基础,它涉及到药物的剂型、组成成分、理化性质等方面的探究。
通过合理的处方设计,可以确保药物在使用过程中具有良好的稳定性、溶解性以及一致的释放速率。
在处方研究中,通常需要考虑以下几个方面的因素:1. 剂型选择根据药物的性质和临床需求,选择合适的剂型进行研究。
常见的药物剂型包括片剂、胶囊剂、注射剂、乳剂等。
剂型的选择应综合考虑药物的物化性质、口服吸收特点以及患者的用药便利性等因素。
2. 成分选择和配比合理选择药物的辅料和配比,以确保药物的稳定性和疗效。
在成分选择上,需要考虑药物与辅料之间的相互作用、相溶性等。
在配比上,应根据药物的特性和所需的剂型特点进行合理的比例。
3. 药物的物理和化学性质药物的物理和化学性质对于制剂设计和工艺研究具有重要的影响。
包括药物的溶解性、稳定性、pH值、离子强度等参数的测定和评价。
4. 药物的生物利用度研究药物的生物利用度是指药物在体内的利用率和吸收程度。
通过药物的生物利用度研究,可以评估药物的有效性和剂型的合理性。
常用的研究方法有体外释放试验、动物实验等。
二、工艺研究工艺研究是指在处方确定的基础上,通过一系列加工工艺的研究,制备出符合药物质量和疗效要求的制剂。
工艺研究主要包括以下几个方面:1. 制剂工艺流程设计制剂工艺流程设计是制剂研究中的关键步骤,它包括药物的加工顺序、加工条件、机械设备的选择等。
通过合理的工艺流程设计,可以保证药物的稳定性、纯度以及工艺的可操作性。
2. 制剂工艺参数的确定制剂工艺参数的确定是制剂研究的重要工作,它直接关系到药物的质量和疗效。
包括药物的溶解温度、混合时间、干燥温度等工艺参数的确定和优化。
化学药物制剂处方及工艺的研究引言化学药物制剂是一种药物剂型,是用化学方法或工艺,将药物活性成分以及辅料制成适合人体使用的药物形式。
这些制剂需要经过严格的处方设计和精细的工艺制备,以确保药物的稳定性、安全性和有效性。
本文将探讨化学药物制剂的处方设计及工艺制备的研究。
一、化学药物制剂的处方设计1. 药物活性成分选择在进行化学药物制剂的处方设计时,首先需要选择适合的药物活性成分。
这些成分需要具有明确的药理学作用,并且在制剂中能够保持其稳定性和活性。
也需要考虑到药物的剂量、毒性和副作用等因素,以确保制剂的安全性和有效性。
2. 辅料选择除了药物活性成分外,制剂中还需要使用一些辅料来增强稳定性、改善外观、提高制剂的生物利用度等。
辅料的选择需要考虑到其与药物活性成分的相容性、溶解性、稳定性等因素。
常见的辅料包括填充剂、粘合剂、分散剂、润湿剂、调味剂等。
3. 剂型设计剂型是指药物在制剂中的物理形态,包括固体制剂、液体制剂、半固体制剂等。
在进行处方设计时,需要根据药物的性质和用途,选择适合的剂型。
也需要考虑到患者的用药便利性和服药途径等因素,以提高患者的依从性和疗效。
4. 质量控制在处方设计中,还需要考虑到质量控制的因素。
这包括药物的稳定性、纯度、一致性等。
需要确保药物在制剂中的含量和质量符合规定的标准,以保证制剂的安全性和有效性。
二、化学药物制剂的工艺制备1. 原料的采购与检验在工艺制备中,首先需要进行原料的采购与检验。
这包括药物活性成分和辅料的采购,以及对其进行外观、纯度、溶解度、含量等方面的检验。
只有通过严格的原料检验,才能确保制剂的质量。
2. 工艺流程的设计制剂的工艺流程是制备过程中的关键环节。
在设计工艺流程时,需要考虑到原料的混合、溶解、浸出、干燥、成型、包装等各个环节。
也需要考虑到温度、时间、压力等工艺参数的控制,以确保制剂的质量和稳定性。
3. 设备的选择和维护在工艺制备中,需要选择适合的设备来完成制剂的生产。