白色念珠菌与抑菌效力检查方法
- 格式:ppt
- 大小:91.00 KB
- 文档页数:21

消毒技术规范95页到109页2.7 抗(抑)菌效果鉴定试验2.7.1目的测定抗(抑)菌产品对细菌和真菌的抗(抑)菌作用。
常使用的方法有抑菌环试验、最小抑制浓度测定试验、滞留抑菌效果测定试验、洗衣粉抗菌效果测定试验、振荡烧瓶试验、浸渍试验与帖膜试验,可视情况选用。
2.7.2抑菌环试验2.7.2.1原理利用抑菌剂不断溶解经琼脂扩散形成不同浓度梯度,以显示其抑菌作用。
试验通过抑菌环大小以判断其是否具有抑菌能力。
本试验适用于抑菌剂与溶出性抗(抑)菌产品的抗(抑)菌效果鉴定。
2.7.2.2实验器材(1)实验菌株金黄色葡萄球菌(ATCC 6538)、大肠杆菌(8099或ATCC 11229)、白色念珠菌(ATCC 10231)菌悬液(见2.1.2)及根据抑菌剂特定用途所用的其他菌悬液(2)抑菌剂载体5mm直径圆形新华一号定性滤纸片,经压力蒸汽灭菌处理后,置120c 烤干2h,保存备用(3)活菌培养计数所需器材见2.1.3(4)微量移液器5p L〜50|J L,可调式(5)游标卡尺(6)营养琼脂培养基、胰蛋白胨大豆琼脂培养基与沙堡琼脂培养基2.7.2.3 操作程序(1)抑菌片的制备:对液体抑菌剂,取无菌并干燥的滤纸片。
每片滴加实际使用浓度抑菌剂溶液5p L,然后将滤纸片平放于清洁的无菌平皿内,开盖置恒温培养箱(37℃)中烤干,或置室温下自然干燥后备用。
溶出性抗(抑)菌产品,可直接制成直径为5mm,厚不超过4mm圆片(块),每4片(块)一组。
(2)阴性对照样片的制备:取无菌干燥滤纸片,每片滴加无菌蒸馏水5P L,干燥后备用。
溶出性抗(抑)菌产品的阴性对照样本,应取同种材质不含抑菌成份的样品,制成与试验组大小相同的样片(块)。
(3)试验菌的接种:用无菌棉拭子蘸取浓度为5X105cfu/mL〜5X106cfu/mL试验菌悬液,在适宜的培养基平板表面均匀涂抹3次。
每涂抹1次,平板应转动60°,最后将棉拭子绕平板边缘涂抹一周。


妇科念珠菌感染3种微生物检验方法的效果观察研究妇科念珠菌感染是一种常见的妇科疾病,主要由念珠菌引起。
念珠菌感染对患者的生活质量和健康造成了严重影响,因此及时准确的检测方法对于诊断和治疗至关重要。
目前,常见的检测方法包括培养法、快速孢子囊法和PCR法。
本研究旨在比较这三种检验方法的效果,为临床医生提供更准确、更有效的念珠菌感染检测方法。
一、材料与方法1. 受试者:本研究共招募了100名有念珠菌感染症状的妇科患者作为研究对象。
2. 检测方法:所有患者分别进行培养法、快速孢子囊法和PCR法的检测。
3. 培养法:将患者样本取出擦拭在含有念珠菌培养基的培养皿上,放置于恒温箱中培养24-48小时,观察是否有念珠菌生长。
4. 快速孢子囊法:利用显微镜观察患者样本中孢子囊的形成情况,快速确定是否感染念珠菌。
5. PCR法:提取患者样本DNA,利用PCR技术对念珠菌的特异基因进行扩增,通过电泳观察扩增产物的情况,进而确定是否感染念珠菌。
二、结果1. 培养法的检测结果显示,共有60名患者被检测出感染念珠菌,其中20名患者为真阳性,40名患者为假阴性。
三、讨论根据本研究的结果分析,可以得出以下结论:1. 培养法的准确率最低,有40%的患者被误判为阴性,存在较大的假阴性率,因此在临床中应该谨慎使用。
2. 快速孢子囊法的准确率次之,其准确率为75%,假阴性率较培养法低,但仍然存在一定的误判风险。
3. PCR法的准确率最高,有80%的患者可以被准确检测出感染念珠菌,假阴性率最低,具有较高的可靠性和准确性。
本研究结果表明PCR法是目前检测妇科念珠菌感染最为准确、可靠的方法,可以为临床医生提供更准确、更有效的念珠菌感染检测方法,为患者的诊断和治疗提供更好的帮助。
建议临床医生在进行念珠菌感染检测时优先选择PCR法进行检测,以提高诊断的准确性和可靠性。


抑菌效力检查记录标准化工作室编码[XX968T-XX89628-XJ668-XT689N]
抑菌效力检查记录
检品名称:批号:来源:
规格:检验日期:报告日期:
检验依据:
1、培养基、试剂批号:
胰酪大豆胨琼脂培养基:沙氏葡萄糖琼脂培养基:
0.9%无菌氯化钠溶液:
胰酪大豆胨琼脂培养基:沙氏葡萄糖琼脂培养基:
0.9%无菌氯化钠溶液:
胰酪大豆胨琼脂培养基:沙氏葡萄糖琼脂培养基:
0.9%无菌氯化钠溶液:
2、试验菌批号、有效期:
金黄色葡萄球菌批号:有效期:
铜绿假单胞菌批号:有效期:
大肠埃希菌批号:有效期:
白色念珠菌批号:有效期:
黑曲霉批号:有效期:
3、抑菌效力测定:
3.1、方法:取上述试验菌,制成每1ml含菌数约为108cfu的菌悬液;
实验组:取包装完整的供试品5份,直接接种试验菌;
菌液组:取同体积无菌0.9%无菌氯化钠溶液5份,直接接种试验菌;
测定1ml菌液组菌量(为第0 d含菌数);
置20-25℃避光贮存,于第14天,第28天分别测定每1ml供试品中的含菌数。
(备注:测定细菌用胰酪大豆胨琼脂培养基,测定真菌用沙氏葡萄糖琼脂培养基。
根据存活菌数测定结果,计算1ml供试品各试验菌所加的菌数及各间隔时间的菌数,并换算成lg值。
)
3.2、判断标准:
3.3、试验结果:
检验人/日期:复核人/日期:。

白色念珠菌病的检测方法及抗真菌药物的研究进展摘要:白色念珠菌感染的发生率极高,对人体的危害极大。
及时的检测白色念珠菌,对于患者的治疗十分关键。
白色念珠菌感染的主要治疗方式为药物治疗,主要的药物有:唑类、多烯类、棘白素类、氟胞嘧啶。
但现有的抗真菌药物耐药情况严重,需开发新药物改善现状。
关键字:白色念珠菌;抗真菌药物;检测方法20世纪70年代以来,由于艾滋病大流行和现代医学的一些进步(包括大规模化疗、器官移植、免疫抑制和植入式医疗设备)。
真菌感染大幅度增加,对人类健康造成了很大威胁[1]。
白色念珠菌是一种常见的真菌病原体。
白色念珠菌是一种机会性致病真菌,通常存在于正常人口腔,上呼吸道,肠道及阴道,一般在正常机体中数量少,不引起疾病,当机体免疫功能或一般防御力下降或正常菌群相互制约作用失调,则本菌大量繁殖并改变生长形式(芽生菌丝相)侵入细胞引起疾病[2]。
白色念珠菌病对人体造成不可逆的损害,严重威胁人体健康。
及时的检测到白色念珠菌,在感染早期进行治疗,合理的应用抗真菌药物,积极有效的控制白色念珠菌病。
现将白色念珠菌的检测方法以及抗真菌药物的研究进展展开综述,旨在为临床控制白色念珠菌病提供科学依据。
1.检测方法白色念珠菌病的伤害性大、病死率高。
选择合适的检测方法,及时准确的诊断深部真菌,有效的发出检验报告对临床诊断尤为重要。
白色念珠菌的检测方法有直接镜检、白色念珠菌培养、组织病理学检测、血清学方法、PCR技术、肽核酸荧光原位杂交技术(PNA-FISH)和靶向分子直接检测等[3]。
直接镜检、白色念珠菌鉴定以及组织病理学检测是较为传统的检测方法。
其中白色念珠菌培养鉴定(Vitek-2 Compact型全自动微生物分析仪、基质辅助激光解析电离飞行时间质谱(MS))将培养后的真菌进行检测,可明确病原菌的名称。
是诊断白色念珠菌病的金标准。
但存在培养时间较长这一缺陷,对于临床诊断有一定的影响。
血清学方法主要G试验。
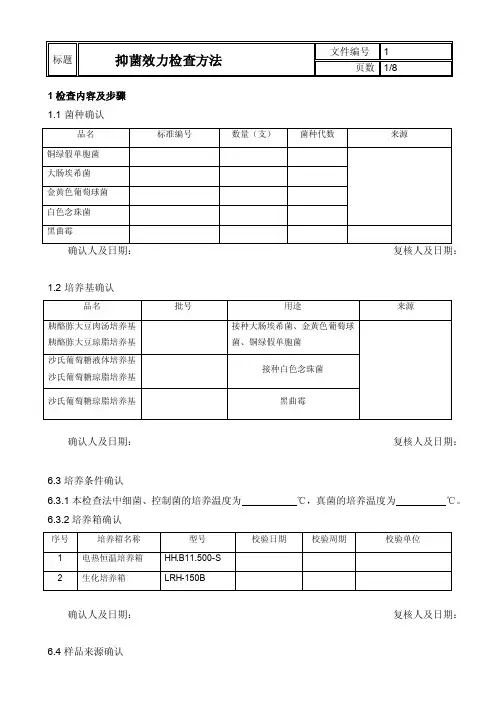
1 检查内容及步骤 1.1 菌种确认1.2 培养基确认确认人及日期:复核人及日期:6.3培养条件确认6.3.1本检查法中细菌、控制菌的培养温度为 ℃,真菌的培养温度为 ℃。
6.3.2培养箱确认确认人及日期: 复核人及日期:6.4样品来源确认确认人及日期:复核人及日期:6.5操作环境确认为的洁净区域以内,局部(操作台)为级并单向流空气。
确认人及日期:复核人及日期:7 培养基的适用性检查7.1抑菌剂效力测定用培养基应进行培养基的适用性检查,包括成品培养基、由脱水培养基或按处方配制的培养基均应检查。
7.2菌种试验所用的菌株传代次数不得超过5代(从菌种保藏中心获得的冷冻干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕大肠埃希菌(Escherichia coli)〔CMCC(B) 44 102〕金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26 003〕白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕黑曲霉(Aspergillus niger)〔CMCC(F) 98 003〕7.3菌液制备7.3.1接种大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的新鲜培养物至胰酪胨大豆肉汤培养基中,30~35℃培养18~24小时;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中,20~25℃培养24~48小时。
上述培养物用0.9%无菌氯化钠溶液制成每1ml含菌数为50~100cfu的菌悬液。
接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基中,20~25℃培养5~7天,加入3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱。
然后,采用适宜方法吸出孢子悬液至无菌氯化钠溶液制成每1ml含孢子数50~100cfu的孢子悬液。


抑菌剂效力检查法指导原则抑菌剂效力检查法系用于测定灭菌、非灭菌制剂中抑菌剂的活性,以评价最终产品的抑菌效力,同时也可用于指导生产企业在制剂研发阶段抑菌剂的确定。
如果药物本身不具有充分的抗菌活性,那么应根据制剂特性(如水溶液制剂)添加适宜的抑菌剂,以防止制剂在正常贮藏和使用过程中可能发生的微生物污染和繁殖,尤其是多剂量包装的制剂,避免因药物微生物污染及变质而对患者造成伤害。
在药品生产过程中,抑菌剂不能用于替代药品生产的GMP管理,不能作为非灭菌制剂降低微生物污染的唯一途径,也不能作为控制多剂量包装制剂灭菌前的生物负载的手段。
所有抑菌剂都具有一定的毒性,制剂中抑菌剂的量应为最低有效量。
同时,为保证用药安全,最终包装容器中的抑菌剂有效浓度应低于对人体有害的浓度。
要求具有抗菌活性的制剂(参见制剂通则),不管是添加的抑菌剂,还是药物本身具有抗菌活性,在药物研发阶段,均应确认其抗菌效力。
抑菌剂的抗菌效力在贮存过程中有可能因药物的成分或包装容器等因素影响而提高或降低,因此,应验证最终容器中的抑菌剂效力在效期内不因贮藏条件而降低。
本试验方法和抑菌剂抑菌效力判断标准用于包装未启开的成品制剂。
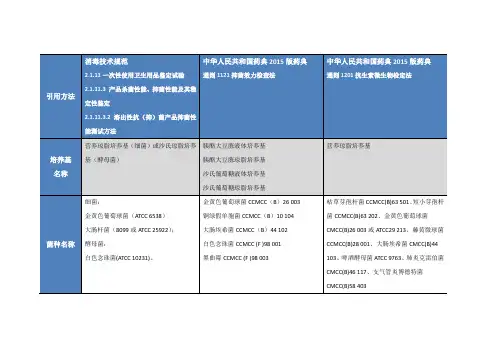
产品分类需要进行本试验的药品分为四类(见表1),以便标准的制定和执行。
表1 产品分类类别 药品1 类 注射剂、其他非肠道制剂,包括乳剂、耳用制剂、无菌鼻用制剂及眼用制剂2 类 局部给药制剂、非灭菌鼻用制剂及用于黏膜的乳剂3 类 口服制剂(非抗酸制剂)4 类 抗酸制剂培养基培养基的制备1.胰酪胨大豆肉汤培养基酪蛋白胨 17.0g 磷酸二氢钾 2.5g大豆木瓜蛋白酶消化物 3.0 g 氯化钠 5.0g葡萄糖 2.5g 水 1000ml 除葡萄糖外,取上述成分混合,微温溶解,调pH约7.0,煮沸,加入葡萄糖溶解后,摇匀,滤清,调节pH使灭菌后为7.3±0.2,分装,灭菌。
2. 胰酪胨大豆琼脂培养基除上述胰酪胨大豆肉汤培养基的处方和制法,加入14.0g琼脂,调pH使灭菌后为7.3±0.2,分装,灭菌。
准备将试验菌24h斜面培养物用PBS洗下,制成菌悬液(要求的浓度为:用100μl滴于对照样片上或5ml样液内,回收菌数为1×104 cfu/片或ml~9×104cfu/片或ml)。
取被试样片(2.0cm×3.0cm)或样液(5ml)和对照样片或样液(与样片同质材料,同等大小,但不含抗菌材料,且经灭菌处理)各4片(置于灭菌平皿内)或4管。
铜绿假单胞菌、金黄色葡萄球菌、大肠埃希菌、白色念珠菌若为琼脂培养物,加入适量的0.9%无菌氣化钠溶液将琼脂表面的培养物洗脱,并将菌悬液移至无菌试管内,用0.9%无菌氣化钠溶液稀释并制成每1ml含菌数约为108cfu的菌悬液;若为液体培养物,离心收集菌体,用0.9%无菌氯化钠溶液稀释并、制成每1ml含菌数约为108cfu的菌悬液。
取黑曲霉的新鲜培养物加人3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,然后,用适宜方法吸出孢子悬液至无菌试管内,加入适量的含0.05%(ml/ml)聚山梨酯80的0.9%无菌氣化钠溶液制成每1ml含孢子数108cfu的孢子悬液。
测定1ml菌悬液中所含的菌数。
菌液制备后若在室温下放置,应在2 小时1、标准品溶液的制备标准品的使用和保存,应照标准品说明书的规定。
临用时照表 1(见附件1)的规定进行稀释。
标准品的品种、分子式及理论计算值见表2(见附件2)。
2、供试品溶液的制备精密称(或量)取供试品适童,用各品种项下规定的溶剂溶解后,再按估计效价或标示量照表1(见附件1)的规定稀释至与标准品相当的浓度。
3、双碟的制备取直径约90mm,高16〜17mm的平底双碟,分别注入加热融化的培养基(表1)20ml,使在碟底内均匀摊布,放置水平台面上使凝固,作为底层。
另取培养基适量加热融化后,放冷至48~50℃(芽孢可至60℃),加入规定的试验菌悬液适量(能得清晰的抑菌圈为度)。
二剂量法标准品溶液的高浓度所致的抑菌圈直径在18~22mm,三剂量法标准品溶液的中心浓度所,产品有抑菌作用,附件1:附件2:标准品品种标准品分子式或品名理论计算值u/mg标准品品种标准品分子式或品名理论计算值u/mg链霉素(C21 H39N7 O 12)2 * 3H2SO4798. 3红霉素C37 H67 NO131000卡那霉素C18H36N4O11 * H2SO4831.6氯霉素C11H12C12N2 O 51000阿米卡星C22H43N5O13·nH2S04 (n=l. 8 或2) 杆菌肽杆菌肽锌核糖霉素C17H34N4O10·nH2SO4 (n<2)黏菌素硫酸黏菌素新霉素硫酸新霉素去甲万古霉素C65H73Cl2N9 O 24• HC1975. 2庆大霉素硫酸庆大霉素卷曲霉素硫酸卷曲霉素磺苄西林C16H16N2Na207S904.0两性霉素B C47 H73NO171000四环素C22H24N208• HC11000巴龙霉素C23H45N5O14 ·n H2SO4土霉素C22H24N2O9 • 2H2 O927奈替米星(C21H41N5O7)2• 5 H2SO4660. 1西索米星(C19H37N507)2• 5H2S04646. 3阿奇霉素C38 H72N2O121000磷霉素C3H5Ca04P • H20711. 5妥布霉素C18 H37N5O91000乙酰螺旋霉素乙酰嫌旋霉素罗红霉素C41H76 N2O151000克拉霉素C38 H69 NO131000吉他霉素吉他霉素大观霉素C14H24N2 O 7• 2HC1 • 5H20670. 9麦白霉素麦白霉素小诺霉素C20H41N5O7 • 5/2H2S O 4654. 3交沙霉素C42 H69NO151000多黏菌素B硫酸多黏菌素B丙酸交沙霉素C45 H73NO16937金霉素C22H23ClN2 O 8 • HC11000替考拉宁C72〜89 H68〜99Cl2N8〜9 O 28〜331000。
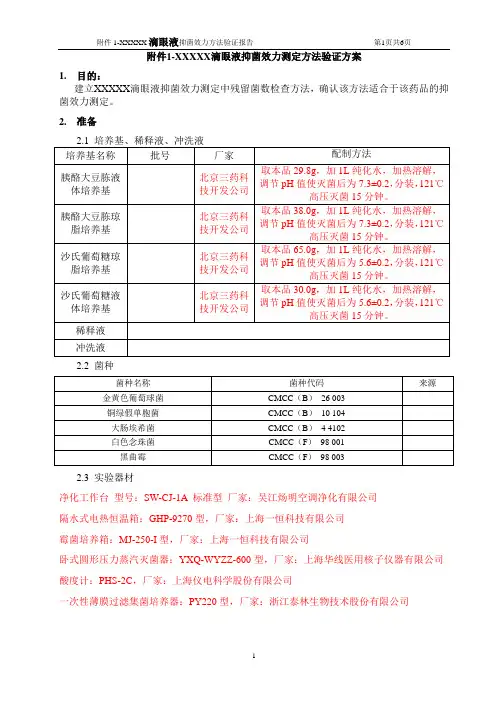
附件1-XXXXX滴眼液抑菌效力测定方法验证方案1.目的:建立XXXXX滴眼液抑菌效力测定中残留菌数检查方法,确认该方法适合于该药品的抑菌效力测定。
2.准备2.2 菌种2.3 实验器材净化工作台型号:SW-CJ-1A 标准型厂家:吴江炀明空调净化有限公司隔水式电热恒温箱:GHP-9270型,厂家:上海一恒科技有限公司霉菌培养箱:MJ-250-I型,厂家:上海一恒科技有限公司卧式圆形压力蒸汽灭菌器:YXQ-WYZZ-600型,厂家:上海华线医用核子仪器有限公司酸度计:PHS-2C,厂家:上海仪电科学股份有限公司一次性薄膜过滤集菌培养器:PY220型,厂家:浙江泰林生物技术股份有限公司3.菌液制备:接种新鲜的金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌的培养物至胰酪大豆胨液体培养基中,经30℃~35℃培养18~24h,用0.9%无菌氯化钠溶液制成适宜浓度的菌悬液(培养基适用性以及计数方法验证用菌液浓度为小于100cfu/ml;抑菌效力检查试验用菌液约为108cfu/ml)。
取新鲜的白色念珠菌的培养物至沙氏葡萄糖液体培养基中,经20℃~25℃培养24~48小时,用0.9%无菌氯化钠溶液制成适宜浓度的菌悬液(培养基适用性以及计数方法验证用菌液浓度为小于100cfu/ml;抑菌效力检查试验用菌液约为108cfu/ml)。
取新鲜的黑曲霉培养物接种至沙氏葡萄糖琼脂斜面培养基,经20℃~25℃培养5~7天,或直到获得丰富的孢子。
加入3~5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱。
然后吸出孢子悬液(用管口带有薄的无菌棉花或纱布能过滤菌丝的无菌毛细吸管)至无菌试管内,用含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液制成适宜浓度的黑曲霉孢子悬液(培养基适用性以及计数方法验证用菌液浓度为小于100cfu/ml;抑菌效力检查试验用菌液约为108cfu/ml)。
菌液制备后若在室温下放置,应在2 小时内使用;若保存在2〜8 ℃,可在24小时内使用。
妇科念珠菌感染3种微生物检验方法的效果观察研究
妇科念珠菌感染是一种常见的妇科疾病,其主要症状包括白带增多、瘙痒、灼痛等。
念珠菌是引起该疾病的主要致病微生物之一,及时准确地检测出念珠菌感染对于临床治疗
非常重要。
研究对象为来就诊的50例妇科念珠菌感染患者,在选择治疗前,采用三种不同的微生物检验方法,分别是湿片镜检、培养法和PCR法。
湿片镜检是一种直接观察细胞和病原体
的方法,培养法通过将样本培养在不同的培养基上,观察细菌或真菌的生长情况,PCR法
则是一种分子生物学技术,通过扩增特定基因的方法来检测病原体的存在。
结果显示,三种方法在妇科念珠菌感染的检测中均有较高的准确率。
湿片镜检方法的
准确率为82%,培养法为88%,PCR法为94%。
三种方法在念珠菌感染的检测时间上也存在
差异。
湿片镜检最为简便快速,仅需几分钟即可获得结果;培养法需要较长的培养时间,
通常需要48至72小时;PCR法虽然准确率较高,但其所需设备和操作条件较为复杂,且较为耗时。
三种不同的微生物检验方法均可用于妇科念珠菌感染的检测,但每种方法都有其特点
和适用范围。
对于需要快速获得结果的临床场景,湿片镜检是一种较为理想的选择;而对
于需要准确度较高的检测结果,PCR法则是一种更为可靠的方法。
培养法虽然准确率较高,但其所需时间较长,一般适用于一些特殊情况或研究需求。
本研究存在一些限制,样本量较小,且研究对象为同一地区的患者,可能存在地域性
差异。
在进一步的研究中,可以增加样本量,并在不同地区进行多中心的研究,以进一步
验证本研究的结论。
妇科念珠菌感染3种微生物检验方法的效果观察研究妇科念珠菌感染是一种常见的妇科疾病,常见于生育年龄的女性。
念珠菌感染会给患者带来不适和痛苦,严重影响生活质量。
目前,念珠菌感染的诊断主要依靠微生物检验方法,但不同的检验方法在效果上可能存在差异。
为了探究不同的微生物检验方法对妇科念珠菌感染的诊断效果,我们开展了一项观察研究。
一、传统的培养法传统的培养法是目前常用的念珠菌感染检验方法之一。
该方法通过将患者采集的分泌物样本进行培养,观察培养皿中是否有念珠菌的生长来判断念珠菌感染的情况。
传统培养法的优点是简单易行,成本较低,但缺点是需要较长时间才能获取结果,且对念珠菌的特异性不高。
二、快速菌种鉴定法快速菌种鉴定法是近年来新兴的微生物检验方法,该方法利用生物分子技术对患者分泌物中的微生物进行快速鉴定。
通过PCR扩增和DNA序列比对等技术,可以快速、准确地确定分泌物中的念珠菌是否存在。
该方法的优点是快速、准确,能够对念珠菌进行特异性鉴定,但缺点是设备和技术要求较高,成本较高。
三、显微镜检查法为了比较不同的微生物检验方法对妇科念珠菌感染的诊断效果,我们招募了100例妇科念珠菌感染患者进行观察研究。
50例患者采用传统的培养法进行检验,25例患者采用快速菌种鉴定法进行检验,25例患者采用显微镜检查法进行检验。
观察研究的主要内容包括检验结果的准确性、阳性率、阴性率、检测时间和成本等指标。
经过观察研究,我们发现不同的微生物检验方法对妇科念珠菌感染的诊断效果存在一定差异。
传统的培养法虽然操作简单,成本低,但在念珠菌的特异性鉴定上存在一定的局限性,有一定的假阴性率。
快速菌种鉴定法虽然能够快速、准确地对念珠菌进行特异性鉴定,但设备和技术要求较高,成本较高。
显微镜检查法操作简单,成本低,但对念珠菌的特异性鉴定也存在一定的局限性。
综合观察研究结果,我们认为在妇科念珠菌感染的微生物检验中,应当综合考虑不同的检验方法。
传统的培养法可以作为常规检验方法,用于快速筛查和初步诊断;而快速菌种鉴定法可以作为辅助检验方法,用于对念珠菌的特异性鉴定;显微镜检查法可以作为常规检验方法的补充,用于快速获取初步结果。
四种检验方法检验阴道念珠菌病的效果比较目的:分析比较四种检验方法检验阴道念珠菌病的效果。
方法:选取在笔者所在医院妇产科就诊的阴道炎患者130例,通过棉拭子法收集患者的阴道分泌物作为检验样本。
分别应用手工法、凝集法、显色法以及妇科白带涂片多项检查快速染色技术(CTB染色法)进行检验,并比较四种检验方法的检验结果。
结果:CTB染色法的阳性率明显高于其他3种检验方法,差异有统计学意义(P<0.05)。
结论:CTB染色技术具有操作简便、细菌的检出率高等优点,可以为临床诊断阴道念珠菌病提供可靠的诊断依据,值得在临床上进一步推广应用。
标签:阴道念珠菌病;CTB染色法;凝集法阴道念珠菌病是妇产科的常见病。
流行病学研究表明,大约有75%的育龄期的妇女曾经患过阴道念珠菌病[1]。
由于部分妇女的卫生意识差,患病后未能彻底治疗以及目前临床广谱抗生素的滥用,导致阴道念珠菌病的发病率居高不下。
严重影响广大妇女的身心健康和生活质量。
及时准确的诊断阴道念珠菌病对于该病是否能够得到及时有效的治疗起到十分重要的作用。
有报道CTB染色法(妇科白带涂片多项检查快速染色技术)能够较为快速报告结果,念珠菌的检出率较高,且该方法较为简便实用[2]。
笔者通过应用四种检验方法对阴道念珠菌病进行检验,并比较四种检验方法的检验效果,现报道如下。
1资料与方法1.1一般资料选取2010年10月-2011年5月在笔者所在医院妇产科就诊的阴道炎患者130例,年龄16~49岁,平均(31.25±2.59)岁。
采用棉拭子法收集上述患者的阴道分泌物作为样本。
标准菌株分别是:光滑念珠菌(ATCC66032)、白色念珠菌(ATCC62376)、热带念珠菌(ATCC66029)、近平滑念珠菌(ATCC22019)。
1.2检验方法所收集的阴道分泌物样本分别采用手工法、凝集法、显色法以及CTB染色法进行检验。
1.2.1手工法对沙堡基上生长出来的菌落进行涂片,经革兰氏染色后,确定为酵母样细菌。
真菌抑菌实验报告1. 研究目的本实验旨在研究不同抑菌剂对真菌生长的影响,并评估其抑菌效果,为寻找有效的真菌抑制剂提供实验依据。
2. 实验设计2.1 材料准备- 真菌菌株:选取常见的白色念珠菌作为研究对象。
- 抑菌剂:分别选取甲酚、抗生素A和氨酚苄青霉的水溶液作为实验组的抑菌剂。
- 导管培养基:用于培养菌株的基础培养基。
- 培养皿、试管、移液器等实验器材。
2.2 实验步骤1. 将培养基倒入培养皿中,使其均匀地分布在培养皿底部。
2. 在培养皿中分别加入甲酚、抗生素A和氨酚苄青霉的水溶液,制成实验组培养皿。
3. 将白色念珠菌涂抹在各个培养皿的表面上,每个培养皿涂抹的菌量相同。
4. 将培养皿密封,放置在恒温培养箱中,设置适宜的温度和湿度。
5. 在指定的时间点上观察真菌的生长情况,并记录相关数据。
3. 实验结果3.1 观察指标- 真菌菌落直径:用尺子或显微镜目镜测量真菌菌落的直径,记录在实验记录表中。
- 菌落形态:观察真菌菌落的形状、颜色等特征,并记录在实验记录表中。
3.2 结果分析根据实验数据统计和观察,观察到不同抑菌剂对真菌生长的影响如下:1. 甲酚:甲酚对真菌菌落的生长有较强的抑制作用,菌落直径较小,呈现出不规则形状。
2. 抗生素A:抗生素A对真菌菌落的生长有一定的抑制作用,菌落直径相对较小,呈现出较规则的形状。
3. 氨酚苄青霉:氨酚苄青霉对真菌菌落的生长几乎没有抑制作用,菌落直径与对照组无明显差异,呈现出较规则的形状。
4. 结论根据实验结果分析,不同抑菌剂对真菌生长有不同的抑制效果。
其中,甲酚对真菌有较强的抑制作用,抗生素A有一定的抑制作用,而氨酚苄青霉几乎对真菌生长没有影响。
因此,甲酚和抗生素A可作为潜在的真菌抑制剂,有望在实际应用中发挥抑菌作用。
5. 实验改进建议为了进一步完善实验结果和提高实验的可靠性,以下是一些建议:1. 增加重复实验:为了提高统计结果的可靠性,可以增加实验的重复次数,重复实验的结果进行平均值统计,减小实验误差。