热力学方程模型
- 格式:doc
- 大小:220.34 KB
- 文档页数:7
应用WILSON NRTL UNIQUAC模型计算乙醇-水体系汽液平衡摘要:利用已知的乙醇-水混合体系在常压下的汽液相平衡数据。
选用Aspen plus 模拟软件系统自带的活度系数数学模型关联相平衡数据,并和实验测定值相比较。
关键词:汽液相平衡, Aspen plus流体相平衡数据是化工过程中重要的基础数据,在热力学方面,新的热力学模型的开发,各种热力学模型的比较筛选。
特别是在分析和解决传质分离设备的设计、操作、控制过程中,开发新的传质分离过程,往往离不开平衡数据的测定,关联和推算【1】。
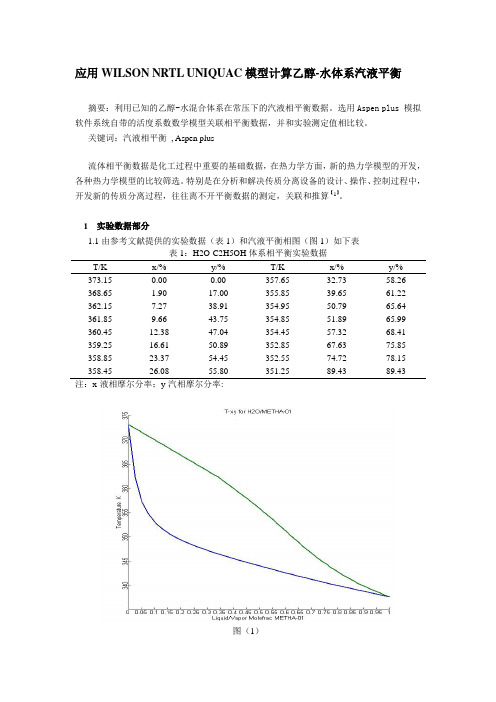
1 实验数据部分1.1由参考文献提供的实验数据(表1)和汽液平衡相图(图1)如下表表1:H2O-C2H5OH体系相平衡实验数据T/K x/% y/% T/K x/% y/% 373.15 0.00 0.00 357.65 32.73 58.26 368.65 1.90 17.00 355.85 39.65 61.22 362.15 7.27 38.91 354.95 50.79 65.64 361.85 9.66 43.75 354.85 51.89 65.99 360.45 12.38 47.04 354.45 57.32 68.41 359.25 16.61 50.89 352.85 67.63 75.85 358.85 23.37 54.45 352.55 74.72 78.15 358.45 26.08 55.80 351.25 89.43 89.43注:x-液相摩尔分率;y-汽相摩尔分率:图(1)2 计算原理2.1汽液相平衡的计算在热力学汽液相平衡的计算中,对于真实体系,采用逸度来表示汽液相平衡,即:Li Vf f =i(1)通常的计算方法有活度系数法和状态方程法2种,UNIQUAC 、WILSON 、NRTL 的相平衡计算称为活度系数法,是将液相组分i 的逸度与混合溶液中组分i 的活度系数建立联系。

写出四个热力学基本方程
1.热力学的四个基本公式:dU=TdS-PdV;dH=TdS+VdP;
dF=-SdT-PdV;dG=-SdT+VdP。
热力学是从宏观角度研究物质的热运动性质及其规律的学科。
属于物理学的分支,它与统计物理学分别构成了热学理论的宏观和微观两个方面。
热力学定律,是描述物理学中热学规律的定律,包括热力学第零定律、热力学第一定律、热力学第二定律和热力学第三定律。
其中热力学第零定律又称为热平衡定律,这是因为热力学第一、第二定律发现后才认识到这一规律的重要性;热力学第一定律是能量守恒与转换定律在热现象中的应用;热力学第二定律有多种表述,也叫熵增加原理。
热力学第一定律也就是能量守恒定律。
自从焦耳以无以辩驳的精确实验结果证明机械能、电能、内能之间的转化满足守恒关系之后,人们就认为能量守恒定律是自然界的一个普遍的基本规律。
热力学第二定律的每一种表述,都揭示了大量分子参与的宏观过程的方向性,使人们认识到自然界中进行的涉及热现象的宏观过程都具有方向性。
2.热力学第二定律的英文解释是熵是趋向于总体增大,比如
1L90度水(A)和1L10度水(B)融合,不会是A的温度增加而 B的温度减小,因为如此的话,总体的熵减小。
如果A 温度降但B温度升高一点,其总体的熵增加。
热力学第三
定律通常表述为绝对零度时,所有纯物质的完美晶体的熵值为零。
或者绝对零度(T=0K即-273.15℃)不可达到。
R.H.否勒和 E.A.古根海姆还提出热力学第三定律的另一种表述形式:任何系统都不能通过有限的步骤使自身温度降低到0K,称为0K不能达到原理。


热力学气体状态方程热力学气体状态方程是描述气体状态的重要公式,通过该方程可以揭示气体在不同条件下的行为和性质。
本文将介绍热力学气体状态方程的基本原理和常见表达式,以及其在实际应用中的重要性。
一、热力学气体状态方程的基本原理热力学气体状态方程是基于气体分子间相互作用力和分子动理论的基础上建立起来的。
根据分子动力学理论,气体分子之间的相互作用力可以忽略不计,只考虑分子热运动对气体的整体性质的影响。
根据热力学气体状态方程的基本原理,可以得到如下形式的方程:PV = nRT其中,P是气体的压强,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的温度。
该方程即为理想气体状态方程,适用于低密度、高温下的气体,是研究气体性质和气体行为的基本工具。
二、常见的除了理想气体状态方程外,实际气体的状态方程还包括范德瓦尔斯方程、爱因斯坦的相对论气体方程等。
这些方程根据不同的物理模型和条件,对气体的性质进行修正和推广。
1. 范德瓦尔斯方程范德瓦尔斯方程是对理想气体状态方程的修正,在高密度和低温下更为准确。
该方程考虑了分子之间的吸引力和排斥力,形式如下:(P + an^2/V^2)(V - nb) = nRT其中,a和b分别为范德瓦尔斯常数,与气体的性质相关。
2. 爱因斯坦的相对论气体方程爱因斯坦的相对论气体方程是适用于极高温下的气体,考虑了相对论效应的影响。
该方程形式如下:V = (1 - (u/c)^2)V0其中,u是气体的运动速度,c是光速,V0是气体相对论体积。
三、热力学气体状态方程的应用热力学气体状态方程在科学研究和工程应用中有着广泛的应用。
1. 研究气体性质通过热力学气体状态方程,可以研究气体的压强、体积和温度之间的关系,揭示气体行为和性质。
例如,可以计算气体的密度、摩尔质量等重要参数,为科学研究提供理论基础。
2. 工业过程中的气体计算在各类工业过程中,热力学气体状态方程可以用于计算气体的体积、温度和压强。


吸附动力学和热力学各模型公式及特点1. Langmuir模型:Langmuir模型是最常用的吸附动力学方程之一,它假设吸附物分子只能以单层方式吸附在吸附剂表面。
该模型的方程表示为:dθ/dt = k_ads * (θ_max - θ) * P其中,dθ/dt表示单位时间内吸附量的增加速率,θ表示已吸附的物质分数,θ_max是最大吸附容量,P是气体或溶液中的吸附物质分压或浓度,k_ads是吸附速率常数。
2. Freundlich模型:Freundlich模型是一个经验模型,适用于多层吸附过程。
该模型的方程表示为:q=k_f*C^(1/n)其中,q表示单位质量的吸附物质的吸附量,C是气体或溶液中的吸附物质浓度,k_f和n是实验参数。
3. Temkin模型:Temkin模型假设吸附位点之间存在相互作用,并且随着吸附量的增加,吸附能力会降低。
该模型的方程表示为:q = K * ln(A * P)其中,q表示单位质量的吸附物质的吸附量,P是吸附物质的分压或浓度,K和A是实验参数。
- Langmuir模型适用于单层吸附过程,Freundlich模型适用于多层吸附过程,而Temkin模型考虑了吸附位点之间的相互作用。
- Langmuir模型假设吸附过程是可逆的,而Freundlich模型和Temkin模型则没有这个假设。
-吸附动力学模型通常基于实验数据拟合得出,因此需要大量的实验数据支持。
-吸附动力学模型常用于工业催化剂和废水处理等领域,用于优化吸附过程和预测吸附性能。
吸附热力学模型:1. Gibbs吸附等温方程:Gibbs吸附等温方程描述了吸附过程中的吸附热效应,即吸附热与吸附度的关系。
方程表示为:ΔG = -RTlnK = -ΔH + TΔS其中,ΔG是自由能变化,ΔH是焓变化,T是温度,R是气体常数,K是吸附平衡常数,ΔS是熵变化。
2. Dubinin-Radushkevich方程:Dubinin-Radushkevich方程适用于描述吸附剂对非特异性吸附的情况。
化学反应热力学的计算模型化学反应热力学是研究化学反应过程中所释放或吸收的热量的学科,它在环境保护、化工工艺设计等领域发挥着重要的作用。
在化学反应热力学计算中,热力学模型是至关重要的一个环节,它可以用来预测反应物的转化情况以及反应所释放或吸收的热量。
目前,已经有多种热力学模型被提出和广泛应用。
下面,我们将介绍一些常见的化学反应热力学计算模型。
1. Arrhenius方程Arrhenius方程式是描述反应速率与温度关系的经典方程式。
它可以用来预测在不同温度下反应速率的变化情况。
Arrhenius方程式的数学表达式为:k = A*e^(-Ea/RT)其中,k表示反应速率常数,A代表所谓的频率因子,Ea表示反应的活化能,R为气体常数,T为反应温度。
Arrhenius方程式的应用范围比较广泛,但它有一个局限性,即认为反应活化能始终保持不变。
这个假设在实际应用中并不总是成立。
2. Benson添加法Benson添加法是一种基于基团贡献的计算方法,它可以用来预测化学反应的热力学性质。
该方法将反应的热力学性质(例如焓、熵、自由能等)分解成各个基团贡献的代数和,然后通过叠加的方式得到反应的整体热力学性质。
该方法能够较好地预测高温下的反应热力学性质,但在低温下的应用效果较差。
3. NASA多项式模型NASA多项式模型是一种经验公式,它可以用来计算化学反应在一定温度范围内的热力学性质。
该模型是由美国宇航局(NASA)开发的,因此得名。
NASA多项式模型利用多项式函数来拟合实验数据,其中每一项对应着不同化学反应的热力学性质(例如焓、熵、自由能等)。
该模型的精度相对较高,但是其模型形式较为复杂,需要大量的实验数据作为基础。
4. UNIFAC方法UNIFAC方法是一种基于统计力学原理的计算方法,它可以用来预测复杂混合物的相行为。
该方法将化学物质中不同基团的物理化学性质作为输入参数,通过一定的组合形式得到相应的物理化学性质(例如熵、焓等)。
应用WILSON NRTL UNIQUAC模型计算乙醇-水体系汽液平衡摘要:利用已知的乙醇-水混合体系在常压下的汽液相平衡数据。
选用Aspen plus 模拟软件系统自带的活度系数数学模型关联相平衡数据,并和实验测定值相比较。
关键词:汽液相平衡, Aspen plus流体相平衡数据是化工过程中重要的基础数据,在热力学方面,新的热力学模型的开发,各种热力学模型的比较筛选。
特别是在分析和解决传质分离设备的设计、操作、控制过程中,开发新的传质分离过程,往往离不开平衡数据的测定,关联和推算【1】。
1 实验数据部分1.1由参考文献提供的实验数据(表1)和汽液平衡相图(图1)如下表表1:H2O-C2H5OH体系相平衡实验数据T/K x/% y/% T/K x/% y/% 373.15 0.00 0.00 357.65 32.73 58.26 368.65 1.90 17.00 355.85 39.65 61.22 362.15 7.27 38.91 354.95 50.79 65.64 361.85 9.66 43.75 354.85 51.89 65.99 360.45 12.38 47.04 354.45 57.32 68.41 359.25 16.61 50.89 352.85 67.63 75.85 358.85 23.37 54.45 352.55 74.72 78.15 358.45 26.08 55.80 351.25 89.43 89.43注:x-液相摩尔分率;y-汽相摩尔分率:图(1)2 计算原理2.1汽液相平衡的计算在热力学汽液相平衡的计算中,对于真实体系,采用逸度来表示汽液相平衡,即:Li Vf f =i(1)通常的计算方法有活度系数法和状态方程法2种,UNIQUAC 、WILSON 、NRTL 的相平衡计算称为活度系数法,是将液相组分i 的逸度与混合溶液中组分i 的活度系数建立联系。
换而言之,就是在处理真实溶液时修正理想溶液的浓度【3】。
因此,对于液相:=^l i f 0i i i f x γ(2)其中,i γ为组分i 的活度系数,0i f 为标准态逸度,取Lewis-Randall 定为基准的标准状态,则:dp RTV p f f sip lis is ili i ∫==expφ(3)对于气相:v i f ^vi i py ^φ=(4)式中,vi ^φ为汽相混合物中组分i 在体系温度T 和压力P 下得逸度系数,综上可知得到活度系数法汽液相平衡计算的公式:),.....2,1(,expφφ∫^N i dp RT V p py sip lis is i vi i ==(5)式中,li V 为纯组分i 在体系温度T 时液相的摩尔体积,si p 为为 纯组分i 在体系温度T 时的饱和蒸汽压,衬为纯组分siφ在体系温度与其饱和蒸汽压sip 时的逸度系数。
在中、低压范围内,压力的变化对0i f 和i γ的影响可以忽略,即可以假设:dpRT V sip li∫exp=1(6)则(5)式可以简化为:i s isi vi i x p py i ^φφγ=(7)应用活度系数法汽液相平衡关系式计算时,先选定适用于体系气相的状态方程,导出i ^ln φ表达式,算得气相组分逸度系数vi ^φ,然后选定适用于体系的液相活度系数关联式来计算活度系数下i γ。
s i p 仅是温度的函数,由Antoine 方程即可算出。
s i φln 衬也只是温度的函数,采用与气相相同的状态方程导出s i φln )。
活度系数采用基团贡献法,气相通常使用RK-Soave 状态方程计算【2】。
2.2WILSON 计算常压二元体系汽液平衡。
由文献查得乙醇和水的ANTOINE 常数见表2,采用Antoine 法计算纯液体在相关温度下的饱和蒸汽下p s即:CT B A p s+=-ln (8)表2:安托因常数【4】安托因常数 A B C 乙醇 18.9119 3803.98 -41.68 水18.30363816.44-46.13对于二元溶液用WILSON 过量函数,Wilson 根据无热溶液理论推导出了活度系数和组成间的关系。
对于无热溶液,弗洛里-哈金斯曾提出过如下的过量自由焓模型【5】∑φlniii i Ex x RTG=(9)式中i φ代表组分i 的体积分数,用下式表示∑=iL ii Lii i Vx V x φ(10)与弗洛里-哈金斯方程中的体积分数相似,威尔逊经验滴定义了局部体积分数21ξξ和)-exp(x )-exp(x )-exp(x 1111122211111RTg V RTg V RTg V LLL+=ξ(11) )-exp(x )-exp(x )-exp(x ξ1211222222222RTg V RTg VRTg V LL L+=(12) 将,得和)中的带入(和21219φφξξ222111lnlnx x x x RTGEξξ+=)]--exp(ln[-)]--exp(ln[-222121122211212211RTg g V V x x x RTg g V V x x x LL LL ++=(13)对给定的二元系,在一定的温度和压力下,22111221g g g V V L L 、、、、均为定值。
为简化计,令)RT--exp(Λ)RT--exp(2221212111121212g g V V g g V V LL L L ==Λ(14)式中,),得将此两参数带入(称为威尔逊方程参数。
、13ΛΛ2112)Λln(-)ln(-1212221211x x x x x x RTGE+Λ+=(14)由此得到)ΛΛ-ΛΛ()Λln(-γln )ΛΛ-Λ()ln(-ln 212212121221212122121121212112221211x x x x x x x x x x x x x x ++++=++Λ+Λ+=γ(15)其中WILSON 方程参数如表3所示。
表3:WILSON 模型参数:组分 乙醇(i ) 水(j ) 乙醇(i ) 1.0000 0.8995 水 (j )0.14411.00002.3由UNIQUAC 模型计算二元体系汽液相平衡【6】。
基团贡献法模型UNIFAC 是由局部组成概念方程UNIQUAC 发展而来,用于估算未知体系的活度系数。
UNIFAC 模型将活度系数分为组合活度系数与剩余活度系数两部分,即Ri ci i γγγln ln ln +=(16))θφlnφ-1(5ln -1ln ii ii i i i ci q +++=θφφγ(17)])ψ(-)ln(-1[ln ∑∑∑=Γmnkmnkmm mk mm k k Q θψθψθ(18)其中:k ki k i R v ∑=)(γk ki k i Q v q ∑)(=∑=nnnm m m X QXQ θ∑=nnnmm m XQXQ x)/-exp(T a nm nm =ψ∑=jiiix rr 4/34/3'φ23,2,1,T a a a a nm nm nm mn ++=上述各式中:下表i 表示组分;下表k 表示基团;)(i k v 表示在一分子i 组分中k 基团的个数;R k 、Q k 分别为官能团体积参数和面积参数,a n m 为基团相互作用参数,表(4)。
表(4):H 2O-C 2H 5OH 的纯物质参数【7】【8】:组分 R k Q k 水0.92 1.40 乙醇2.110.012.4应用NRTL 模型计算汽液体相平衡∑∑∑=N kkkiN i jji jiN Ex Gx G RTGτiix -(19)∑∑∑∑+=N jNkkjijj N kkNjjji jii x GG x x Gx G kk iln ττ(∑∑N kkkjNjkjkj kij x GG xττ-)(20)其中:RT g g ji ij ij /)-(=τ ;RT g gij jiji/)-(=τ)-exp(ij ij ij G τα= ; )τα-exp(ji ji jiG=表(5):H2O(1)-C2H5OH(2) NRTL二元参数【9】体系△g12 △g21 a12H2O(1)-C2H5OH(2) -2918.642+4.085T 3409.355+8.400T 0.1803注:Δg ij= g ij- g ji , j/mol-1 ;T/K3 乙醇-水体系的模拟值与实验值比较如下表温度实验值NRTL UNIQUAC WILSONT/K x/% y/% x/% y/% x/% y/% x/%373.15 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 368.65 1.90 17.00 1.85 17.40 18.50 17.35 18.50 17.75 362.15 7.27 38.91 6.6137.80 6.6137.57 6.6137.43 361.85 9.66 43.75 6.9138.55 6.9138.32 6.9138.15 360.45 12.38 47.04 8.8142.578.8142.308.8142.00 359.25 16.61 50.89 11.0146.0411.0145.7311.0145.37 358.85 23.37 54.45 11.8147.0811.8146.7611.8146.39 358.45 26.08 55.80 12.8148.2512.8147.9112.8147.55 357.65 32.73 58.26 15.0250.4115.0250.0515.0249.73 355.85 39.65 61.22 23.0255.5623.0255.1823.0255.23 354.95 50.79 65.64 29.8358.4329.8358.1129.8358.51 354.85 51.89 65.99 30.7358.7730.7358.4530.7358.90 354.45 57.32 68.41 34.7360.2134.7359.9434.7360.55 352.85 67.63 75.85 55.6668.1255.6668.1255.6668.89 352.55 74.72 78.15 60.6670.4260.6670.4660.6671.10 351.25 89.43 89.43 NULL NULL NULL NULL NULL NULL4结论4.1 分别用NRTL、UNIQUAC、WILSON方程关联的数据和实验值相比较,相对误差大于2%,模拟计算结果不满足工业设计需求。
4.2 在模拟计算中,由于模型参数的复杂性,部分模型参数任然采用系统自带的参数,可能存在与实际存在偏差,在此,可以使用实验数据,用ASPEN PLUS 对模型参数回归,这样能得到较符合实际条件的模型参数。