铜及其它常考的过渡金属元素
- 格式:doc
- 大小:237.00 KB
- 文档页数:4

金属元素知识点总结一、金属元素的定义金属元素是指具有金属性质的元素,通常具有良好的导电性、导热性、延展性和弹性。
金属元素在周期表中主要位于左侧和中间位置,包括钠、铁、铜、铝等元素。
金属元素的性质主要受到其电子排布和原子结构的影响。
二、金属元素的分类1. 碱金属:包括锂、钠、钾等元素,它们具有低密度、低熔点和高反应性的特点。
2. 碱土金属:包括镁、钙、锶等元素,它们具有活泼的化学性质,在自然界中普遍存在。
3. 过渡金属:包括铁、铜、锌等元素,它们具有良好的导电性和导热性,通常用于制造工业材料。
4. 钪族元素:包括钪、钇、镧等元素,它们具有与过渡金属相似的性质。
5. 铀族元素:包括铀、钍、镤等元素,它们具有放射性特点,被广泛应用于核能领域。
6. 稀土金属:包括铈、镨、钕等元素,它们具有多样的化学性质和广泛的应用价值,是现代工业中重要的原材料。
三、金属元素的性质1. 导电性:金属元素中的自由电子能够在外加电场的作用下形成电流,因此具有良好的导电性能。
铜、铝等金属常用于制造电线、电路板等导电材料。
2. 导热性:金属元素的自由电子能够快速传递热量,因此具有良好的导热性能。
铝、银等金属常用于制造散热器、热交换器等导热材料。
3. 延展性:金属元素具有良好的延展性,可以在一定条件下被拉伸成细丝或薄片。
铜、铝等金属常用于制造金属丝、箔等材料。
4. 弹性:金属元素具有一定的弹性,可以在外力作用下产生形变并且恢复原状。
钢、弹簧钢等金属常用于制造弹簧、弹簧元件等。
5. 耐腐蚀性:金属元素中的一部分具有较强的耐腐蚀性,可以在不同环境条件下保持良好的性能。
不锈钢、镍基合金等金属常用于制造耐腐蚀部件。
6. 磁性:金属元素中的一部分具有一定的磁性,包括铁、镍、钴等元素。
它们在外加磁场的作用下能够产生磁性。
四、金属元素的应用金属元素广泛应用于工业、建筑、电子、航空航天等领域,具有重要的经济价值和社会意义。
1. 金属材料:金属元素作为重要的结构材料和功能材料,被广泛应用于制造汽车、飞机、船舶、建筑等领域。


13-6 铜族元素13-6-1 铜族元素概述一、铜族元素通性1•价层电子构型为(n-1)d10 ns1,氧化数有+1、+2、+3,铜、银、金最常见的氧化数分别为+2、+1、+3。
2•铜族金属离子具有较强的极化力,本身变形性又大,所以它们的二元化合物一般有相当程度的共价性。
3•与其它过渡元素类似,易形成配合物。
二、铜族元素单质1•它们的密度大,都是重金属,其中金的密度最大,为19.3g cm-3。
2•硬度小、有极好的延展性和可塑性,金更为突出,3•导热、导电能力极强,尤以银为最,铜是最通用的导体。
4.铜、银、金能与许多金属形成合金。
5•铜、银、金的化学活泼性较差。
铜:在干燥空气中铜很稳定,有二氧化碳及湿气存在,则表面上生成绿色的碱式碳酸铜2Cu + 02 + H2O + CO2 > Cu(0H”C03金:在高温下唯一不与氧气起反应的金属,在自然界中仅与碲形成天然化合物(碲化金)。
银:在室温下不与氧气、水作用,即使在高温下也不与氢、氮或碳作用,与卤素反应较慢,但即使在室温下与含有H2S的空气接触时,表面因蒙上一层Ag2S而发暗,这是银币和银首饰变暗的原因。
4Ag + 2H 2S + O2 > 2AgS + 2H 2。
铜、银不溶于非氧化性稀酸,能与硝酸、热的浓硫酸作用:Cu + 4HN0 3(浓)> Cu(N02 + NO2 f + 2H03Cu + 8HN0 3(稀)> 3C U(N0»2 + 2N0 f + 4H0Cu + 2H 2SO4(浓)―> CuSO- SO2 f + 2H02Ag + 2H2SO4(浓)> AS04 + SO2 f + 2H0Ag + 2HN0 3(65%)> AgNO+ NO z f + HO金不溶于单一的无机酸中,但金能溶于王水(浓HCI:浓HN03 = 3:1的混合液)中:Au + HNO 3+ 4HCl H[AuC4]I + NO f + 22HO 而银遇王水因表面生成AgCI薄膜而阻止反应继续进行。






I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第训I族,属于过渡元素。
原子结构示意图:主要化合价:+2, +32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/cm 3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2 ==2FeCl3 Fe+S= FeSFe+I2= FeI2②跟水反应:3Fe+4H20==(高温)==Fe3O4+4H2炼铁料化学原理铁矿石、焦炭、石灰石、空气在高温下用还原剂从铁矿石里还原出来I①还原剂的生成炼钢生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去I ______________________________________________________________________________________①氧化:2Fe+02fBi温 2FeOC+O2=CO2CO +C 同温2CO 2FeO氧化铁水里的Si、Mn、C等。
如 C+FeO②铁的还原亘ie+COTFe2O3+3CO )高2Fe+3CO2②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
③炉渣的生成③脱氧,并调整Mn、Si含量CaCO3向温 CaO+CO22FeO+SiEL=E2Fe+SiO2③跟酸作用:Fe+2H+=Fe2++H t (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应2不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+4.炼铁和炼钢的比较1.过渡元素位于周期表中中部从niB〜ii B族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。

第13章过渡元素(一)铜族和锌族元素第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性 13.2 铜族元素 13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ? ⅧB族,即ds区和d区元素称为过渡元素,(见表13��1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素ⅢB ⅣB ⅤB ⅥB ⅦB ⅧB ⅠB ⅡB Sc Y La Ac Ti Zr Hf Rf V Nb Ta Db Cr Mo W Sg Mn Tc Re Bh Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Cu Ag Au Zn Cd Hg 通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ? Zn称第一过渡系元素;第5周期的Y ? Cd为第二过渡系元素;第6周期的La ? Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1?2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10ns1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期1元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
原子半径/pm250过渡元素的原子半径第一过渡系第二过渡系200第三过渡系150100ⅠAⅡAⅢBⅣBⅤBⅥBⅦBⅧⅧⅧⅠBⅡB图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
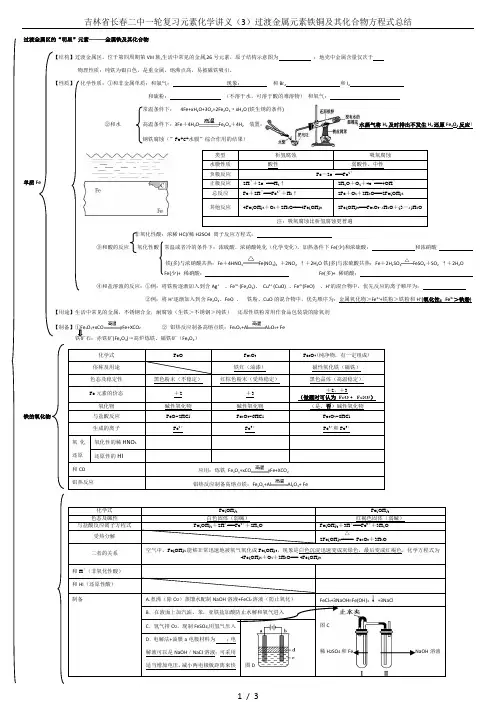
过渡金属区的“明星”元素———金属铁及其化合物【结构】过渡金属区,位于第四周期第VIII 族,生活中常见的金属,26号元素,原子结构示意图为 ;地壳中金属含量仅次于 物理性质:纯铁为银白色,是重金属,熔沸点高,易被磁铁吸引。
【性质】 化学性质:①和非金属单质:和氯气: 现象: 和Br 2 和I 2和硫粉: (不溶于水,可溶于酸的难溶物) 和氧气: 4Fe+xH 2O+3O 2=2Fe 2O 3·xH 2O (铁生锈的条件)②和水 高温条件下:3Fe +4H 2O Fe 3O 4+4H 2 装置: (水蒸气将H 2及时排出不发生H 2还原Fe 3O 4反应)钢铁腐蚀(”Fe+C+水膜”综合作用的结果) 单质Fe非氧化性酸:浓稀HCl/稀H2SO4 离子反应方程式:③和酸的反应 氧化性酸 常温或者冷的条件下:浓硫酸、浓硝酸钝化(化学变化),加热条件下Fe(少)和浓硫酸: 和浓硝酸铁(多)与浓硝酸共热:Fe +4HNO 3Fe(NO 3)2 +2NO 2 ↑+2H 2O 铁(多)与浓硫酸共热:Fe +2H 2SO 4FeSO 4+SO 2 ↑+2H 2OFe(少)+ 稀硝酸: Fe(多)+ 稀硝酸: ④和盐溶液的反应:①例:将铁粉逐渐加入到含Ag + 、Fe 3+ (Fe 2O 3)、 Cu 2+ (CuO) 、Fe 2+(FeO) 、H +的混合物中,优先反应的离子顺序为: ②例:将H +逐渐加入到含Fe 2O 3、FeO 、 铁粉、CuO 的混合物中,优先顺序为:金属氧化物>Fe 3++铁粉>铁粉和H +(氧化性:Fe 3+>铁粉) 【用途】生活中常见的金属,不锈钢合金,耐腐蚀(生铁>不锈钢>纯铁) 还原性铁粉常用作食品包装袋的除氧剂 x O y +xCOyFe+XCO 2 ② 铝热反应制备高熔点铁:Fe x O y +AlAl 2O 3+ Fe(Fe 2O 3)→高炉炼铁、磁铁矿(Fe 3O 4)铁的氧化物yFe+XCO Al铁的氢氧化物含铁盐类归纳总结: 根据“铁三角”书写化学或离子反应方程式过渡金属区的“明星”元素———金属铜及其化合物1.金属铜(1)与非金属的反应Cu —⎪⎪⎪O 2⎪⎪⎪――→加热2Cu +O 2=====△2CuO――→常温下在潮湿空气中2Cu +O 2+CO 2+H 2O===Cu 2(OH )2CO3――→Cl 2Cu +Cl 2=====△CuCl 2 现象:棕黄色烟(2)与酸的反应Cu —⎪⎪⎪⎪――→非氧化性酸不反应氧化性酸⎪⎪⎪ ――→浓H 2SO 4Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O ――→浓HNO 3Cu +4HNO 3(浓)===Cu (NO 3)2+2NO 2↑+2H 2O――→稀HNO 33Cu +8HNO 3(稀)===3Cu (NO 3)2+2NO ↑+4H 2O(3)与盐溶液的反应Cu —⎪⎪⎪――→AgNO 3溶液Cu +2AgNO 3===Cu (NO 3)2+2Ag――→FeCl 3溶液Cu +2FeCl 3===CuCl 2+2FeCl22.氧化铜和氧化亚铜3.氢氧化铜(1)物理性质:蓝色不溶于水的固体。
高中学生化学竞赛辅导——元素部分2铜族元素一、铜族元素的通性包括:铜(Cu)银(Ag)金(Au)价电子构型:(n-1)d10ns1次外层为18电子构型,使铜族元素原子的有效核电荷较多。
M+为18电子构型。
氧化态:+I +II +III 常见氧化态:Cu Ag Au(在水溶液中) +II +I +III铜Cu 银Ag 金Au标准电极电势依次增大,且都大于氢,金属活泼性依次减小单质形成M+(aq)的活性依次降低在酸性溶液中,Cu+Au+易歧化铜族元素的离子具有很强的极化力和明显的变形性,易形成共价化合物易形成配合物化学性质与氧气:在含有CO2的潮湿空气中,铜的表面会逐渐蒙上绿色的铜锈2Cu + O2 + H2O + CO2→ Cu2(OH)2CO3在加热条件下,铜与氧化合成CuO,而银、金不发生变化与酸:有氧存在时,铜可溶于稀酸和浓盐酸铜银可溶于硝酸和浓硫酸金只溶于王水三、铜族元素的重要化合物1、铜的化合物铜的常见化合物的氧化值为+1和+2。
颜色(1)Cu2O制备4CuO→2Cu2O(红)+O2↑(1000℃)2[Cu(OH)4]2-+CH2OH(CHOH)4CHO=Cu2O↓(红棕色)+4OH-+ CH2OH(CHOH)4COOH鉴定醛,医学上检查糖尿病性质a. 对热的稳定性Cu2O对热比较稳定, 在1235℃融化而不分解b.与酸反应——发生歧化反应Cu2O+H2SO4=CuSO4+Cu↓c. 溶于氨水形成配合物Cu2O+4NH3·H2O=2 [Cu(NH3)2]++2OH-+3H2O无色[Cu(NH3)2]+的还原性较强在空气中不稳定:2[Cu(NH3)2]+ +4NH3·H2O+2/1O2= 2[Cu(NH3)4]2+(蓝色) +2OH-+3H2O 可用来除去气体中的氧(2)卤化物CuX(X=Cl,Br,I) 物理性质:白色,难溶于水且溶解度按Cl,Br,I依次降低制备2Cu2++4I-=2CuI↓+I2用此反应以碘量法测定Cu2+的含量Cu2++Cu+4Cl-→2[CuCl2]-(土黄色) 2[CuCl2]-→2CuCl↓(白色)+2Cl-(稀释)总反应: Cu2++Cu+2Cl-→2CuCl ↓(3)配合物Cu+:3d10 能形成配位数为2、3、4的配合物例如:配位数杂化配离子几何构型2 sp [CuCl2]-直线型4 sp3[Cu(CN)4]3- 四面体氧化态为+II的化合物氧化铜CuO 黑色的碱性氧化物,不溶于水溶于酸,热稳定性高, 具有氧化性.氢氧化铜Cu(OH)2 制备: Cu2++2OH-= Cu(OH)2↓(浅蓝色絮状)性质: a. 受热分解Cu(OH)2= CuO (黑色)+H2Ob.显两性Cu(OH)2+ 2NaOH= Na2[Cu (OH)4](蓝色) Cu(OH)2+ 2H+= Cu2++2H2Oc. 易溶于氨水,生成深蓝色的配合物Cu(OH)2+4NH3·H2O= 2[Cu(NH3)4]2+(深蓝色)+2OH-+4H2O 鉴定Cu2+离子Cu(I)和Cu(II)的相互转化2+若使Cu+的歧化反应逆向进行, 需要降低溶液中的Cu+浓度; 在还原剂作用下, 使Cu2+转变为Cu+,同时使Cu+形成配离子或沉淀2、银的化合物(1)在银的化合物中,Ag(Ⅰ)的化合物最稳定。
铜、银及其它常考的过渡金属元素【重要知识点回顾】一、铜1.铜:(1)铜的颜色色(2)火法或湿法制铜:(3)铜与下列物质反应:铜在空气中生成铜绿、浓硫酸(加热)、双氧水(加稀硫酸酸性);硝酸(浓)、硝酸(稀)、硝酸银溶液、铁盐溶液、稀硫酸中加入少量铜不溶解,若加(通)入下列物质,能使铜溶解的是①硫酸铁②硝酸钾③双氧水④氧气(加热)。
(4)粗铜精炼:阳极为,有关电极反应式,比铜活泼的金属如铁以进入,比铜不活泼的金属沉积在中;阴极为,电极反应式;电解质溶液为,电解过程中电解质溶液浓度。
(5)溶液中Cu2+含量测定(碘量法)有关反应的离子方程式:、2.氧化铜:色。
做用氢气还原氧化铜的实验时应先后,实验结果时应先后。
可用于还原氧化铜的物质有:将铜丝在空气中加热后迅速插入乙醇中,现象为,有关化学方程式为、,总方程式为,铜的作用是。
3、氧化亚铜:色。
氧化亚铜溶于稀硫酸:氧化亚铜溶于稀硝酸:检验用氢气还原氧化铜所得产物中是否含氧化亚铜的实验方法是4、氢氧化铜:色。
配制新制氢氧化铜悬浊液的操作:乙醛与新制氢氧化铜加热的化学方程式为5、硫化铜:色。
制备方法硫酸铜溶液中通入硫化氢:硫化铜不溶于盐酸、稀硫酸但溶于稀硝酸:硫化亚铜:色。
制备方法铜在硫蒸气中加法:硫化亚铜溶于稀硝酸:鉴别CuS和Cu2S两种黑色粉末的方法是6、CuH:红色固体,难溶于水;CuH与氯气点燃CuH中加稀盐酸CuH中加稀硝酸酸(只产生一氧化氮一种气体)二、银1、银溶于稀硝酸:(应用:试管的洗涤)2、银氨溶液的配制方法是:,有关反应为乙醛发生银镜反应的离子方程式为3、往硝酸银溶液中依次滴加足量氯化钠溶液、溴化钠溶液、碘化钠溶液、硫化钠溶液,现象为、、、,加入硫化钠溶液的离子方程式三、其他过渡元素1. Zn (1)实验室常用锌与稀硫酸反应制取氢气,为了加快反应速率,可采取的措施有:(2)银锌电池的负极是锌,正极是氧化银,电解质是氢氧化钾,负极反应式为,正极反应式为2.Mn(1)实验室制氧气、氯气都可用到锰的化合物,写出有关化学方程式:氧气氯气(2)向酸性高锰酸钾溶液中加入草酸溶液:生成的Mn2+对该反应起催化作用。
常见过渡金属离子及化合物颜色:一.铜副族(IB):1.1铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr 黄↓;CuI 棕黄↓;Cu2SO4灰黑色(在水溶液中歧化)CuCN 白↓;Cu2O暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(浓溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑;CuS黑↓;CuSO4 无色;CuSO4·5H2O 蓝;Cu(OH)2 淡蓝↓;Cu(OH)2·CuCO3 墨绿;[Cu(H2O)4]2+蓝;[Cu(OH)4]2‐蓝紫;Cu(NH3)4]2+ 深蓝;[CuCl4]2‐黄;[Cu(en)2]2+ 深蓝紫;(CuCO3·Cu(OH) 2)亮红色(孔雀石)(Cu3 (CO3) 2 (OH) 2)蓝色(石青)K2[Cu(CO3)2](暗蓝色)、K2 [Cu(CO3)2]·2H2O(亮蓝色)K2[Cu(CO3)2]·4H2O(浅蓝绿色)炔铜红↓.1.2 银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6]白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3‐,[Ag(CN)2]‐无色.1.3 金化合物:HAuCl4·3H2O 亮黄晶体;KAuCl4·1.5H2O 无色片状晶体;Au2O3 黑;H[Au(NO3)4]·3H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.二.锌副族(IIB):2.1 锌化合物:ZnO 白(锌白颜料)↓;ZnI2 无色;ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性).2.2 镉化合物:CdO 棕灰↓;CdI2 黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl白↓;Hg2Cl2(甘汞) 白↓.2.3 汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);HgS 黑或红↓;Hg2NI·H2O 红↓;Hg2(NO3)2 无色晶体.三. 钪副族(IIIB):略四.钛副族(IVB):4.1 钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;H2TiO3 白色↓;TiO2 白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2·H2O 绿色晶体;TiCl4 无色发烟液体.4.2 锆、铪:MO2,MCl4 白.五. 钒副族(VB):5.1 钒化合物:V2+ 紫;V3+ 绿;V4+ 蓝;V5+ 黄;VO 黑;V2O3 黑;VO2 黄;V2O5 黄或砖红;水合V2O5 棕红;饱和V2O5 溶液(微溶) 淡黄.VO4^3‐黄。
铜、银及其它常考的过渡金属元素【重要知识点回顾】一、铜1.铜:(1)铜的颜色色(2)火法或湿法制铜:(3)铜与下列物质反应:铜在空气中生成铜绿、浓硫酸(加热)、双氧水(加稀硫酸酸性);硝酸(浓)、硝酸(稀)、硝酸银溶液、铁盐溶液、稀硫酸中加入少量铜不溶解,若加(通)入下列物质,能使铜溶解的是①硫酸铁②硝酸钾③双氧水④氧气(加热)。
(4)粗铜精炼:阳极为,有关电极反应式,比铜活泼的金属如铁以进入,比铜不活泼的金属沉积在中;阴极为,电极反应式;电解质溶液为,电解过程中电解质溶液浓度。
(5)溶液中Cu2+含量测定(碘量法)有关反应的离子方程式:、2.氧化铜:色。
做用氢气还原氧化铜的实验时应先后,实验结果时应先后。
可用于还原氧化铜的物质有:将铜丝在空气中加热后迅速插入乙醇中,现象为,有关化学方程式为、,总方程式为,铜的作用是。
3、氧化亚铜:色。
氧化亚铜溶于稀硫酸:氧化亚铜溶于稀硝酸:检验用氢气还原氧化铜所得产物中是否含氧化亚铜的实验方法是4、氢氧化铜:色。
配制新制氢氧化铜悬浊液的操作:乙醛与新制氢氧化铜加热的化学方程式为5、硫化铜:色。
制备方法硫酸铜溶液中通入硫化氢:硫化铜不溶于盐酸、稀硫酸但溶于稀硝酸:硫化亚铜:色。
制备方法铜在硫蒸气中加法:硫化亚铜溶于稀硝酸:鉴别CuS和Cu2S两种黑色粉末的方法是6、CuH:红色固体,难溶于水;CuH与氯气点燃CuH中加稀盐酸CuH中加稀硝酸酸(只产生一氧化氮一种气体)二、银1、银溶于稀硝酸:(应用:试管的洗涤)2、银氨溶液的配制方法是:,有关反应为乙醛发生银镜反应的离子方程式为3、往硝酸银溶液中依次滴加足量氯化钠溶液、溴化钠溶液、碘化钠溶液、硫化钠溶液,现象为、、、,加入硫化钠溶液的离子方程式三、其他过渡元素1. Zn (1)实验室常用锌与稀硫酸反应制取氢气,为了加快反应速率,可采取的措施有:(2)银锌电池的负极是锌,正极是氧化银,电解质是氢氧化钾,负极反应式为,正极反应式为2.Mn(1)实验室制氧气、氯气都可用到锰的化合物,写出有关化学方程式:氧气氯气(2)向酸性高锰酸钾溶液中加入草酸溶液:生成的Mn2+对该反应起催化作用。
(注:图像问题)3、Cr:(1)往K2Cr2O7溶液中滴加浓硫酸,现象是;往K2Cr2O7溶液中滴加氢氧化钠溶液,现象是,解释以上现象(联系:电解K2CrO4溶液可制备K2Cr2O7溶液)(2)电解法除酸性废水中Cr2O72—(铁为阳极),有关的电极反应式及离子方程式:4、Pt、Au不溶于硝酸但能溶于王水(浓盐酸与浓硝酸按体积比3:1混合)。
Pt溶于王水生成H2PtCl6的化学方程式为。
5、Ti:用钠和四氯化钛在高温下反应制取钛的化学方程式为四氯化钛与水反应生成TiO2.xH2O的化学方程式,TiO2.xH2O经焙烧得TiO26、Pb:(1)Pb3O4溶于稀盐酸:Pb3O4与浓盐酸共热:(2)铅蓄电池总反应方程式:放电时,负极电极反应式:,正极电极反应式:7、Ni:在有机反应中常用作反应的催化剂。
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。
总反应方程式如下:NiOOH+MH ,放电时负极反应式为,充电时阳极反应式为【重要考查】1、与铜有关的计算问题例:某混合溶液中含0.8mol的HNO3(稀)和0.4mol的H2SO4(稀),则该溶液最多可以溶解铜A.0.3mol B.0.4 mol C.0.5 mol D.0.6 mol例:现向Cu、Cu2O和CuO组成的混合物中,加入1L0.6mol/L硝酸恰好使混合物溶解,同时收集到2240mlNO气体(标况下),请回答下列问题:(1)写出Cu2O跟稀硝酸反应的离子方程式:(2)若将上述混合物用足量H2加热还原,所得固体的质量为:(3)若混合物中含0.1molCu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为2、铜的化合物的检验或鉴别问题例1:已知酸性条件下有如下反应:2Cu+===Cu2++Cu。
由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。
一同学对某次用氢气还原氧化铜实验A.Cu B.Cu2OC.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu例2:铜及其化合物一般都具有特殊的颜色,例如Cu呈紫红色,Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。
研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。
Ⅰ.查阅资料:①高温灼烧CuO生成Cu2O;②Cu2O在酸性条件下能发生下列反应:Cu2O+2H+===Cu+Cu2++H2O。
Ⅱ.设计实验方案:方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
1、请你评价方案1和方案2。
如果你认为该方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1:__________________________________________________________。
方案2:__________________________________________________________。
(2)方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学关系为________ ,该实验方案最少应进行________ 次称量。
3、CuSO4·5H2O受热分解产物的考查例:0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
(1)试确定200℃时固体物质的化学式__ ___(要求写出推断过程);(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为。
把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为,其存在的最高温度是;(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为_________ _______;(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(K ap[Cu(OH)2]=2.2×10-20)。
若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
4、溶液中Cu2+含量的测定(间接碘量法)例2-2-―(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入______ 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________;过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是:__________ _____。
(用化学方程式表示)。
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是__ _____。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。
用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为_____________ ______ ________。
5、电解法制重铬酸钾例:重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。
工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。
制备装置如图所示(阳离子交换膜只允许阳离子透过):制备原理:2CrO2-4(黄色)+2H+≒Cr2O2-7(橙色)+H2O。
(1)通电后阳极室产生的现象为;其电极反应式:。
(2)该制备过程总反应的离子方程式可表示为4CrO2-4+4H2O===2Cr2O2-7+4OH-+2H2↑+O2↑,若实验开始时在右室中加入38.8 g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3∶2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为;此时电路中转移电子的物质的量为。
6、工业流程题:例1、某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(1)第①步Cu与酸反应的离子方程式为:_________ __________;得到滤渣1的主要成分为___________。
(2)第②步加H2O2的作用是__________,使用H2O2的优点是______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是___。
例2、银铜合金广泛用于航空工业。
从切割废料中回收银并制备铜化工产品的工艺如下:(注:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和80℃)(1)电解精炼银时,阴极反应式为;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为。
(2)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH 的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
(3)完成煅烧过程中一个反应的化学方程式:CuO + Al2O3=== CuAlO2 + ↑(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为mol CuAlO2,至少需要1.0mol·L-1的Al2 (SO4) 3溶液L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是、过滤、洗涤和干燥。