过渡金属元素
- 格式:ppt
- 大小:4.91 MB
- 文档页数:138




过渡元素金属性变化规律金是元素周期表中的第79号元素,是一种重要的过渡金属元素。
金具有许多特殊性质,其中包括其独特的金色、良好的导电性和导热性等。
金的属性很大程度上取决于其化学环境和物理状态。
在本文中,我们将探讨过渡元素金的属性变化规律。
金的基本性质金的原子序数为79,原子量为197,具有原子序数较高的特点。
金的化学符号为Au,是元素周期表中的d区过渡金属元素之一。
金是一种稀有金属,自古以来就被用作珍贵的贵金属。
金的金属特性使其具有良好的导电性和导热性。
金具有优秀的化学稳定性,不容易被氧化或腐蚀。
因此,金常被用于珠宝、金币、电子器件等领域。
金的物理性质金是一种黄金色的金属,具有较高的密度和较高的熔点。
在常温下,金为固体,具有良好的延展性和韧性。
金具有优异的光学性能,可用于反射镜、光学镜片等光学器件。
金的密度为19.32克/立方厘米,熔点达到1064摄氏度,沸点约为2856摄氏度。
金是一种化学稳定的金属,不容易与其他元素发生化学反应。
金的化学性质金是一种化学不活跃的元素,通常以+1和+3的价态存在。
金通常被用作催化剂、电极和电镀等材料。
金在水中不溶解,但可以与氰化物形成配合物。
金的氧化性较低,对许多酸和碱都不会发生化学反应。
金可以与银、铜、铂等金属形成合金,提高其物理性能。
金的属性变化规律金在化学环境和物理状态下表现出不同的属性。
在不同温度和压力下,金的密度、熔点和电导率等性质会发生变化。
金在不同价态下的化合物也具有不同的化学性质。
金的属性变化规律受到化学环境和外部力的影响。
金的物理性质会随着温度和压力的变化而发生改变,这些变化反映了金在不同条件下的稳定性和活性。
综上所述,金作为一种过渡元素具有丰富的属性和特性,其属性变化规律受到多种因素的影响。
深入研究金的属性变化规律有助于更好地理解金的特性和应用。


I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第训I族,属于过渡元素。
原子结构示意图:主要化合价:+2, +32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/cm 3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2 ==2FeCl3 Fe+S= FeSFe+I2= FeI2②跟水反应:3Fe+4H20==(高温)==Fe3O4+4H2炼铁料化学原理铁矿石、焦炭、石灰石、空气在高温下用还原剂从铁矿石里还原出来I①还原剂的生成炼钢生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去I ______________________________________________________________________________________①氧化:2Fe+02fBi温 2FeOC+O2=CO2CO +C 同温2CO 2FeO氧化铁水里的Si、Mn、C等。
如 C+FeO②铁的还原亘ie+COTFe2O3+3CO )高2Fe+3CO2②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
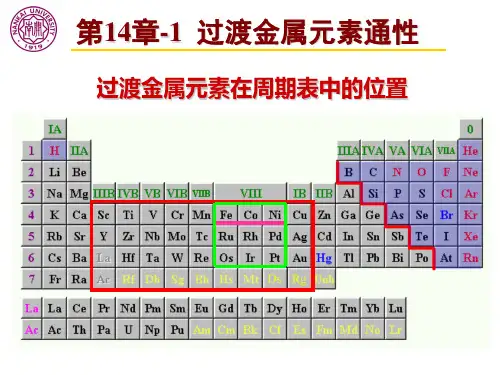
③炉渣的生成③脱氧,并调整Mn、Si含量CaCO3向温 CaO+CO22FeO+SiEL=E2Fe+SiO2③跟酸作用:Fe+2H+=Fe2++H t (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应2不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+4.炼铁和炼钢的比较1.过渡元素位于周期表中中部从niB〜ii B族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。

元素周期表中的主族元素与过渡金属元素元素周期表是化学领域里最重要的工具之一,用于分类和组织已知的化学元素。
它根据元素的原子数和电子排布等特征将元素分为不同的类别。
其中,主族元素和过渡金属元素是两个重要的类别。
本文将对这两类元素进行详细介绍,并探讨它们的性质和应用。
一、主族元素主族元素又称为主族化学家族,包括了元素周期表中1A、2A、3A、4A、5A、6A和7A族的元素。
这些元素具有相似的化学性质,主要是由于它们拥有相似的电子排布。
1.1 原子结构和电子排布主族元素的原子结构和电子排布有一些共同特点。
它们的原子核周围的电子层分别填充有相同数量的电子。
例如,1A族的元素(氢、锂、钠等)具有一个电子在最外层(K层);2A族的元素(铍、镁、钙等)具有两个电子在最外层(L层);以此类推。
1.2 化学性质和应用主族元素的化学性质与其电子排布密切相关。
由于它们外层电子数量相对较少,主族元素通常表现出较低的电负性,并倾向于失去或共享电子,以达到稳定的电子结构。
主族元素在生活中有着广泛的应用。
例如,氧(O)是生命所必需的元素,广泛存在于空气和水中;氢(H)在燃料电池中被用作清洁能源;氯(Cl)和钠(Na)被用于制备食盐等。
此外,主族元素还在药品、化妆品、农药和材料科学等领域得到了广泛应用。
二、过渡金属元素过渡金属元素是元素周期表中位于3B至2B族的元素,它们的特点是较为复杂的电子排布和多样的化学性质。
2.1 原子结构和电子排布过渡金属元素的原子结构较复杂,其电子填充在d轨道中。
这些轨道能容纳不同数量的电子,因此过渡金属元素可以具有不同的氧化态,从而展现出多样的化学性质。
2.2 化学性质和应用过渡金属元素具有许多特殊的化学性质,例如良好的导电性、热稳定性和反应活性等。
这些性质使得过渡金属元素被广泛应用于许多领域。
过渡金属元素常用于催化剂的制备。
钯(Pd)和铂(Pt)等过渡金属催化剂在化学反应中具有高效率和选择性,广泛应用于化学工业和环境保护等领域。


过渡金属的配位数一、过渡金属的基本概念过渡金属,又称过渡元素,是一类在周期表中位于d区元素的统称。
它们具有不完全充满的d轨道,因此表现出较强的金属性。
过渡金属广泛应用于催化剂、磁性材料、合金等领域。
二、过渡金属的配位数定义与分类过渡金属的配位数是指一个过渡金属原子与周围配体原子形成的化学键的数量。
根据配体与过渡金属原子之间的键的复杂程度,过渡金属配位数可以分为简单配位数和复杂配位数。
1.简单配位数简单配位数指的是过渡金属原子与周围配体原子通过单一化学键相连的情况。
在这种情况下,过渡金属原子与配体原子之间的相互作用较弱,配位数较低。
2.复杂配位数复杂配位数是指过渡金属原子与周围配体原子通过多种化学键(如单键、双键、三键等)相连的情况。
在这种情况下,过渡金属原子与配体原子之间的相互作用较强,配位数较高。
三、过渡金属配位数的计算方法过渡金属配位数的计算方法主要有以下几种:1.配体电子对数法:根据配体的电子构型,计算其提供的电子对数,从而确定配位数。
2.配体原子数法:统计配体中与过渡金属原子形成化学键的原子数量,即为配位数。
3.晶体场理论法:根据晶体场理论,分析过渡金属原子在晶体中的环境,确定其配位数。
四、过渡金属配位数在实际应用中的重要性过渡金属配位数在实际应用中具有重要意义,它直接影响着过渡金属化合物的性质和功能。
例如,在催化剂领域,过渡金属配位数会影响催化剂的活性、选择性和稳定性;在磁性材料领域,过渡金属配位数会影响材料的磁性性能等。
五、常见过渡金属化合物的配位数举例1.铁(Fe)催化剂:常见的铁催化剂有Fe-EDTA(配位数6)、Fe-CN(配位数4)等。
2.钴(Co)催化剂:常见的钴催化剂有Co-PN(配位数6)、Co-BIPY (配位数6)等。
六、总结与展望过渡金属的配位数研究对于理解过渡金属化合物的性质和功能具有重要意义。
随着科学技术的不断发展,过渡金属配位数的研究将不断深入,为指导实际应用提供理论依据。

化学钴元素
钴( Co)是一种过渡金属元素,其原子序数为27。
钴的化学性质与铁和镍相似,具有很高的硬度和抗腐蚀性。
在自然界中,钴以矿物的形式存在,如砷化钴、硫化钴等。
钴在工业上有着广泛的应用。
它是制造合金的重要元素,特别是不锈钢和耐热钢。
钴也是磁体的重要原料,用于制造各种电子设备中的磁性元件。
此外,钴还被用于制造硬质合金、催化剂、颜料等。
在生物学中,钴也是一种重要的微量元素。
它在人体内的含量虽然很少,但对红细胞生成有重要作用。
缺乏钴会导致贫血和其他健康问题。
然而,过量的钴对人体是有害的。
长期接触高浓度的钴会引发一种名为“钴中毒”的疾病,症状包括头痛、恶心、呼吸困难等。
因此,在使用含钴的产品时,必须注意安全防护。
元素周期表中的过渡金属元素性质分析元素周期表是化学领域中最重要的工具之一,它将所有已知的化学元素按照一定的规律排列在一起。
其中,过渡金属元素是周期表中的一个重要类别,它们具有独特的性质和广泛的应用。
本文将对过渡金属元素的性质进行分析和探讨。
过渡金属元素是指周期表中3至12族元素,它们的电子排布在d轨道中。
这使得过渡金属元素具有一系列特殊的性质。
首先,过渡金属元素常常具有多种氧化态。
这是因为它们的d轨道能级相对较低,容易失去或获得电子,形成不同的氧化态。
例如,铁元素可以呈现2+、3+、4+等多种氧化态,这使得它在生物体内起着重要的作用,如参与氧气的运输和储存。
其次,过渡金属元素具有良好的催化性能。
由于它们的d轨道能级接近反应物和产物的能级,过渡金属元素能够提供活化能,促进化学反应的进行。
铂金、钯等过渡金属元素常被用作催化剂,广泛应用于化学工业、环境保护和能源领域。
例如,铂金催化剂可用于汽车尾气净化,将有害气体转化为无害物质。
此外,过渡金属元素还具有良好的磁性和导电性。
这是因为它们的d轨道中存在未填充的电子,这些电子能够自由移动,形成电流。
铁、钴、镍等过渡金属元素是常见的磁性材料,它们在电子学和材料科学中有着重要的应用。
例如,硬盘驱动器中的磁性材料就是由过渡金属元素构成的,它们能够存储和读取大量的数据。
过渡金属元素还表现出丰富的颜色。
这是由于它们的d轨道能级与可见光的能级相近,能够吸收或散射特定波长的光。
铬元素的化合物常常呈现绿色,铜元素的化合物呈现蓝色。
这些颜色不仅赋予了过渡金属元素化合物独特的外观,还在颜料、染料等领域中得到广泛应用。
最后,过渡金属元素在生物体内发挥着重要的生理功能。
铁元素是血红蛋白的组成部分,它能够与氧气结合并在体内进行氧气的运输。
锌元素是许多酶的辅助因子,参与多种生化反应。
这些生理功能使得过渡金属元素在医学和生物学研究中具有重要的地位。
综上所述,过渡金属元素具有多种独特的性质和广泛的应用。