青岛科技大学2007物理化学
- 格式:doc
- 大小:41.00 KB
- 文档页数:2

2007-2008 2 基础化学原理(A 卷)化学院孙雪梅07应化,化学,海科等王卫,张召香(答案写在答题纸上,写在试题纸上无效)一填空(共36分,每空1分)1. 某元素的主量子数n = 4,在n = 3,l = 2的轨道上有5个电子,原子的最外层电 子数为2,原子的核外电子排布式为,该元素属______区, 为。
其+2氧化态离子属电子构型。
2. O 22+的分子轨道表达式为,键级为,磁距为。
3. CO 2分子中中心C 原子采取的杂化方式的类型是,分子的空间构型 为,价键结构式为,其分子中的大π键表示为。
4. 在极性溶剂中,若溶质和溶剂间存在氢键,则会使溶质的溶解度(增大/减小)5. 配合物PtC14·2NH 3的水溶液中加入硝酸银不产生沉淀,滴加强碱也无氨放出,所 以它的化学式是,命名为,配位数是。
6. 当[Ni(NH 3)4]2+的磁矩大于零,按价键理论中心离子的杂化方式是,离子的空 间构型是。
7. Co 2+的价电子构型为,根据晶体场理论Co 2+ 与强场配体形成(低/高)自旋配合物,在八面体场中中心离子d 轨道的电子排布方式为, 单电子数为;晶体场稳定化能CFSE 为 Dq 。
8. 已知θθBiYPbY lg 27.94lg 18.04==,K K ,当△pM =±0.3,t 0.5%E =±时,能否 用控制酸度的方法用EDTA 对0.010 mol·L -1的Bi 3+,Pb 2+进行分别滴定?, 原因是;应先滴定哪种物质?,如何确定滴定该物质适合的pH ? 9. HgS 溶于王水的主要原因一是由于王水中的具有氧化性,二是由于具有配位作用,从而使化学平衡向溶解方向移动。
10. 由于效应,使得铋酸钠在酸性条件下具有很强的氧化性。
11. 向HgCl 2溶液中加入氨水可生成白色沉淀,这种沉淀的化学式为。
12. 写出鉴定下列离子所用的试剂名称Co 2+;Ni 2+;Zn 2+; PO 43-;NH 4+;Pb 2+ 。

(答案要注明各个要点的评分标准)一、 选择题(每小题1分,共30分)1-5:CDCBA 6-10:CCDCB 11-15:DABCD 16-20:CCDBD二、 填空题:(每空1分,共36分) 1. MnO 4-22. 232M(Al)()M(Al O )F =3. 小;小4. Cr 2O 72-+ 14H ++ 6e - = 2Cr 3++ 7H 2O ; Fe 3++ e - = Fe 2+5. 223333H CO H O NH CO OH +--+=++ 6. 75~85;自动催化;慢7. 避免诱导反应;使终点颜色变化灵敏;保持酸度 8. 15.8mol ·dm -3 9. 相对10. 1,0; 1.1×102 11. 正;变大 12. 9013. 3; v = k (NO)2(Cl 2) 14. 降低反应活化能低15. 后沉淀,表面吸附,混晶,包藏 16. Pk In θ ; Pk In θ±1; 指示剂的变色范围部分或全部落在滴定突跃范围内 17. K a1θ/K a2θ<104 ; cK a2θ>10-8 ; 酚酞 18. K a θ ,越强 三、 配平化学反应方程式(每小题2分,共6分)(1)3IO 5I 6H I --++→+ = 3 I 2 +3 H 2O(2)32222272Cr 3PbO H O Cr O 3Pb 2H +-++++=++ (3)2323Br 6OH BrO 5Br 3H O ---+=++四、计算题(共27分)1. (6分)解:根据题意,欲不产生Mg (OH )2沉淀,因而 [Mg 2+][OH -]2 =10-1·[OH -]2 =10-11. 25 ≤K θs p,Mg(OH)2 (2分)解得 [OH -]≤10-5. 05则不沉淀的最大 pH =14-pOH =14-5.05=8.95(1分)根据题意,欲使Mg (OH )2沉淀完全,意指沉淀平衡时[Mg 2+]=10-5 mol ·L -1 (1分)因而 K θs p,Mg(OH)2=[Mg 2+][OH -]2≤10-5·[OH -]2=10-11. 25 (1分)解得 [OH -]≥10-3. 12则沉淀完全时最小 pH =14-pOH =14-3.12=10.88(1分)2. (8分)解:据题意有 V 1>0 ,V 2>0,且V 2>V 1,所以样品由NaHCO 3与Na 2CO 3组成。


- 2 / d tR 2 ∞22007-2008学年 2学期大学物理 A (上)(Ⅰ卷)课程考试试题拟题学院(系):适 用 专 业: 数 理 学 院07 级 56 学时各专业拟题人: 校对人: 葛松华籍远明考试时间:2008-07-1(答案写在答题纸上,写在试题纸上无效)一、选择题 (共 30 分)1. 一运动质点在某瞬时位于矢径 -() 的端点处, 其速度大小为(A )(C ) r - r .(B )d t . (D ) d t x , yd r.d t.2. 一质点在平面上运动,已知质点位置矢量的表示式为常量), 则该质点作(A) 匀速直线运动. (B) 变速直线运动. (C) 抛物线运动.(D)一般曲线运动.r = at i + bt - j (其中 a 、b 为3.质点作半径为 R 的变速圆周运动时的加速度大小为( v 表示任一时刻质点的速率)(A )d v. (B )v .d tRd v v 2 ϒ d v 21/ 2v 4 (C )+ d t R. (D ) ' '≤ + ∞ . ƒ4. 某人骑自行车以速率 v 向西行驶,今有风以相同速率从北偏东 30°方向吹来,试问人感到风从哪个方向吹来? (A ) 北偏东 30°. (B ) 南偏东 30°. (C ) 北偏西 30°. (D ) 西偏南 30°.5. 在两个质点组成的系统中,若质点之间只有万有引力作用,且此系统所受外力的矢量和为零,则此系统(A )动量一定守恒,机械能不一定守恒. (B )动量与机械能一定都不守恒. (C )动量不一定守恒,机械能一定守恒 (D) 动量与机械能一定都守恒.6. “理想气体和单一热源接触作等温膨胀时,吸收的热量全部用来对外作功.”对此说法有如下几种评论,哪种是正确的?(A ) 不违反热力学第一定律,但违反热力学第二定律.(B ) 不违反热力学第一定律,也不违反热力学第二定律.d - rd x 2 d t d t+ d y 2 2d(C)违反热力学第一定律,但不违反热力学第二定律.(D)违反热力学第一定律,也违反热力学第二定律.7.一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A)温度相同、压强相同.(B)温度、压强都不相同.(C)温度相同,但氦气的压强大于氮气的压强.(D)温度相同,但氦气的压强小于氮气的压强.8.分子速率分布函数f (v) 的物理意义为:(A)具有速率v 的分子数占总分子数的百分比.(B)速率分布在v 附近的单位速率间隔中的分子数占总分子数的百分比.(C)具有速率v 的分子数.(D)速率分布在v 附近的单位速率间隔中的分子数.9.在静电场中,下列说法哪一个是正确的?(A)带正电荷的导体,其电势一定是正值.(B)等势面上各点的场强一定相等.(C)场强为零处,电势也一定为零.(D)场强相等处,电势梯度矢量一定相等.10.C1和C2两空气电容器串联以后接电源充电.在电源保持联接的情况下,在C2中插入一电介质板,则(A)C1极板上电荷增加,C2极板上电荷增加.(B)C1极板上电荷减少,C2极板上电荷增加.(C)C1极板上电荷增加,C2极板上电荷减少.(D)C1极板上电荷减少,C2极板上电荷减少.二、填空题(共22 分)1.质量m = 1kg 的物体,在坐标原点处从静止出发在水平面内沿x 轴运动,其所受合力方向与运动方向相同,合力大小为F = 3 + 2x (N),那么,物体在开始运动的3 m 内,合力所做的功W = ;且x =3 m 时,其速率v = .2.有一质量为m=5 kg 的物体,在0 到10 秒内,受到如图所示的变力F 的作用.物体由静止开始沿x 轴正向运动,力的方向始终为x 轴的正方向.则10 秒末物体的速度大小为.F(N)C1C2飞4020t(s)O 5 10O d dl3.如图所示,轻弹簧的一端固定在倾角为α的光滑斜面的底端E,另一端与质量为m 的物体相连,O 点2x0B为弹簧原长处,A点为物体的平衡位置,x0为弹簧被m压缩的长度.如果在一外力作用下,物体由A 点沿斜面A向上缓慢移动了2x0距离而到达B点,则该外力所作αE功为.4.如图所示,一水平刚性轻杆,质量不计,杆长l=20 cm,其上穿有两个小球.初始时,两小球相对杆中心O对称放置,与O的距离d=5 cm,二者之间用细线拉紧.现在让细杆绕通过中心O的竖直固定轴作匀角速的转动,转速为ω0,再烧断细线让两球向杆的两端滑动.不考虑转轴的和空气的摩擦,当两球都滑至杆端时,杆的角速度为.5.一“无限长”均匀带电直线,电荷线密度为λ.在它的电场作用下,一质量为m,电荷为2q的质点以直线为轴线作匀速率圆周运动.该质点的速率v =.6.在边长为l 的等边三角形的三个顶点上分别放置着电量为q 的三个正的点电荷.若将另一正点电荷Q 从无限远移到等边三角形的中心,则外力所作的功为.7.一任意形状的带电导体,其电荷面密度分布为σ(x, y, z) ,则在导体表面外附近任意点处的电场强度大小E(x, y, z) = .三、计算题(本题12 分)质量为m 的小船在平静的水面上以速率v0航行.以小船关闭发动机为计时起点,设水的阻力和小船速率之间的关系是f =-kv (其中k 是常量),求:(1)发动机关闭后小船的速率与时间的关系式;(2)发动机关闭后小船通过的路程与时间的关系式;(3)如果v =12 m ⋅s -1, 处关闭发动机最合适?k / m = 0.25s -1.为了节省燃料,小船靠码头时在离码头多远Ox2四、计算题(本题 12 分)电风扇在开启电源后,经过t 1 时间达到了额定转速,此时相应的角速度为ω0 .当关闭电源后,经过t 2 时间电风扇停转.已知电风扇转子的转动惯量为 J ,并假定摩擦阻力矩 M f 和电机的电磁力矩 M r 均为常量,求:(1) 开启电源到达到额定转速过程中的角加速度 β1 ;(2) 关闭电源到电风扇停转过程中的角加速度 β2 ;(3) 摩擦阻力矩 M f ;(4) 电机的电磁力矩 M r五、计算题(本题 12 分)1mol 双原子分子理想气体,做如图所示的循环,其中ab 代表等体过程, bc 代表绝热过程, ca 代表等压过程.设 p 1 = 1.0 ⨯105 Pa , p = 3.0 ⨯105 Pa ,V = 1.0 ⨯10-3 m 3 ,V = 2.0 ⨯10-3 m 3 .求: (1) 一次循环中,系统从外界吸收的热量; (2) 一次循环中,系统向外界放出的热量; (3) 一次循环中,系统对外界做的功; (4) 循环的效率.六、计算题(本题 12 分)一球形电容器由两个同心金属球面组成,内、外球面半径分别为 R 1 和 R 2 ,其间充满相对电容率为ε r 的各向同性均匀电介质,设内、外球面分别带有等量异号电荷+ Q 和- Q , 求:(1) 电容器间的电场强度大小分布和两极板间的电势差; (2) 电容器的电容和电容器所贮存的能量;(3) 设电介质的击穿场强为 E b 、R 2 为定值.在电介质不被击穿的情况下,R 1 取多大时可使电容器贮存的能量最多?1 21 m v2007-2008 学年 2 学期大学物理A (上)(Ⅰ卷) 试题标准答案拟题学 院 (系 ):数理学(答案要注明各个要点的评分标准)一、选择题 (每小题 3 分,共 30 分)1.(D )2.(B )3.(D )4.(C )5.(A )6.(B )7.(C )8.(B )9.(D ) 10.(A )二、填空题(共 22 分)1. 18 J 6m/s( 4 分) 2.40 m/s(3 分) 3. 2mgx 0 sin α(3 分)4.ω (3 分)45.6. 4πε 0lο (x , y , z ) 7.ε 0(3 分)(3 分)(3 分)三、计算题(12 分)(1) 由牛顿第二定律得m dv= -kv dt分离变量并积分得(2 分)v dvtkv k ⎰ = ⎰ - dtv 0- k tln 0= - tm (2 分)v = v 0 e m(2 分)λq πε 0m3 3qQv0 t 0(2)由v =dx= v edt0 - k tm分离变量并积分得x t⎰ dx = ⎰ v 0e 0v m -k t mdt- k t(2 分)x = 0 (1 - e m )k(2 分)(3) (3)t → ∞.....x = v 0 mk将 v = 12m ⋅ s -1 , k /m = 0.25s -1x = 12= 48m0.25代入上式得(2 分)四、计算题(12 分)(1) 根据题意,电风扇在开启电源后到达额定转速过程中,作匀加速转动ω = β tβ =ω0(3 分)1 111(2)同理,关闭电源后到电风扇停转,做匀减速转动0 = ω0 + β2t 2β = -ω02t(3 分)2(3) 关闭电源后到电风扇停转,根据转动定律有- M f= J β = -J ω2 t(3 分)2(4) 开启电源后到达额定转速,根据转动定律有M r - M f = J β1M r = J β1 + M f= J ω ( 11+ 1 )t 2(3 分)五、计算题(12 分)ab 过程吸热,bc 过程Q = 0 ,ca 过程放热。

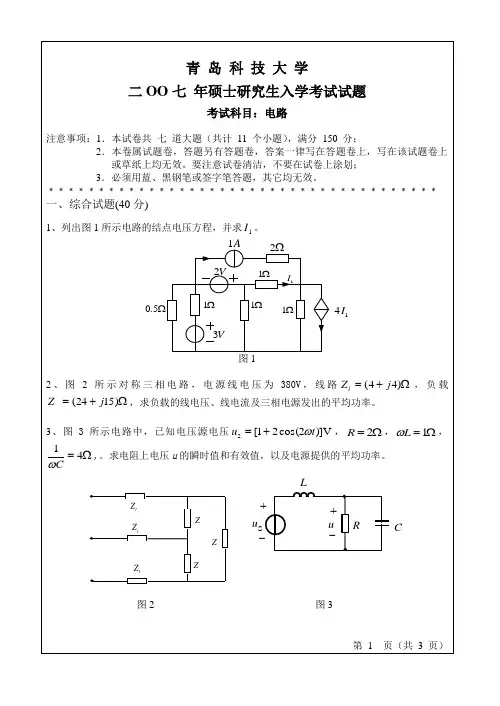
图621/U U 。
求出H 图7 所示电路,已知当1V S U =,=S I 。
求当3V S U =,2A S I =时,U图 9所示双口网络的Z ,Y ,H 参数。
(20分)Ω2Ω21I 2I四、在图3所示正弦稳态电路中,已知1求:(1) 1S 闭合,2S 断开时的电流图2图3图4图5 图6青 岛 科 技 大 学二○一一年硕士研究生入学考试试题考试科目:电路注意事项:1.本试卷共7道大题(共计10个小题),满分150分;2.本卷属试题卷,答题另有答题卷,答案一律写在答题卷上,写在该试题卷上或草纸上均无效。
要注意试卷清洁,不要在试卷上涂划;3.必须用蓝、黑钢笔或签字笔答题,其它均无效。
﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡ 一.简答题(38分)1.试举两例,说明叠加定理在电路分析中的应用(8分); 2.在图1正弦稳态电路中,已知2A 的读数为5A ,求1A 和3A 表的读数(10分);3.求图2所示电路的网络函数)()(2s U s H,并求出零、极点(8分);图1 图24.在图3所示三相对称电路中,已知电源线电压为380V ,电流表的读数为17.3A ,三相功率为6KW 。
试求:(1)每相负载的阻抗;(2)当A 线断开时,图中各电流表的读数和三相功率(12分)。
二.在图4正弦稳态电路中,已知V U s 250=,A I I c 101==,Ω=15R ,求:1I 、c x 及1R ;(2)电路消耗的有功功率、无功功率和功率因数。
(20分)三.图5所示电路中,当Ω=3α ,Ω=6R 时,I=2A ;当Ω=2α ,Ω=8R 时,用戴维宁定理和直接列方程两种方法求此时的电流I (25分)。
四.图6电路中N 由电阻元件所组成,已知图6(a )中,A I 12=,请分别用互易定理的三种图3图4图5五.图7所示电路中,分别用回路电流法和结点电压法列写电路方程(不求解)(22分)。

青岛科技大学物理化学试题三套及答案青岛科技大学物理化学试题之一第一套一、填空题(每小题2分,共20分)1、系统处于热力学平衡状态时,必须同时满足、、、四个条件平衡。
2、同一个系统的U、H、A、G这四个热力学量,最大,最小。
3、补全热力学函数关系式:dG= + VdP ;(?G/?p)T = 。
4、理想气体与温度为T的大热源接触作等温膨胀,吸热Q,所做的功是变化到相同终态的最大功的20%,则系统的熵变为(用T和Q 表示)。
5、等温等压下两种纯物质混合形成理想溶液,则△mix V 0,△mix H 0,△mix S 0,△mix G 0(填“>”或“<”或“=”)。
6、非理想气体的标准态是指:。
7、热分析法绘制相图时,常需画出不同组成混合物的温度-时间曲线,这种线称之为。
8、写出化学反应等温式:。
9、反应C(s)+O2(g)=CO2(g),2 CO(g) +O2(g)= 2CO2(g),C(s)+ 1/2 O2(g)=CO(g)的平衡常数分别为K1Θ、K2Θ、K3Θ,这三个平衡常数之间的关系是K3Θ= 。
10、298K时有一仅能透过水的渗透膜将0.01mol/L和0.001mol/L的蔗糖溶液分开,欲使该体系达平衡,需在浓度为的溶液上方施加压力,该压力为Pa。
二、选择题(每小题2分,共30分)1、下列说法不符合近代化学的发展趋势与特点的是()(A)从单一学科到交叉学科(B)从宏观到微观(C)从平衡态研究到非平衡态研究(D)从表相到体相2、下列关于热力学方法的叙述,不正确的是()(A)热力学研究对象是大量分子的集合,所得的结论不适用于分子的个体行为。
(B)热力学可以解决怎样把一个变化的可能性变为现实性的问题(C)经典热力学不考虑物质的微观结构和反应机理(D)经典热力学不能解决一个具体变化所需要的时间3、下列参数中属于过程量的是()(A)H (B)U (C)W (D)V4、实际气体处于下列哪种情况时,其行为与理想气体接近()(A)高温高压(B)高温低压(C)低温高压(D)低温低压5、在一个刚性绝热容器内发生苯在氧气中燃烧的反应()(A) △U=0,△H<0,Q=0 (B) △U=0,△H>0,W=0(C) △U=0,△H=0,Q=0 (D) △U=0,△H=0,W=06、关于Joule-Thomson系数μJ-T,下列说法错误的是()(A)μJ-T是系统的强度性质(B)μJ-T<0,表示节流膨胀后气体的温度下降(C)常温下,大多数气体的μJ-T为正值,而H2和He的μJ-T 为负值(D)理想气体的μJ-T = 07、工作在393K和293K的两个大热源间的卡诺热机,其效率约为()(A) 83%(B) 25%(C) 100%(D) 20%8、当10mol N2和20mol H2混合通过合成氨塔,反应一段时间后有5mol NH3生成。

全国化学排名及专业排名全国化学排名2007年排名学校代码及名称整体水平得分10001 北京大学 1 95 10055 南开大学3 10284 南京大学 9210246 复旦大学 4 89 10358 中国科学技术大学6 10183 吉林大学 877 10486 武汉大学 8510335 浙江大学 8 84 10558 中山大学10 10384 厦门大学 83分析化学排名排名学校名称等级排名学校名称等级排名学校名称等级1 武汉大学 A+ 8 西南大学 A 15 山东大学 A2 北京大学 A+ 9 东北大学 A 16 西北师范大学 A3 厦门大学 A+ 10 中国科学技术大学 A 17 四川大学 A4 南京大学 A+ 11 兰州大学 A 18 陕西师范大学 A5 湖南大学 A 12 南开大学 A 19 中南大学 A6 浙江大学 A 13 华东师范大学 A7 吉林大学 A 14 复旦大学 AB+ 等 (29 个 ) : 西北大学、河北大学、中山大学、清华大学、北京化工大学、同济大学、福州大学、苏州大学、安徽师范大学、南昌大学、北京理工大学、扬州大学、河南师范大学、山东师范大学、湖南师范大学、聊城大学、华东理工大学、郑州大学、山西大学、桂林工学院、江南大学、北京师范大学、湖北师范学院、浙江工业大学、上海交通大学、云南大学、辽宁大学、辽宁石油化工大学、中国地质大学B 等 (29 个 ) : 首都师范大学、华中科技大学、青岛科技大学、浙江师范大学、上海师范大学、东北师范大学、湘潭大学、上海大学、河南大学、广西师范大学、中国海洋大学、安徽大学、贵州师范大学、成都理工大学、东南大学、中国农业大学、吉首大学、长春师范学院、沈阳药科大学、暨南大学、漳州师范学院、西南科技大学、东华理工大学、华中师范大学、济南大学、广西大学、延边大学、延安大学、中南民族大学无机化学排名排名学校名称等级排名学校名称等级排名学校名称等级 1 南京大学A+ 7 山东大学 A 13 郑州大学 A 2 吉林大学 A+ 8 东北师范大学 A 14 清华大学A 3 南开大学 A+ 9 兰州大学 A 15 武汉大学 A 4 北京大学 A+ 10 复旦大学 A16 同济大学 A 5 中国科学技术大学 A 11 厦门大学 A 17 苏州大学 A 6 中山大学 A 12 浙江大学 AB+ 等 (26 个 ) : 北京师范大学、黑龙江大学、福州大学、湖南大学、北京理工大学、四川大学、中南大学、北京化工大学、华中科技大学、哈尔滨工业大学、安徽大学、长春理工大学、西北大学、天津大学、华东理工大学、山西大学、上海交通大学、宁波大学、上海大学、山西师范大学、大连理工大学、辽宁师范大学、辽宁大学、暨南大学、陕西师范大学、河南大学B 等 (25 个 ) : 广西师范大学、河南师范大学、青岛科技大学、西北师范大学、河北大学、华东师范大学、华南理工大学、新疆大学、南昌大学、武汉理工大学、汕头大学、河北师范大学、曲阜师范大学、哈尔滨师范大学、安庆师范学院、安徽师范大学、内蒙古大学、华中师范大学、贵州大学、湖北大学、中北大学、沈阳化工学院、云南师范大学、江苏大学、西南大学有机化学排名排等排等排等学校名称学校名称学校名称名级名级名级A+ A A 1 兰州大学 8 吉林大学 15 徐州师范大学A+ A A 2 南开大学 9 山东大学 16 华中师范大学A+ A A 3 北京大学 10 南京大学 17 天津大学A+ A A 4 浙江大学 11 中山大学 18 郑州大学A+ A A 5 四川大学 12 复旦大学 19 苏州大学 6 A 13 武汉大学 A 20 湖南师范大学 A 中国科学技术大学A A A 7 清华大学 14 厦门大学 21 云南大学B+等(32个):华东理工大学、安徽师范大学、聊城大学、北京师范大学、华东师范大学、湖南大学、西北大学、同济大学、福州大学、湘潭大学、延边大学、东北师范大学、北京化工大学、河北大学、西北师范大学、华中科技大学、河北师范大学、东华大学、大连理工大学、中国农业大学、上海交通大学、南昌大学、西南大学、浙江工业大学、黑龙江大学、江西师范大学、陕西师范大学、江苏工业学院、广西大学、贵州大学、广西师范大学、辽宁师范大学B等(31个):新疆大学、浙江师范大学、河南大学、华南师范大学、首都师范大学、上海大学、辽宁大学、河南师范大学、温州大学、南京理工大学、杭州师范大学、山东师范大学、烟台大学、上海师范大学、山西大学、扬州大学、大连大学、长春工业大学、青岛科技大学、西华师范大学、中南大学、南京工业大学、陕西科技大学、广州大学、湖南科技大学、内蒙古民族大学、曲阜师范大学、沈阳药科大学、内蒙古大学、云南师范大学、福建师范大学物理化学排名1 北京大学 A+ 8 清华大学 A 15 北京理工大学 A2 吉林大学 A+ 9 南京大学 A 16 福州大学 A3 中国科学技术大学 A+ 10 大连理工大学 A 17 华东师范大学 A4 复旦大学 A+ 11 武汉大学 A 18 天津大学 A5 浙江大学 A+ 12 北京师范大学 A 19 中山大学 A6 厦门大学 A 13 山东大学 A 20 湖南大学 A7 南开大学A 14 辽宁师范大学 AB+ 等 (31 个 ) : 四川大学、上海交通大学、兰州大学、华东理工大学、北京化工大学、东北师范大学、扬州大学、山东师范大学、西北大学、同济大学、华南师范大学、苏州大学、河南师范大学、新疆大学、华中科技大学、哈尔滨工业大学、西北工业大学、陕西师范大学、南京师范大学、重庆大学、东南大学、安徽师范大学、东北大学、上海大学、华南理工大学、太原理工大学、浙江工业大学、中南大学、浙江师范大学、武汉理工大学、上海师范大学B 等 (31 个 ) : 河北师范大学、南昌大学、华中师范大学、湘潭大学、西北师范大学、郑州大学、长春理工大学、南京理工大学、河北大学、宁波大学、南京工业大学、青岛科技大学、西南大学、青海民族学院、黑龙江大学、云南师范大学、南京航空航天大学、烟台大学、内蒙古师范大学、首都师范大学、长沙理工大学、辽宁大学、曲阜师范大学、山西大学、中南民族大学、内蒙古大学、山东理工大学、广西大学、中国海洋大学、温州大学、贵州大学。

2007-2008 1 基础化学原理(B 卷) 化学院 孙雪梅应化,化学,海科等 许泳吉(答案写在答题纸上,写在试题纸上无效)一. 判断题:对者打“√”,错者打“×”(共10分,每题1分)1. 同一反应的反应进度因选用计算物质的不同而不同。
( )2. 热力学第三定律规定,在绝对零度时,任何理想晶体的熵值为零。
( )3. 金刚石比石墨稳定,所以金刚石的标准生成焓等于零 ( )4. 在定温定容下,反应NH 4Cl (s)NH 3 (g) + HCl (g)达平衡,加入惰性气体平衡不移动。
( )5. 速率方程式中浓度的指数与化学计量系数一致,则反应一定为基元反应。
( )6. 在酸碱滴定终点时,指示剂呈其酸式色或其碱式色。
( )7. 沉淀能否转化及转化的程度,取决于两种沉淀溶度积的相对大小。
类型相同时,sp θK 大的沉淀容易转化成sp θK 小的沉淀。
( )8. 标准氢电极的电池符号可以表示成:H + (0.1 mol·L -1)│H 2(101.325 kPa ),Pt (+) ( )9. 因为2θCl /Cl 1.36V -=ϕ,22θMnO /Mn 1.23V +=ϕ, 由此说明MnO 2不能氧化HCl 而生成Cl 2。
( )10. 氧化还原指示剂的变色范围为pH=0.059n'±ϕ ( ) 二. 填空题(共30分,每空1分):1. 已知AgBr 的标准摩尔生成焓为-100.4 kJ·mol -1,请写出热化学反应方程式 。
2. 已知反应 C (石墨,s) + O 2 (g) = CO 2 (g) θr m ΔH (1) = –393.5 kJ·mol -1CO (g) + 1/2 O 2 (g) = CO 2 (g) θr m ΔH (2) = –283.0 kJ·mol -1求反应C (石墨,s) + 1/2 O 2 (g) = CO (g)的θr m ΔH =3. 化学反应速率的大小,首先取决于反应物的本性,除此之外,反应速率还与反应物的 , 与 等因素有关。


青岛科技大学化学工程与工艺专业材料清单青岛科技大学化学工程与工艺专业资料清单教员近5年编写出版的教材清单1. 化工原理学习指点唐继国2001.10 陆地大学出版社2. 化工原理赵文2001.9 石油大学出版社3. 物理化学实验滕虹霓2002.8 化学工业出版社4. 基础无机化学〔化工专业〕杨丰科2001.9 化学工业出版社近5年教员出版的专著清单1.化学化工物性数据手册〔无机卷〕董殿权2002.4 化学工业出版社2.进程系统工程词典韩方煜2002.4 中国石化出版社3.工业水回用及废水最小化〔译〕项曙光2001.12 中国石化出版社4.固体酸催化剂与精细化工于世涛2006.4 化学工业出版社教员近5年宣布的主要教学研讨论文清单1.殷树梅, 改良专业课教学方式,培育创新型科技人才,2001中国现代教育论坛,89-902.王晓红等,基于MATLAB的化工单元操作图形演示模块开发,计算机与运用化学,2001,18〔4〕:373-3763.王晓红等,基于PowerBuilder 的化工原理查询软件的开发与完成,青岛化工学院学报,2001,22〔3〕:2394.叶臣等,化工原理多媒体课件的开发及运用,初等文科教育,2002,〔教育教学研讨专集〕156-1575.赵文等,化工类专业CAI课程体系的研讨,化工初等教育,2002,1:82-836.周传光等,化学工程与工艺课程体系树立的探求与实际,化工初等教育,2002,2:22-257.岳学海等,化工专业CAI系统的研讨与开发,青岛化工学院学报,2002,3:85-888.王犇等,选修课中的探求式教学形式的研讨,现代教学与管理,2003,3〔11〕:8-99.岳学海等,课堂教学CAI体系的构建与实施,航空教育,2004,1:105-10810.岳学海等,MATLAB在化工计算CAI中的运用,实验室研讨与探求,2003,3:78-7911.田文德等,化工原理精馏进程的计算机辅佐计算,计算机与运用化学,2005,10:925-92812.田文德等,化工原理实验装置的数据采集,化工初等教育〔已接受〕13.王许云等,深化化工原理课程革新的实际,高教研讨〔已接受〕近5年承当的省、部级教学革新项目清单1.陈学玺等,化学工程与工艺教学革新试点专业2001年山东省教育厅2.王晓红等,化工原理教学革新试点课程2001年山东省教育厅近5年教员在中心期刊宣布的主要论文清单说明: 局部教员的论文没有统计在内。
青岛科技大学物化考研大纲420物理化学考试大纲青岛科技大学硕士研究生入学考试物理化学考试大纲本《物理化学》考试大纲适用于青岛科技大学化学化工类专业的硕士研究生入学考试。
物理化学是化学学科的重要分支,是化学和化工学科的重要理论理论基础。
物理化学课程的主要内容包括化学热力学(统计热力学)、化学动力学、电化学、界面化学与胶体化学等。
要求考生熟练掌握物理化学的基本概念、基本原理及计算方法,并具有综合运用所学知识分析和解决实际问题的能力。
一、考试内容1. 气体的性质1.1理想气体状态方程1.2理想气体混合物1.3真实气体状态方程(范德华方程)1.4气体的液化及临界参数1.5对比参数、对应状态原理及普遍化压缩因子图2. 热力学基础2.1热力学基本概念2.2热力学第一定律2.3恒容热、恒压热、焓2.4热容、恒容变温过程、恒压变温过程2.5热力学第一定律在单纯状态变化(等温、等压、等容、绝热、节流膨胀)过程中的应用2.6热力学第一定律在相变化变化(可逆相变、不可逆相变)过程中的应用2.7 化学计量数、反应进度2.8标准摩尔生成焓、标准摩尔燃烧含及由标准摩尔生成焓和标准摩尔燃烧焓计算标准摩尔反应焓变2.9盖斯定律及其应用2.10卡诺循环2.11熵、热力学第二定律及自发性的判断2.12单纯pVT变化熵变的计算2.13相变过程熵变的计算2.14热力学第三定律和化学变化过程熵变的计算2.15亥姆霍兹函数和吉布斯函数及其函数変计算2.16热力学函数关系式3.化学平衡3.1偏摩尔量和化学势3.2气体组分的化学势3.3化学平衡条件与理想气体化学反应的标准平衡常数3.4化学反应的等温方程3.5多项反应的化学平衡3.6温度对标准平衡常数的影响3.7温度、压力、浓度、惰性组分等因素对理想气体化学平衡的影响3.8逸度与逸度因子3.9真实气体反应的化学平衡及压力对真实气体化学平衡的影响3.10平衡常数及平衡组成的计算4.相平衡4.1相律4.2单组分两相平衡时温度与压力的关系4.3水的相图4.3拉乌尔定律和亨利定律4.4理想液态混合物、理想稀溶液及稀溶液的依数性4.5活度及活度因子4.6液态多组分系统中各组分的化学势4.7杠杆规则4.8二组分理想液态混合物的气-液平衡相图4.9二组分真实液态混合物的气-液平衡相图4.10二组分液态部分互溶系统的液- 液平衡相图4.11简单二组分凝聚系统相图4.12生成稳定化合物与不稳定化合物的二组分凝聚系统相图4.13二组分固态部分互溶系统液-固平街相图4.14二组分固态互溶系统液-固平衡相图4.15三组分系统液-液平衡相图5.统计热力学基础5.1独立子系统、相依子系统、离域子系统5.2粒子各种运动形式的能级及能级的简并度5.3能级分布分布与状态分布5.4微态数及系统的总微态数5.5等几率原理、最概然分布与平衡分布5.6玻耳兹曼分布5.7粒子配分函数的析因子性质及粒子配分函数的计算5.8系统的热力学能与配分函数的关系5.9系统的摩尔定容热容与配分函数的关系5.10系统的熵与配分函数的关系5.11其它热力学函数与配分函数的关系5.12理想气体反应的标准平衡常数6.电化学6.1电解质溶液的导电机理及法拉第定律6.2离子的迁移数6.3电导、电导率和摩尔电导率6.4电导测定在电解质解离度及解离常数、难溶盐溶解度计算中的应用6.5强电解质的活度和活度因子6.6离子强度、德拜-休克尔极限公式6.7可逆电池及其表达式6.8可逆电池电动势的测定6.9可逆电池热力学6.10电动势的产生6.11电极电视机电极反应的能斯特方程6.12电极的种类及电动势计算6.13电动势测定的应用(氧化还原反应的平衡常数、难溶盐溶度积及溶液pH的确定)6.14电化学反应速率与电流密度6.15分解电压与析出电势6.16极化作用与超电势6.17超电势测定与计划曲线6.18电解时的电极反应6.19电化学腐蚀与防护7.界面现象与胶体7.1界面张力与表面积不是吉布斯函数7.2弯曲液面的附加压力与弯曲液面的蒸汽压7.3溶液的表面吸附与吉布斯吸附等温式7.4表面活性剂及种类7.5气固表面上的吸附与兰格缪尔吸附等温式7.6液-固界面现象与液-液界面现象7.7胶团的结构、胶体的性质及稳定性8.化学动力学8.1化学反应的反应速率的表示及测定8.2速率方程与数率常数8.3简单级数反应的动力学方程8.4速率方程的确定8.5典型复合反应的动力学特征8.6复合反应动力学处理的近似方法8.7链反应动力学8.8温度对反应速率的影响8.9气体反应的碰撞理论8.10溶液反应、催化反应及光化反动力学二、考试要求1. 气体的性质掌握理想气体状态方程和混合气体的性质(组成的表示、分压定律、分容定律)。
考生答题须知1.所有题目(包括填空、选择、图表等类型题目)答题答案必须做在考点发给的答题纸上,做在本试题册上无效。
请考生务必在答题纸上写清题号。
2.评卷时不评阅本试题册,答题如有做在本试题册上而影响成绩的,后果由考生自己负责。
3.答题时一律使用蓝、黑色墨水笔或圆珠笔作答(画图可用铅笔),用其它笔答题不给分。
4.答题时不准使用涂改液等具有明显标记的涂改用品。
一.选择与填充题(每题2分,共30分)1. 物质的量为n的理想气体,其(әH/әp)T = ,C p,m-C V,m = 。
2. 1 mol理想气体由300 K、1 MPa向真空膨胀至0.1 MPa,此过程的ΔS系统0、ΔS 总0。
(填>、<或=)3.某温度下,理想气体反应PCl5 (g) =PCl3 (g) + Cl2 (g)达到平衡时,PCl5的离解度为α1。
若等压下通入N2,PCl5的离解度为α2,则α1α2;若等容下通入N2,PCl5的离解度为α3,则α1α3。
4. 影响实际气体反应标准平衡常数pK的物理量是。
A. 系统总压B. 温度C. 催化剂D. 惰性气体的量5. 分子能级的简并度g与各种运动形式的能级简并度g t、g v、g r、g e、g n之间的关系是。
6. 公式Θv=hν / k中Θv为。
A. 玻尔兹曼常数B. 阿伏伽德罗常数C. 振动特征温度D.配分函数7. 某系统中存在如下三个反应,且均已达到平衡:NiO(s)+CO(g) = Ni(s)+CO2(g)H2O(l)+CO(g)= H2(g)+CO2(g)NiO(s)+H2(g) = H2O(l)+Ni(s)此系统的独立反应数R =,自由度数f =。
A . 3 B. 2 C. 1 D. 08. 将溶质A和B分别溶于水中形成稀溶液,凝固时均析出冰,且A溶液的凝固点低于B溶液的凝固点,则A 溶液的渗透压。
A. 一定高于B溶液的渗透压B. 一定低于B溶液的渗透压C. 一定等于B溶液的渗透压D. 一定等于水的渗透压9. 已知25℃下E (Cd2+ | Cd) = - 0.403 V,氢在Cd上的超电势η= 0.414 V,若25℃,100k Pa下以Cd为阴极电解CdSO4 (a =1) 的酸性溶液(H 1a+=),则阴极上。
青岛科技大学教师授课教案课程名称分离工程课程性质必修授课教师叶庆国教师职称教授授课对象化工工艺04级6~8班、05级AB班授课时数 40学时教学日期 2007年3月~6月所用教材分离过程授课方式课堂教学分离工程Separation Engineering学时数:40小时1、课程依据课程依据本大纲依据化学工业出版社刘家淇编写的“化工分离过程”(2002),化学工业出版社Seader J D编写的“Seperation Process Principles”(2002),史季芬编,“多级分离过程—蒸馏、吸收、萃取、吸附”(1991)等编写。
适用于化学工程与工艺及相近化工类专业本(专)科学生。
2、课程的性质、地位和任务本课程是化学工程与工艺及相近化工类专业教学中一门专业基础课程,是建立在物理化学、化工原理、化工热力学、传递课程原理等技术基础课程知识之上的一门必修课程。
化工分离过程是实现化工生产过程的必不可少的重要步骤。
它在化工生产中的地位和作用,决定了本课程在化学工程及相近化工类专业人才培养中的地位和作用。
因此,化工分离过程的知识和理论在化学工程及相近化工类专业人才的知识构成中占有相当重要的分量。
本课程的主要任务是运用化工单元操作的基本知识、溶液相平衡理论、动量、热量和质量传递的原理来研究化工生产实际中复杂的物系的分离和提纯技术、分析和解决在化工生产、设计和科研中常用的分离过程的理论和实际问题;讨论分离设备的处理能力和效率,分离过程的节能技术和分离流量的选择;简要介绍膜分离、吸附、反应精馏等其它分离技术主分离过程的选择。
通过学习和应用化工分离过程的基本理论、概念和知识,掌握各种常用分离过程的基本理论,操作特点,简捷和严格的计算方法和强化、改进操作的途径,对一些新分离技术有一定的了解;通过对典型实例的分析和讨论,培养选择适宜的分离方法,进行分离过程特性分析,解决在操作和设计方面的实际问题的能力;从分离过程的共性出发,通过讨论各种分离方法的特征,培养和建立工程与工艺相结合的观点和经济学的观点,以及考虑和处理工程实际问题的能力;培养学生科学的思想方法,注重实际的求实态度。
青岛科技大学2007年研究生入学考试试卷
考试科目:物理化学(答案全部写在答题纸上)
一. 选择及填充题(每小题3分,共30分)
1. 无非体积功的封闭系统中,等温、等压下的化学反应可用______来计算系统的熵变。
A. ΔS=Q/T
B. ΔS=ΔH/T
C. ΔS=(ΔH-ΔG)/T
D. ΔS=nR ln(V2/V1)
2. 298 K时气相反应2 SO3(g) == 2 SO2(g) + O2(g) 的标准平衡常数为K p (1),反应 2 SO2(g) + O2(g) == 2 SO3(g) 的标准平衡常数K p (2) = _______________。
A. Kp (1)
B. -Kp (1)
C. 1 / Kp (1)
D. [Kp (1)]1/2
3. 已知25℃时标准电极电势E (Ag+|Ag)=0.799 V,E (Cu2+|Cu)=0.337 V。
25℃时电池
Cu|Cu2+(a=1)‖Ag+(a=1)|Ag
的电动势E=______V。
A. –0.462
B. 0.462
C. –1.136
D. 1.136
4. 0.1 mol·dm-3的KI溶液与等体积的0.08 mol·dm-3的AgNO3溶液相混,制得的AgI溶胶分别用以下四种电解质溶液使其聚沉,其中聚沉能力最大的是___________:
A. Na2SO4
B. ZnCl2
C. Na3PO4
D. AlCl3
5. 在各种运动形式的配分函数中,与粒子运动空间有关的是______________。
A. q t
B. q v
C. q r
D. q t与q v
6. 某系统中粒子的分布符合玻尔兹曼分布。
温度T下,分布在简并度均为1的两个能级ε2和ε 1 上的粒子数之比n2/n1=____________________。
A. (ε2-ε1) / (kT)
B. exp[ε2 / (kT)] / exp[ε1 / (kT)]
C. exp[-(ε2-ε1) / (kT)]
D. exp[-ε2 / (kT)] / exp[-ε1 / (kT)]
7. 25℃下,压力为100 kPa的2 m3气体反抗恒外压50 kPa膨胀至内、外压相等为止,此过程中气体对外做功-W=_______________。
8. 恒温、恒压下,由CaCO3(s)、CaO(s)、BaCO3(s)、BaO(s)和CO2(g)构成的多相平衡系统的独立组分数为______________,自由度数为___________。
9. CaCl2溶液的质量摩尔浓度为b,此溶液的离子平均质量摩尔浓度b±=_________。
10. 25℃下进行反应2 A ─→B 的速率常数为k,采用催化剂S后,反应速率可提高到10 k。
同温度下,反应B─→ 2 A的速率常数为0.1 s-1,采用催化剂S后,此反应的速率常数k’= _______________。
二.(20分)在100 kPa下将1 mol He(g)从100℃加热到200℃,计算此过程的Q、W、ΔU、ΔS及ΔG。
已知100℃下He(g)的标准摩尔熵为130.2 J·K-1·mol-1,He(g)可看作理想气体。
三.(20分)将NH4HS(s)放入抽空的容器中,25℃下分解为NH3(g)和H2S(g)。
平衡时容器内的压力为66.8kPa。
若放入NH4HS(s)时容器中已有40.0 kPa的H2S(g),计算25℃下平衡时容器中气体的压力。
四.(20分)苯的正常沸点为80℃,气化焓为393 J/g。
计算25℃时苯的蒸气压及26.7 kPa下苯的沸点。
五.(20分)将反应Hg2Cl2(s) + H2[p(H2)] == 2 Hg(l) + 2 HCl[b(HCl)] 设计成电池(写出电池表示式)。
若p(H2)=101.3 kPa,b(HCl)=0.1 mol/kg时,测得进行该反应的电池电动势与绝对温度T呈直线关系,直线斜率为1.88×10-3 V/K,截距为0.0694 V,计算25℃时所设计电池的电动势及电池反应的Δr H m、Δr S m和Δr G m。
六.(20分)乙酸甲酯和碱的皂化反应
CH3COOCH3 + NaOH == CH3COONa + CH3OH
对碱和酯分别为一级。
298 K下,用等体积、同浓度(0.02 mol·dm-3)的酯溶液与碱溶液相混,反应5 min后测得溶液中碱的浓度为6.34×10-3 mol·dm-3,计算:
(1)反应的速率常数;
(2)反应10 min后,溶液中酯的浓度;
(3)酯的半衰期;
(4)若用浓度均为0.01 mol·dm-3的等体积酯溶液与碱溶液相混进行反应,酯的半衰期。
七.(8分)气相反应:
2 HI ─ H2 + I2
在283℃和300℃下的速率常数分别为 3.50×10-7dm3·mol-1·s-1 和 1.14×10-6 dm3·mol-1·s-1。
计算此反应的活化能。
八.(12分)20℃下水的表面张力为72.75 mN·m-1,密度为103 kg·m-3。
若在0℃~ 100 ℃范围内可将水的蒸发热看作常数,Δvap H m = 40.67 kJ/mol,计算20℃时,半径为10-7 cm水滴的饱和蒸气压。