青岛科技大学考研真题-物理化学2010
- 格式:doc
- 大小:106.00 KB
- 文档页数:3
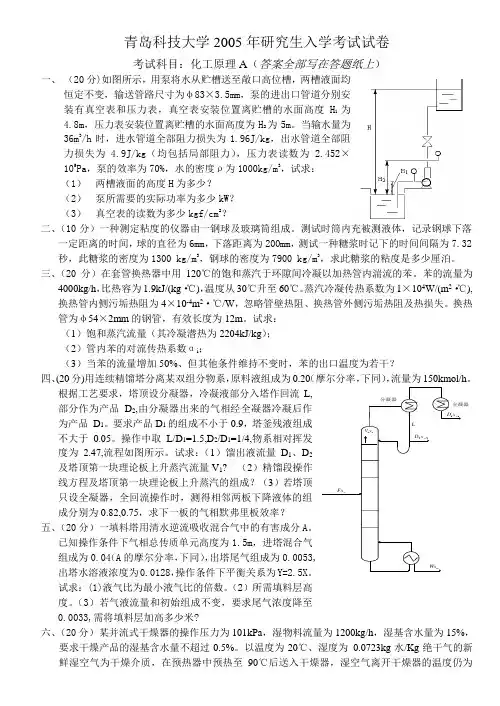
青岛科技大学2005年研究生入学考试试卷考试科目:化工原理A (答案全部写在答题纸上)一、 (20分)如图所示,用泵将水从贮槽送至敞口高位槽,两槽液面均恒定不变,输送管路尺寸为φ83×3.5mm ,泵的进出口管道分别安装有真空表和压力表,真空表安装位置离贮槽的水面高度H 1为4.8m ,压力表安装位置离贮槽的水面高度为H 2为5m 。
当输水量为36m 3/h 时,进水管道全部阻力损失为1.96J/kg ,出水管道全部阻力损失为 4.9J/kg (均包括局部阻力),压力表读数为 2.452×105Pa ,泵的效率为70%,水的密度ρ为1000kg/m 3,试求:(1) 两槽液面的高度H 为多少?(2) 泵所需要的实际功率为多少kW ?(3) 真空表的读数为多少kgf/cm 2?二、(10分)一种测定粘度的仪器由一钢球及玻璃筒组成。
测试时筒内充被测液体,记录钢球下落一定距离的时间,球的直径为6mm ,下落距离为200mm ,测试一种糖浆时记下的时间间隔为7.32秒,此糖浆的密度为1300 kg/m 3,钢球的密度为7900 kg/m 3,求此糖浆的粘度是多少厘泊。
三、(20分)在套管换热器中用120℃的饱和蒸汽于环隙间冷凝以加热管内湍流的苯。
苯的流量为4000kg/h ,比热容为1.9kJ/(kg ·℃),温度从30℃升至60℃。
蒸汽冷凝传热系数为1×104W/(m 2·℃),换热管内侧污垢热阻为4×10-4m 2·℃/W ,忽略管壁热阻、换热管外侧污垢热阻及热损失。
换热管为φ54×2mm 的钢管,有效长度为12m 。
试求:(1)饱和蒸汽流量(其冷凝潜热为2204kJ/kg );(2)管内苯的对流传热系数αi ;(3)当苯的流量增加50%、但其他条件维持不变时,苯的出口温度为若干?四、(20分)用连续精馏塔分离某双组分物系,原料液组成为0.20(摩尔分率,下同),流量为150kmol/h 。

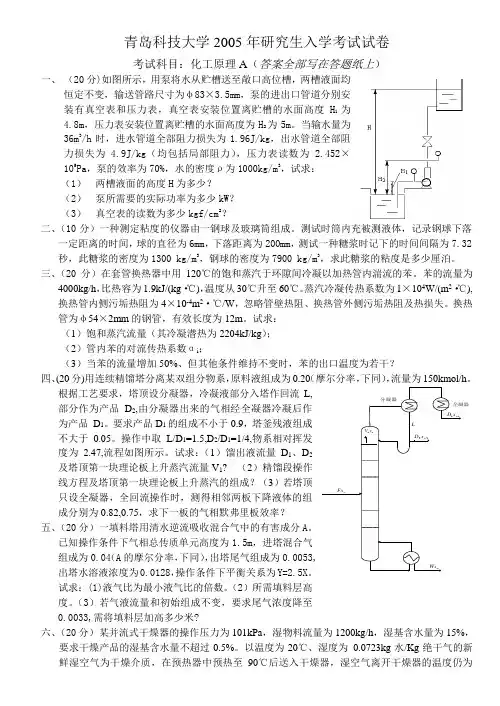
青岛科技大学2005年研究生入学考试试卷考试科目:化工原理A (答案全部写在答题纸上)一、 (20分)如图所示,用泵将水从贮槽送至敞口高位槽,两槽液面均恒定不变,输送管路尺寸为φ83×3.5mm ,泵的进出口管道分别安装有真空表和压力表,真空表安装位置离贮槽的水面高度H 1为4.8m ,压力表安装位置离贮槽的水面高度为H 2为5m 。
当输水量为36m 3/h 时,进水管道全部阻力损失为1.96J/kg ,出水管道全部阻力损失为 4.9J/kg (均包括局部阻力),压力表读数为 2.452×105Pa ,泵的效率为70%,水的密度ρ为1000kg/m 3,试求:(1) 两槽液面的高度H 为多少?(2) 泵所需要的实际功率为多少kW ?(3) 真空表的读数为多少kgf/cm 2?二、(10分)一种测定粘度的仪器由一钢球及玻璃筒组成。
测试时筒内充被测液体,记录钢球下落一定距离的时间,球的直径为6mm ,下落距离为200mm ,测试一种糖浆时记下的时间间隔为7.32秒,此糖浆的密度为1300 kg/m 3,钢球的密度为7900 kg/m 3,求此糖浆的粘度是多少厘泊。
三、(20分)在套管换热器中用120℃的饱和蒸汽于环隙间冷凝以加热管内湍流的苯。
苯的流量为4000kg/h ,比热容为1.9kJ/(kg ·℃),温度从30℃升至60℃。
蒸汽冷凝传热系数为1×104W/(m 2·℃),换热管内侧污垢热阻为4×10-4m 2·℃/W ,忽略管壁热阻、换热管外侧污垢热阻及热损失。
换热管为φ54×2mm 的钢管,有效长度为12m 。
试求:(1)饱和蒸汽流量(其冷凝潜热为2204kJ/kg );(2)管内苯的对流传热系数αi ;(3)当苯的流量增加50%、但其他条件维持不变时,苯的出口温度为若干?四、(20分)用连续精馏塔分离某双组分物系,原料液组成为0.20(摩尔分率,下同),流量为150kmol/h 。


青岛科技大学物理化学试题之一第一套一、填空题(每小题2分,共20分)1、系统处于热力学平衡状态时,必须同时满足、、、四个条件平衡。
2、同一个系统的U、H、A、G这四个热力学量,最大,最小。
3、补全热力学函数关系式:dG= + VdP ;(∂G/∂p)T = 。
4、理想气体与温度为T的大热源接触作等温膨胀,吸热Q,所做的功是变化到相同终态的最大功的20%,则系统的熵变为(用T和Q表示)。
5、等温等压下两种纯物质混合形成理想溶液,则△mix V 0,△mix H 0,△mix S 0,△mix G 0(填“>”或“<”或“=”)。
6、非理想气体的标准态是指:。
7、热分析法绘制相图时,常需画出不同组成混合物的温度-时间曲线,这种线称之为。
8、写出化学反应等温式:。
9、反应C(s)+O2(g)=CO2(g),2 CO(g) +O2(g)= 2CO2(g),C(s)+ 1/2 O2(g)=CO(g)的平衡常数分别为K1Θ、K2Θ、K3Θ,这三个平衡常数之间的关系是K3Θ= 。
10、298K时有一仅能透过水的渗透膜将0.01mol/L和0.001mol/L的蔗糖溶液分开,欲使该体系达平衡,需在浓度为的溶液上方施加压力,该压力为Pa。
二、选择题(每小题2分,共30分)1、下列说法不符合近代化学的发展趋势与特点的是()(A)从单一学科到交叉学科(B)从宏观到微观(C)从平衡态研究到非平衡态研究(D)从表相到体相2、下列关于热力学方法的叙述,不正确的是()(A)热力学研究对象是大量分子的集合,所得的结论不适用于分子的个体行为。
(B)热力学可以解决怎样把一个变化的可能性变为现实性的问题(C)经典热力学不考虑物质的微观结构和反应机理(D)经典热力学不能解决一个具体变化所需要的时间3、下列参数中属于过程量的是()(A)H (B)U (C)W (D)V4、实际气体处于下列哪种情况时,其行为与理想气体接近()(A)高温高压(B)高温低压(C)低温高压(D)低温低压5、在一个刚性绝热容器内发生苯在氧气中燃烧的反应()(A) △U=0,△H<0,Q=0 (B) △U=0,△H>0,W=0(C) △U=0,△H=0,Q=0 (D) △U=0,△H=0,W=06、关于Joule-Thomson系数μJ-T,下列说法错误的是()(A)μJ-T是系统的强度性质(B)μJ-T<0,表示节流膨胀后气体的温度下降(C)常温下,大多数气体的μJ-T为正值,而H2和He的μJ-T为负值(D)理想气体的μJ-T = 07、工作在393K和293K的两个大热源间的卡诺热机,其效率约为()(A) 83%(B) 25%(C) 100%(D) 20%8、当10mol N2和20mol H2混合通过合成氨塔,反应一段时间后有5mol NH3生成。





6.的组分________(填先或后)流出色谱柱。
二、选择题(每题1.5分,共36分)1. 欲配制As2O3标准溶液以标定0.02 mol/L KMnO4溶液,如要使标定时两种溶液消耗的体积大致相等,则As2O3溶液的浓度约为-------------------------------------------------------------( )(A) 0.016 mol/L (B) 0.025 mol/L (C) 0.032 mol/L (D) 0.050 mol/L2. 用HCl标液测定硼砂(Na2B4O7·10H2O)试剂的纯度有时会出现含量超过100%的情况,其原因是--------------------------------------------------------------------------------------------------( )(A) 试剂不纯 (B) 试剂吸水 (C) 试剂失水 (D) 试剂不稳,吸收杂质第 2 页(共 6 页)----------------------( )(A) 一氯乙酸(p K a = 2.86) (B) 氨水(p K b = 4.74)(C) 六次甲基四胺(p K b = 8.85) (D) 甲酸(p K a = 3.74)9. 用NaOH标准溶液滴定一元弱酸时,若弱酸和NaOH的浓度都比原来增大十倍,则滴定曲线中--------------------------------------------------------------------------------------------------( )(A) 化学计量点前后0.1%的pH均增大(B) 化学计量点前后0.1%的pH均减小(C) 化学计量点前0.1%的pH不变,后0.1%的pH增大(D) 化学计量点前0.1%的pH减小,后0.1%的pH增大10. 下列溶液用酸碱滴定法能准确滴定的是-----------------------------------------------------( )(A) 0.1 mol/L HF (p K a = 3.18)(B) 0.1 mol/L HCN (p K a = 9.21)(C) 0.1 mol/L NaAc [p K a(HAc) = 4.74](D) 0.1 mol/L NH4Cl [p K b(NH3) = 4.75]11. 现有一含H3PO4和NaH2PO4的溶液,用NaOH标准溶液滴定至甲基橙变色, 滴定体积为a(mL)。

青岛科技大学2010年硕士研究生入学考试参考书目考试科目考试范围241日语《新编日语》(1-4册)周平、陈小芳主编上海外语教育出版社2006242德语A 《新求精德语强化教程》(第二版)(初、中级)同济大学留德预备部主编同济大学出版社2003243法语《简明法语教程》(上、下册)孙辉主编商务印书馆1990244俄语《俄语》(修订版)(3-4册)黑龙江大学俄语系外语教学与研究出版社1996 245德语B《新标准德语强化教程(中级)》外语教学与研究出版社2006408计算机学科专业基础综合全国统考,考试内容包括:数据结构、计算机组成原理、操作系统和计算机网络620分析化学《基础化学教程》付洵主编科学出版社2007;《仪器分析》(第三版)朱明华主编高教出版社2000621有机化学《系统有机化学》杨丰科主编化学工业出版社2003 622无机化学《基础化学教程》付洵主编科学出版社2007623药剂学综合《分析化学》(五版)李发美人民卫生出版社;《药剂学》(四版)毕殿洲人民卫生出版社;《药剂学》(五版)崔福德人民卫生出版社;《药物分析》刘文英人民卫生出版社624药物化学综合《系统有机化学》杨丰科化学工业出版社2003;《药物化学》郑虎人民卫生出版社2006《分析化学》(药)尤启冬化学工业出版社2004625海洋化学《海洋化学》张正彬中国海洋大学出版社2004630基础英语《高级英语》(1、2册)张汉熙主编外语教学与研究出版社2000 640数学分析《数学分析》(上、下)欧阳光中主编高教出版社2007650中外美术史A 《中国美术简史》中央美术学院编高等教育出版社;《外国美术简史》中央美术学院编高等教育出版社651中外美术史B《中国美术简史》《外国美术简史》中央美术学院编高等教育出版社666马克思主义哲学原理《马克思主义哲学原理》肖前主编中国人民大学出版社2007671情报学基础《情报学基础教程》叶鹰,潘有能,潘卫编著科学出版社2006年;《计算机情报检索》(第2版)赖茂生等编著北京大学出版社2006年810材料科学基础《材料科学基础》刘志恩主编西北工业大学出版社2000 811环境化学《环境化学》戴树桂主编高教出版社2006.10812环境学《环境学原理》陈立人科学出版社2003年1版820物理化学《物理化学》王光信等编化学工业出版社2001821高分子化学与物理《高分子化学》第四版潘祖仁主编化学工业出版社《高分子物理》(修订版)何曼君、陈维孝、董西侠主编复旦大学出版社823传热学《传热学》杨世铭高等教育出版社2006 824汽车理论《汽车理论》余志生清华大学出版社2006825材料力学《材料力学》刘鸿文主编高教出版社2004826机械设计《机械设计》濮良贵主编高教出版社2007827金属学与热处理《金属学与热处理》崔忠圻主编机械工业出版社2007828工程热力学《工程热力学》沈维道高教出版社2005;《工程热力学》陈贵堂编北京理工大学出版社2008;《工程热力学》华自强编高教出版社2001829工程力学《工程力学》《理论力学》王永岩主编科学出版社2007831控制原理《自动控制原理》(第四版)胡寿松科学出版社832电路《电路》(第五版)邱关源编高等教育出版社835化工原理《化工原理》夏青等主编天津大学出版社2005836生物化学《生物化学教程》(第三版)张洪渊主编四川大学出版社2003 837发酵工艺学《发酵工艺原理》熊宗贵主编中国医药科技出版社2005838生物催化与生物转化《生物催化的手性合成》张玉彬主编化学工业出版社2002839植物纤维化学《植物纤维化学》(第三版)杨淑蕙主编中国轻工业出版社2001 840管理学原理《管理学——原理与方法》周三多主编复旦大学出版社2006 841西方经济学《西方经济学》高鸿业主编中国人民大学出版社2007850综合考试《语言学教程》(修订版)胡壮麟主编北京大学出版社2001 《新编英汉翻译教程》孙致礼主编上海教育出版社2003860高等代数《高等代数》王萼方、石声明高教出版社2003870水污染控制工程《水污染控制工程》(下册)高延耀高等教育出版社2007871大气污染控制工程《大气污染控制工程》(第二版)郝吉明高等教育出版社2002 872安全系统工程《安全系统工程》汪元辉编天津大学出版社2006.10873化工单元运行安全技术《化工单元运行安全技术》崔克清化学工业出版社2006.3876美术理论《中国美学史》王振复复旦大学出版社2004.3;《西方美学史》朱光潜人民文学出版社1975.5;《美术概论》王宏建、袁宝林主编高等教育出版社880思想政治教育学原理《思想政治教育学原理》陈万柏,张耀灿高等教育出版社2007911微机原理与接口技术《微型计算机原理及应用》(第三版)郑学坚,周斌编著清华大学出版社。
考生答题须知1.所有题目(包括填空、选择、图表等类型题目)答题答案必须做在考点发给的答题纸上,做在本试题册上无效。
请考生务必在答题纸上写清题号。
2.评卷时不评阅本试题册,答题如有做在本试题册上而影响成绩的,后果由考生自己负责。
3.答题时一律使用蓝、黑色墨水笔或圆珠笔作答(画图可用铅笔),用其它笔答题不给分。
4.答题时不准使用涂改液等具有明显标记的涂改用品。
一.选择与填充题(每题2分,共30分)1. 物质的量为n的理想气体,其(әH/әp)T = ,C p,m-C V,m = 。
2. 1 mol理想气体由300 K、1 MPa向真空膨胀至0.1 MPa,此过程的ΔS系统0、ΔS 总0。
(填>、<或=)3.某温度下,理想气体反应PCl5 (g) =PCl3 (g) + Cl2 (g)达到平衡时,PCl5的离解度为α1。
若等压下通入N2,PCl5的离解度为α2,则α1α2;若等容下通入N2,PCl5的离解度为α3,则α1α3。
4. 影响实际气体反应标准平衡常数pK的物理量是。
A. 系统总压B. 温度C. 催化剂D. 惰性气体的量5. 分子能级的简并度g与各种运动形式的能级简并度g t、g v、g r、g e、g n之间的关系是。
6. 公式Θv=hν / k中Θv为。
A. 玻尔兹曼常数B. 阿伏伽德罗常数C. 振动特征温度D.配分函数7. 某系统中存在如下三个反应,且均已达到平衡:NiO(s)+CO(g) = Ni(s)+CO2(g)H2O(l)+CO(g)= H2(g)+CO2(g)NiO(s)+H2(g) = H2O(l)+Ni(s)此系统的独立反应数R =,自由度数f =。
A . 3 B. 2 C. 1 D. 08. 将溶质A和B分别溶于水中形成稀溶液,凝固时均析出冰,且A溶液的凝固点低于B溶液的凝固点,则A 溶液的渗透压。
A. 一定高于B溶液的渗透压B. 一定低于B溶液的渗透压C. 一定等于B溶液的渗透压D. 一定等于水的渗透压9. 已知25℃下E (Cd2+ | Cd) = - 0.403 V,氢在Cd上的超电势η= 0.414 V,若25℃,100k Pa下以Cd为阴极电解CdSO4 (a =1) 的酸性溶液(H 1a+=),则阴极上。
资料收集于网络,如有侵权请联系网站删除一.判断题(10分,每题1分):1.反应进度与选用何种物质计算有关,和反应方程式的写法无关。
()2.热力学第二定律规定,在绝对零度时,任何理想晶体的嫡值为零。
()3.在等温、等压的封闭体系内,不做非体积功的前提下,任何趋向于能量降低、混乱度增大的反应都能够自发进行。
()4.在一定温度下,一定体积的容器中放入一定量的NH4C1发生分解反应:NH4Cl(s)=NH3(g) + HCl(g),加入惰性气体会增大总压,因此根据道尔顿分压定律体系中各气体的分压也将增大。
()5.反应速率常数不只受反应温度的影响,也受催化剂的影响,但和反应物的浓度无关。
()6.在酸碱滴定中使用的双指示剂法就是将两种指示剂配制成一份使用,利用指示剂颜色之间的互补作用,使滴定终点时的颜色变化更加敏锐。
()7.因为BaSO4的K s?比BaCO4的K sP小,所以不能通过与NaCO3溶液作用将BaSO4 转化为BaCO4。
()8.测定力^的原电池符号可以写成:(-)Zn Zn2+(O.l moi L4) H+(0.1 mol L") H2 (101.325 kPa), Pt(+)()9.因为中C l /Cl-=1.36 V,591Vl e 2+=1.23 V ,由此说明MnO2不能氧化HCl而生成Ci 2/Ci ivinO 2 / MnCl2。
()10.氧化还原指示剂本身也可以发生氧化还原反应,且其氧化型和还原型的颜色明显不同。
例如,在间接碘法中使用的可溶性淀粉就是这种类型。
() 二.填空题(30分,每空1分):1.已知AgBr的标准摩尔生成夕含为-100.4 kJ mol 1,请用热化学反应方程式表示298.15K , 标准状态下AgBr (s) 的生成反应。
一,.一、. _ ___ _ _ ,..。
-12.已知反应1.C (石墨,s) + O2 (g) = CO 2 (g) Ar H m (2)= 293.5 kJ mol一一一一. ...A-12.CO(g) + 1/2O2(g) = CO2(g) ArH m (3)= N83.0kJ mol求反应C (石墨,s) + 1/2 O2 (g) = CO (g)的 A H mm =3.化学反应速率的大小,首先取决于反应物的本性,除此之外,反应速率还与反应物的,与等因素有关。
m <0m >0, p 应1p <,且随温度升高而增大 B . 1p <,且随温度升高而减小1p >,且随度升高而增大1p >,且随温度升高而减小℃下A 、B 两种气体在同一溶剂中的亨利常数分别为k A 气体的蒸汽压相同时,溶液中 22
k k C - 1,1,A A
k k k B -−−第
C . 1,2A
k A B −−→, 2k B C D +−−→ D . 1,2
1,22A A
k k k A
B C -−−→
8.在统计热力学中,根据粒子间的相互作用可否忽略将统计系统分为 和 系统,根据粒子的运动特点将统计系统分为 和 系统,非理想气体 是 子系统。
9.理想气体反应PCl 5 (g) = PCl 3 (g)+Cl 2 (g) 的187.9r m H kJ mol -∆=,,()0B p m B
C B ν≈∑,要提高
PCl 5 (g)的解离度,可采取的措施是 。
A .降温
B . 加压
C . 降温和加压
D .升温和减压 10.对独立子系统,在各种运动形式的配分函数中,与压力有关的是 。
A. 平动配分函数
B.转动配分函数 C . 振动配分函数 D.电子配分函数
二.(20分)
101 kPa 下,将1g 、0℃的冰投入到10g 沸水中,冰立即熔化。
计算该过程的Q 、W 、ΔU 、ΔH 、ΔS ,并说明此过程为自发自发过程。
已知在此条件下,冰的熔化焓为6025J·mol -
1 ,水的平均等压摩尔热容为75.29J ·mol -1·K -1
, 水的摩尔质量为18.01g ·mol -1。
三.(20分)
NH 4Cl(s)受热分解:
NH 4Cl(s) = NH 3 (g ) + HCl(g)
实验测得加热NH 4Cl(s)至700K 和732K 时,其蒸气压分别为607.94 kPa 和1114.56 kPa 。
(1)计算上述两温度下NH 4Cl(s)分解反应的标准平衡常数。
(2)假设NH 4Cl(s)分解反应的△r C P ,m ≈ 0 , 计算NH 4Cl(s)分解反应的r m H ∆和r m S ∆。
(3)300K 下,30.001NH HCl p p kPa ==, 能否生成NH 4Cl(s) ? 说明理由。
.四. (22分)
A 与
B 二组分液态完全互溶,固态完全不互溶,
其低共溶混合物中B 的质量分数为60%,101.3kPa 下A-B 二组分相图如右图所示。
(1)指出相图中1、2、3 区 及E 点的相及自 由度;
(2)画出图上a 点所示系统的步冷曲,并说明 各转折点的相态变化。
(3) 冷却B 的质量分数为40%的A-B 二组分液
第 2 页(共 3 页)
t /℃
1
2)kg H -|2(E Pb
V , 2PbCl 1
kg -,计算298 K 下该电池的电动势及电池反应的摩尔吉布斯函数变。
1) 苯的正常沸点为80.133.9m =。
若20℃下苯蒸气凝结成半径为。