中药制剂提取车间批生产记录模版精编版
- 格式:doc
- 大小:359.50 KB
- 文档页数:16
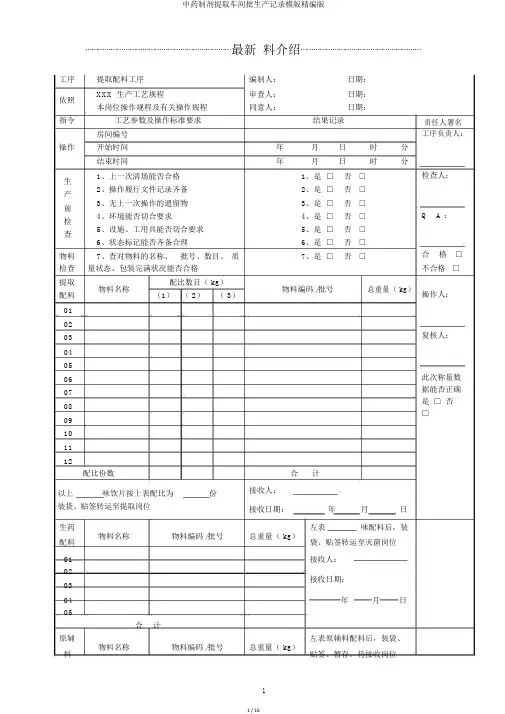
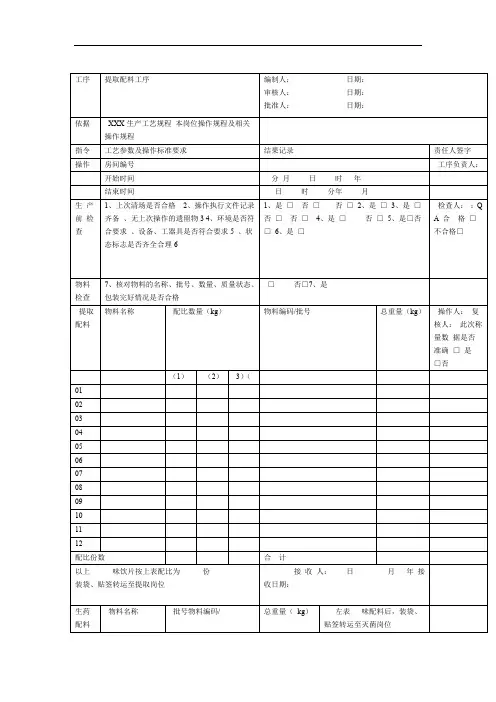
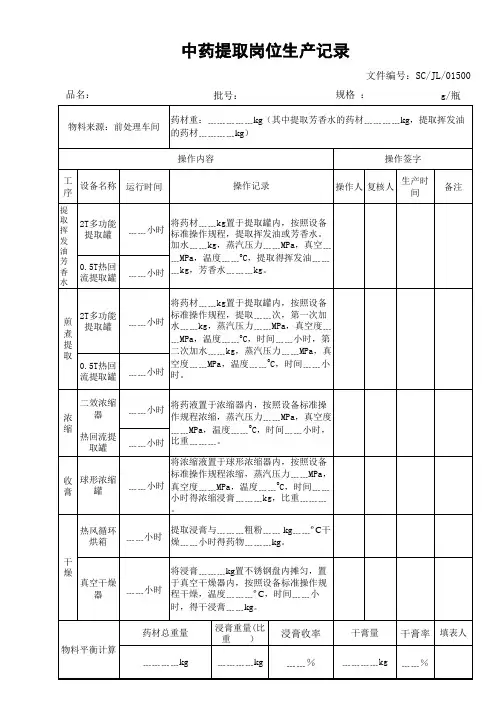
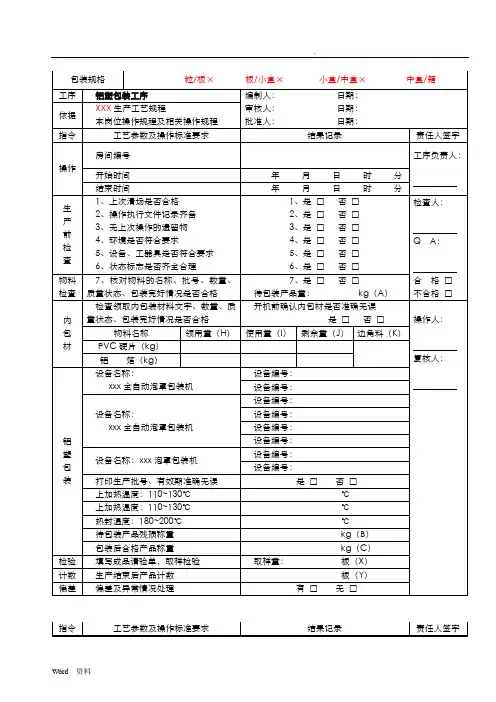
⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯工序提取配料工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格提取物料名称配比数目( kg)物料编码 /批号总重量( kg)配料(1)( 2)( 3)010203040506070809101112配比份数合计以上味饮片按上表配比为份接收人:装袋、贴签转运至提取岗位接收日期:年月日生药物料名称物料编码 /批号总重量( kg)左表味配料后,装配料袋、贴签转运至灭菌岗位01 接收人:02接收日期:0304 年月日05合计原辅左表原辅料配料后,装袋、责任人署名工序负责人:检查人:Q A :合格□不合格□操作人:复核人:此次称量数据能否正确是□ 否□⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯01 使用02 接收人:03接收日期:0405 年月日合计指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A :场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□领料单粘贴处:工序水提工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格提取设施名称:QA 确认本罐投料能否正确无误并署名( X )设施编号:是□否□投饮片名称投料量( kg )饮片名称投料量( kg)料量误差误差及异样状况办理有□无□控制温度: 95~100℃℃蒸汽压力:Mpa第一次加水量:投料量的X 倍kg浸泡时间: X 小时日时分 ~ 日第一次升温时间日时分 ~ 日第一次提取时间: X 小时日时分 ~ 日第二次加水量:投料量的X 倍kg第二次升温时间日时分 ~ 日第二次提取时间: X 小时日时分 ~ 日第三次加水量:投料量的X 倍kg第三次升温时间日时分 ~ 日第三次提取时间: X 小时日时分 ~ 日检查人:Q A:合格□不合格□操作人:复核人:Q A:时分时分时分时分时分时分时分指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A :场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序浓缩工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号YB-TQ-020 工序负责人:操作开始时间年月日时分结束时间年月日时分检查人:生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□Q A:前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□合格□不合格□设施名称:设施编号:设施编号:操作人:蒸汽压力:Mpa浓一效浓缩温度: 80± 2℃℃一效真空度:Mpa 复核人:缩二效浓缩温度: 70± 2℃℃二效真空度:Mpa浓缩相对密度:( 00℃)(℃)浓缩后称重kg误差误差及异样状况办理有□无□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序醇提工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格提取设施名称:QA 确认本罐投料能否正确无误并署名设施编号:是□否□投饮片名称投料量( kg )饮片名称投料量( kg)料量误差误差及异样状况办理有□无□控制温度: 80~85℃℃蒸汽压力:Mpa乙醇使用记录物料编码 /批号领用量使用量节余量乙醇( kg)回收乙醇( kg)第一次加醇 (00%) 量:投料量的X 倍kg 乙醇浓度:第一次升温时间日时分 ~ 日第一次提取时间:X 小时日时分 ~ 日第二次加醇 (00%) 量:投料量的X 倍kg 乙醇浓度:第二次升温时间日时分 ~ 日第二次提取时间:X 小时日时分 ~ 日第三次加醇 (00%) 量:投料量的X 倍kg 乙醇浓度:第三次升温时间日时分 ~ 日第三次提取时间:X 小时日时分 ~ 日检查人:Q A:合格□不合格□操作人:复核人:Q A:%时分时分%时分时分%时分时分指令工艺参数及操作标准要求结果记录1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时结束时间日时责任人署名清场人:Q A :分合格□分不合格□⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯工序醇沉工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□检查人:2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□Q A:检5、设施、工用具能否切合要求5、是□否□查⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格清膏重量:kg设施名称:设施编号:醇设施编号:加入乙醇,使含醇量达到00% 含醇量:%沉静置时间: X 小时日时分至日时分误差误差及异样状况办理有□无□乙醇使用记录物料编码 /批号领用量使用量节余量乙醇( kg)回收乙醇( kg)1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分结束时间日时分工序回收乙醇浓缩工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□设施名称: XXXXX 合格□不合格□操作人:复核人:清场人:Q A:合格□不合格□责任人署名工序负责人:检查人:Q A:合格□不合格□乙回收乙醇订制批号批号:醇回收乙醇量kg浓折算浓度( 20℃)%( 20℃)复核人:缩蒸汽压力:Mpa浓缩温度: 80± 2℃℃真空度:Mpa浓缩相对密度:( 00℃)(℃)浓缩后称重kg误差误差及异样状况办理有□无□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序灭菌干燥工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□检查人:2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□Q A:检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□合格□检查量状态、包装完满状况能否合格不合格□生药设施名称:QA 确认灭菌投料能否正确无误并署名灭菌设施编号:是□否□操作人:投饮片名称投料量( kg)饮片名称投料量( kg)量复核人:共计误差误差及异样状况办理有□无□蒸汽压力:Mpa Q A:灭菌温度: 115± 2℃℃每锅灭菌时间: 0.5 小时灭菌锅次:锅灭菌时间日时分~ 日时分设施名称:设施编号:设施编号:真空度:Mpa Mpa干干燥温度: 80± 2℃℃℃每锅次干燥时间: 3~4 小时锅次锅次燥干燥时间日时分日时分至日时分至日时分干燥后称重kg( A )灭菌前饮片总重量:kg (B )收A率收率( %)= = %B限度≥ 98.0% 符合□不切合□指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□工序生药粉碎工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格饮片总重量:kg( A )生药设施名称:粉碎机组设施编号:粉碎设施名称:低温涡流粉碎机组设施编号:误差误差及异样状况办理有□无□检查筛网能否正确、完满是□否□粉碎细度: 000 目目粉碎后称重kg( B )收B收率( %)==%率A责任人署名工序负责人:检查人:Q A:合格□不合格□操作人:复核人:限度≥ 98.0%符合□不切合□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□Q A:4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分合格□结束时间日时分不合格□工序混淆工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□检查人:产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□Q A:查6、状态标记能否齐备合理6、是□否□7、查对物料的名称、批号、数目、质7、是□否□物料量状态、包装完满状况能否合格稠膏重量:kg 合格□检查生粉重量:kg 不合格□设施名称:设施编号:混淆设施名称:设施编号:操作人:将领取物料均匀分派后加入混淆机中每次混淆时间: XX 分钟稠膏( kg)生粉( kg)混淆时间1 时分至时分复核人:2 时分至时分3 时分至时分4 时分至时分5 时分至时分6 时分至时分误差误差及异样状况办理有□无□1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分结束时间日时分工序微波干燥工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时结束时间年月日时生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格微波设施名称:干燥温度: 80±2℃干燥设施编号干燥温度干燥次数盘数干燥时间: 1 小时/次1 ℃时分至时2 ℃时分至时3 ℃时分至时4 ℃时分至时5 ℃时分至时误差误差及异样状况办理有□无□干燥后称重kg( A )提取投料总量:kg( B)混淆生粉总量:kg( C)收A -C清场人:Q A:合格□不合格□责任人署名工序负责人:分分检查人:Q A:合格□不合格□操作人:分分分复核人:分分率收率( %)==%B限度: (00±00)%符合□不切合□1、消除生产中产生的荒弃物1、是□否□2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分结束时间日时分工序干膏粉碎工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录房间编号操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□查6、状态标记能否齐备合理6、是□否□物料7、查对物料的名称、批号、数目、质7、是□否□检查量状态、包装完满状况能否合格干膏重量:kg( A )生药设施名称:设施编号:粉碎设施编号:误差误差及异样状况办理有□无□检查筛网能否正确、完满是□否□粉碎细度: 000 目目粉碎后称重kg( B )收B收率( %)==%率A 清场人:Q A:合格□不合格□责任人署名工序负责人:检查人:Q A:合格□不合格□操作人:复核人:限度≥ 98.0% 符合□不切合□1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□3、洁净称量衡器、容用具3、是□否□清4、是□Q A:4、洁净生产地区否□5、采集整理生产文件5、是□否□场QA 确认6、是□6、贴挂状态标记,并经否□开始时间日时分合格□结束时间日时分不合格□工序批混工序编制人:日期:依照XXX 生产工艺规程审查人:日期:本岗位操作规程及有关操作规程同意人:日期:指令工艺参数及操作标准要求结果记录责任人署名房间编号工序负责人:操作开始时间年月日时分结束时间年月日时分生1、上一次清场能否合格1、是□否□2、操作履行文件记录齐备2、是□否□检查人:产3、无上一次操作的遗留物3、是□否□前4、环境能否切合要求4、是□否□检5、设施、工用具能否切合要求5、是□否□Q A:查6、状态标记能否齐备合理6、是□否□7、查对物料的名称、批号、数目、质7、是□否□物料量状态、包装完满状况能否合格药粉重量:kg 合格□检查不合格□设施名称:设施编号:操作人:批混混淆时间: XX 分钟时分至时分批混前物料总量kg( A )批混后称重kg( B )复核人:查验填写中间产品请验单,取样查验取样量:g误差误差及异样状况办理有□无□B收收率( %)==%A率限度≥ 99.0% 符合□不切合□移交人:交药粉重量:kg岗位同中间站进行物料交接接收人:接件数:件指令工艺参数及操作标准要求结果记录责任人署名1、消除生产中产生的荒弃物1、是□否□清场人:2、洁净生产所用设施2、是□否□清3、洁净称量衡器、容用具3、是□否□4、洁净生产地区4、是□否□Q A:场5、采集整理生产文件5、是□否□6、贴挂状态标记,并经QA 确认6、是□否□开始时间日时分合格□结束时间日时分不合格□请验单粘贴处:。
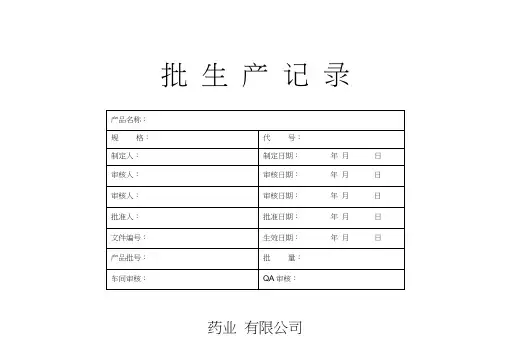
批生产记录
药业有限公司
页号:3/2
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
页号:2/2品名:胶囊文件编号:
备注:
充填中间控制记录
充填中间控制记录
充填中间控制记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
内包装中间控制记录
页号:1/2
内包装中间控制记录
页号:1/2
页号:1/3
页号:2/3
批生产记录
页号:3/3
外包装中间控制记录
页号:1/2
执行外包装S O P(每30箱取2盒检查一次喷码内容、板装半成品、说明书完好、清洁情况)
备注:
外包装中间控制记录
页号:2/2
执行外包装S O P(每30箱取2盒检查一次喷码内容、板装半成品、说明书完好、清洁情况)
备注:
变更记载。

中药饮片批生产记录一、基本信息1.产品名称:XXX中药饮片2.生产批号:XXX-2024XXX3.生产日期:2024年XX月XX日4.生产线号:XXX二、原料准备1.原料名称:XXXX(按照普通名称、拼音首字母排序,加入合适的说明)。
2.原料品牌:XXX(生产商名称),批号:XXX3.用量:按照处方和配方要求,准确称量。
4.检查:检查原料外观,气味、湿度、杂质等,并在记录中注明合格与否。
5.清洗:如有需要,对原料进行清洗处理,保证无杂质。
三、生产过程1.设备清洁:确认生产设备已经清洁干净,符合卫生要求。
2.操作员:XXX3.操作步骤:(1)根据工艺流程,准备生产所需的器具和设备。
(2)按照生产配方,将称好的原料依次放入料斗中。
(3)启动搅拌机,根据工艺要求进行搅拌,搅拌时间、速度和转速等需要记录。
(4)运送:将搅拌好的料移送至下一个工序。
4.温度、湿度记录:记录生产过程中的温度和湿度,确保符合工艺要求。
四、包装和贮存1.包装要求:根据产品要求选择包装材料并包装好。
2.包装记录:记录包装过程中的产品批号、包装材料、操作人员等信息。
3.贮存要求:按照产品要求的环境条件进行贮存。
五、清洁、消毒和废弃物处理1.清洁:生产设备的清洁,如搅拌机等。
2.消毒:根据产品特性和卫生要求,做好设备的消毒处理。
3.废弃物处理:按照相关规定妥善处理生产过程中产生的废弃物。
六、记录与复核1.生产记录:记录生产过程中的详细操作步骤、温度湿度、称量、检查结果等信息。
2.复核记录:复核记录的人员姓名、复核时间、复核结果等信息。
七、备注1.根据实际需要,添加合适的备注信息。
以上是一份中药饮片批生产记录的简要示例,生产记录的内容应根据具体情况进行调整和补充。
同时,为了确保生产质量,生产过程中还需要严格遵守相关的操作规范和卫生要求。

中药制剂提取车间批生产记录模版产品名称:(填写产品名称)批号:(填写产品批号)生产日期:(填写生产日期)生产车间:(填写车间名称)一、提取工艺记录1.原辅料清单(列出所用原辅料名称、规格、批号、发货日期等信息)2.配方记录(列出各原辅料用量、提取工艺步骤、提取剂用量等信息)3.人员操作记录(记录提取过程中参与操作的人员、操作时间、操作内容等信息)4.设备使用记录(记录使用的设备名称、规格、操作时间、设备状态等信息)5.清洁记录(记录提取设备的清洁情况、清洁时间、清洁剂使用情况等信息)二、醇提工艺记录1.醇提步骤(记录醇提的步骤、温度、时间等信息)2.提取剂使用量记录(记录使用的提取剂名称、用量、操作时间等信息)3.煮沸浸泡记录(记录煮沸浸泡的温度、时间、提取液浓度等信息)4.过滤记录(记录过滤的步骤、过滤器规格、过滤时间等信息)三、浓缩工艺记录1.浓缩步骤(记录浓缩的步骤、温度、时间等信息)2.蒸发器使用记录(记录蒸发器的使用情况、温度、时间、压力、真空度等信息)3.浓缩液浓度检验记录(记录浓缩液的浓度、检验时间、检验人员等信息)四、冷冻干燥工艺记录1.冷冻步骤(记录冷冻的步骤、温度、时间、冻结桶使用情况等信息)2.干燥步骤(记录干燥的步骤、真空度、温度、时间等信息)3.干燥终点检验记录(记录干燥终点的指标、检验时间、检验人员等信息)五、包装记录1.包装物清单(列出所用包装物的名称、规格、批号等信息)2.包装操作记录(记录包装人员、操作时间、操作内容等信息)3.包装质量检验记录(记录包装质量检验的项目、检验时间、检验结果等信息)六、消毒记录(记录车间的消毒情况、消毒剂使用情况、消毒时间等信息)七、备注(填写其他需要备注的事项)以上是中药制剂提取车间批生产记录模版,供参考使用。
实际生产中,需要根据具体的生产工艺和质量要求进行调整和补充。

中药饮片批生产记录批生产记录编号:XXXX日期:XXXX年XX月XX日一、原料准备:1.核对原料清单与实际所需原料,确保原料种类、数量、质量符合要求。
2.按照操作规程,将所需原料净重准确称取。
二、制备药液:1.按照处方要求,将所需原料按比例加入制药用容器中。
2.加入规定量的水,加热至溶解并沸腾。
3.继续煮沸20分钟,使溶液浓缩。
4.关闭加热装置,放置冷却至适宜温度。
三、炮制药液:1.将冷却后的药液过滤,去除杂质。
2.将过滤后的药液放入适宜的容器中。
3.加入规定量的糖浆或其他要求的辅料。
4.将药液加热至适宜温度,持续搅拌均匀。
5.关闭加热装置,放置冷却至适宜温度。
四、制备湿饮片:1.将炮制后的药液缓慢倒入饮片机中。
2.调节饮片机温度、湿度及运行时间,使药液喷雾均匀。
3.饮片干燥后,倒入合适的容器中,密闭保存。
五、制备干饮片:1.将炮制后的药液缓慢倒入饮片机中。
2.调节饮片机温度、湿度及运行时间,使药液快速挥发。
3.挥发后的饮片,通过传送带收集,倒入合适的容器中,密闭保存。
六、包装与质量控制:1.对饮片进行称重,确保每袋饮片的净重符合要求,记录在表格中。
2.开始包装,使用高温杀菌的包装袋,确保饮片的卫生安全。
3.根据产品要求,适当添加防腐剂。
七、清洁与消毒:1.生产设备清洁:对生产过程中所使用的设备进行清洁,包括饮片机、容器、工作台等。
2.员工卫生:员工需洗手并佩戴工作帽、口罩等防护用品。
备注:1.每个操作环节的操作人员、检查人员、批准人员需签名确认。
2.每个操作环节的时间、温度、湿度等关键参数需记录。
3.每个操作环节必须严格按照操作规程操作,不得随意修改或省略操作步骤。
4.如发现异常情况或不良反应,应及时记录并通知质量管理部门进行评估和处理。
生产记录审核人:_______________。

中药制剂提取车间批生产记录模版生产日期:____年____月____日生产批号:____________提取车间操作人员:_______审核人:_______1.原辅材料和设备准备情况:a.原料名称:____________________批号:________________数量:______________________属性:________________b.辅材料名称:____________________批号:________________数量:______________________属性:________________c.设备名称:______________________包装:________________2.提取工艺:a.提取方法:____________________b.提取工艺参数:-温度:___________℃-时间:___________小时-浓度:___________%-比例:___________-其他参数:___________________3.生产操作记录:a.环境条件:-温度:_____________℃-湿度:_____________%b.操作步骤:-仪器设备检查是否正常;-材料配置是否准确,是否有误操作或差错;-提取操作是否按照工艺要求执行;-有无异常情况记录。
4.提取过程监控:a.温度监测情况:(记录每小时)-时间:____:____温度:_______℃b.浓度监测情况:(记录每小时)-时间:____:____浓度:_______%5.精制作业记录:a.精制方法:____________________b.精制工艺参数:-温度:___________℃-时间:___________小时-浓度:___________%-比例:___________-其他参数:___________________6.质量控制记录:a.质量指标:-外观:____________________-气味:____________________-颜色:____________________-出膏率:__________________-含量测定:_______________-其他指标:________________b.检测方法:___________________7.包装及贮存:a.包装方式:___________________b.包装数量:___________________c.贮存条件:___________________d.贮存期限:____年____月____日备注:(列出需要特别说明的事项,如异常情况、仪器设备故障、操作人员变动等)操作人员签字:_______________审核人签字:_________________这是一个中药制剂提取车间批生产记录模板,根据实际情况进行必要的调整和补充。
板蓝根颗粒提取批生产记录、指令单号:产品批号:药材用量:共1味,总计252 Kg浸膏数目:Kg操作日期:年月日至月日汇总人:审查人:**********提取批生产指令指令依照板蓝根颗粒浸膏工艺规程标准依照中国药典(2015年版一部)产品代码产品名称药材总量制剂总量浸膏数目产品批号TQ001板蓝根颗粒浸膏252kg万袋名称物料代码批生产处方量名称物料代码批生产处方量板蓝根YJ004252kg药材用量备注:生产处方量为饮片或净料量,领料量按药材领用量=处方投料量÷炮制得率计。
设施多功能提取罐、提取液储罐、双效节能浓缩器、浓缩液储罐、醇沉罐、球形真空减压浓缩器将称量好的板蓝根净药材投入到多功能提取罐中,要求每罐煎煮两次,第一次加入8倍量水,浸提取6倍量水,煎煮1小时,泡30分钟,煎煮2小时(药液沸腾开始计时),煎液滤过注入储罐,再加入方法煎液滤过注入提取液储罐。
1.生产过程吻合“板蓝根颗粒浸膏工艺规程”要求;2.按各岗位标准操作规程进行操作;3.按上述设施的标准操作规程进行操作;4.收膏在D级干净区进行。
操作5.各区按相应生产区的洁净规程进行洁净。
要求6.按上述各设施的洁净标准操作规程对设施进行洁净或消毒。
7.所有工序的物料交接一定进行复核复秤。
8.各工序按“交接班管理规程”进行交接班。
9.按“清场管理规程”要求进行变换品种或批号的清场。
1、提取:将称量好的板蓝根净药材投入到多功能提取罐中,要求每罐煎煮两次,第一次加入8倍量水,浸泡30分钟,煎煮2小时(药液沸腾开始计时),煎液滤过注入储罐,再加入6倍量水,煎煮1小时,煎液滤过注入提取液储罐。
提取工艺(50℃测),注入浓缩液储罐中。
2、浓缩:煎液所有浓缩至相对密度为参数3、醇沉:加入乙醇,使含醇量达到60%,搅拌30分钟,室温静置48小时使积淀。
4、收膏:将药液浓缩至相对密度为(50℃测)的浸膏。
下达人下达时间年月日QA复核人同意人接收人板蓝根批办理生产记录药材名称及批号:板蓝根()净料批号:项目指令工艺参数及要求实质操作及结果清场合格证优选□洗润□切药□干燥□1、操作前检生产允许证优选□洗润□切药□干燥□查设施完满证优选□洗润□切药□干燥□批办理指令优选□洗润□切药□干燥□所用设施设施一般优选工作台执行:操作时间:日时分--日时分2、优选SOP-PM002除去。
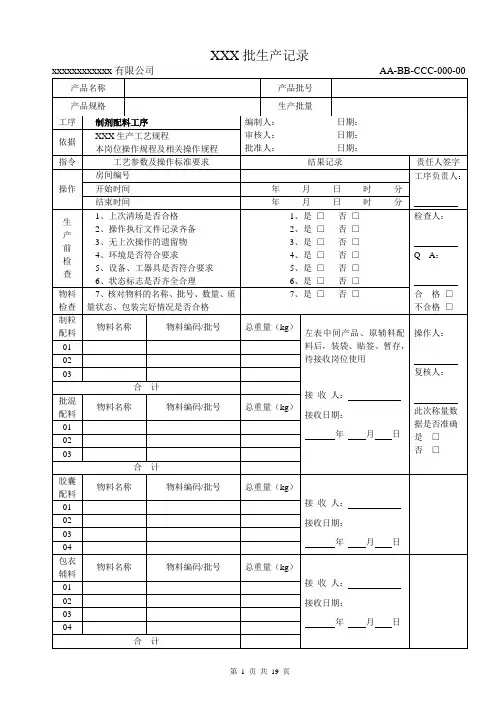
胶囊剂批生产记录如日中天产品名称产品规格产品批号技术主任技术员天津中天制药有限公司胶囊剂批生产记录年月日产品名称:规格:批号:投料量:万粒掺入残粉:kg 总产量:万粒投料日期:年月日包装产量:万粒成品率:% 配料工序制粒整粒工序原辅料名称数量kg 日期配料重量kg掺入残粉kg混筛重量收率% 颗粒中间站进站日期:年月日进站重量:kg 出站日期:年月日出站重量:kg中间体化验含量水分溶出度差异每粒重量包装工序日期包装规格应出万粒数实包万粒数收率%成品质量日期溶出度装量差异或含量均匀度含量菌检备注:胶囊剂生产处方年月日产品名称规格批号投料量万粒掺入余粉量折合万粒生产总量万粒原、辅料配比原、辅料名称分料量总量(kg)处方签发人复核者备注:配料工序原始记录产品名称批号规格投料量原、辅料名称产地厂名批号(编号)过筛目数数量kg 袋(桶)数备注:操作者复核者配料工序的质量检验品种数量异物细度检验人产品名称:规格:原料批号:批号:投料量:万袋掺入余量:kg 生产日期年月日年月日实投车料数班次:班次:分料量投料车数分料量投料车数原辅料名称重量kg 原辅料名称重量kg结合剂浓度每车用量kg kg 制粒筛网目数及类别干燥温度干燥时间干燥时间60℃时分至时分时分至时分80℃时分至时分时分至时分整粒筛网目数及类别振动筛网目数及类别干颗粒重量(kg)大颗粒重量(kg)细粉重量(kg)操作者签名备注:日期混合方式干颗粒总重量kg 桶数操作者签名备注:批清场原始记录生产批号调换批号清场日期清场人检查情况质检员签字备注:中转站颗粒原始记录进站日期进站数量收发人出站日期出站数量收发核对人残粉进站日期:进站数量:收发人:备注:中间体化验含量水分溶化性粒度签名项目备注:制粒工序的质量检验品名数量粘合剂浓度及温度干燥温度总混时间筛网目数检验人产品名称:批号:批来料量:产量:胶囊规格:理论囊重:应装囊重:装囊操作记录装囊日期板数折万粒数空囊领取数使用量万粒剩余量万粒消耗% 操作者合计备注:品名:批号:理论囊重:检验人:每次抽验粒数每格时间15分钟日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%备注:品名:批号:理论囊重:检验人:每次抽验粒数每格时间15分钟日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%备注:品名:批号:理论囊重:检验人:每次抽验粒数每格时间15分钟日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%日期:年月日班次:检验人:+5%+3.75%+2.5%+1.25%-1.25%-2.5%-3.75%-5%备注:产品名称批号批量规格包装规格日期操作情况包装材料姓名产量工号名称领取量使用量损耗量剩余量备注本批来料量:本批产量:本批产率:%本批损耗量:损耗率:% 合计投产日期:完成日期:备注:负责人:质量情况:质检员:名称数量外观密封批号检验人产品名称批号批量规格包装规格日期包装材料名称编号处方用量批准用量签发人:年月日产品名称批号批量规格包装规格日期操作情况包装材料姓名产量工号名称领取量使用量损耗量剩余量备注合计本批理论产量:本批来料量:本批总成品量:本批入库量:本批成品率:备注:本工序负责人:质量情况:本工序质检员:名称数量说明书批号外观检验人工序投料量(kg)成品量(kg)收率(%)制剂原辅料处理组制粒组内包装组外包装组填表人审核人填表日期审核日期备注:批审核记录产品名称:生产批号:批量:基本数据审核项目审核结果生产周期生产前清场检查□合格□不合格本批产量所用原敷料均检验合格□合格□不合格含量(%)称量、投料及复核□合格□不合格成品率(%)生产操作与操作指令、工艺规程一致性□合格□不合格总平衡率(%)半成品检验结果□合格□不合格物料平衡□合格□不合格生产过程的质量检查□合格 □不合格 成品检验结果 □合格 □不合格 生产原始记录审核□合格 □不合格 成品留样 □合格 □不合格 小盒、标签、说明书 □合格 □不合格 生产结束后的清场检查 □合格 □不合格 统计人 偏差及异常情况评价 □合格 □不合格统计日期 审核结论:审 核 人: 审核日期:车间主管签字日期。
中药丸剂制备车间批生产记录模版中药丸剂制备车间批生产记录模板
1. 项目概述
本文档旨在提供中药丸剂制备车间批生产记录的模板,以确保生产过程的可追溯性和合规性。
2. 生产记录模板
3. 注意事项
- 每个工序的物料名称、批号、数量、质量要求、检验结果和
检验员都应进行详细记录。
- 如果发现任何不合格或异常情况,应立即停止生产并记录。
- 所有记录应按照时间顺序进行编号和记录,以确保可追溯性。
4. 批生产记录模板的填写要求
- 所有填写应清晰、准确、无遗漏。
- 所有记录应及时填写并进行签字确认。
- 所有检验结果应附上相应的检验报告。
5. 批生产记录模板的保存和归档
- 每批生产记录应妥善保存,包括原始记录和相关检验报告。
- 按照相关法规要求,生产记录应保存至少5年。
以上是中药丸剂制备车间批生产记录的模板及相关要求。
在实际生产过程中,请严格按照模板填写和保存相关记录,并定期进行复核和归档,以确保生产过程的合规性和可追溯性。