药品化妆品批生产记录模板
- 格式:doc
- 大小:281.50 KB
- 文档页数:10
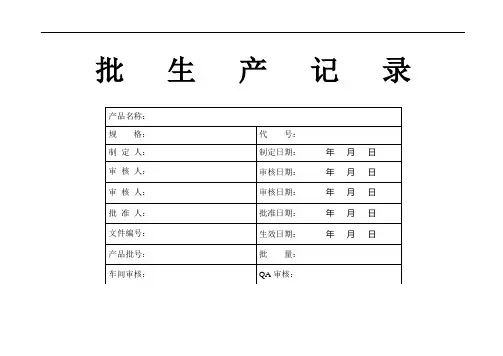
批生产记录
药业有限公司
批生产记录
页号:1/2
批生产记录
页号:2/2
称量单
页号:1/1
批生产记录
页号:1/2
批生产记录
页号:2/2
批生产记录
页号:1/2
批生产记录
页号:2/2
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
充填中间控制记录
页号:1/3
充填中间控制记录
页号:2/3
充填中间控制记录
页号:3/3
批生产记录
页号:1/2
批生产记录
页号:2/2
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
内包装中间控制记录
页号:1/2
内包装中间控制记录
页号:2/2
批生产记录
页号:1/3
批生产记录
页号:2/3
批生产记录
页号:3/3
外包装中间控制记录
外包装中间控制记录
附页
变更记载。
批生产记录
药业有限公司批生产记录
批生产记录
称量单
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
页号:1/3
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
充填中间控制记录
充填中间控制记录
充填中间控制记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
内包装中间控制记录
内包装中间控制记录
页号:2/2
批生产记录
批生产记录
批生产记录
外包装中间控制记录
页号:1/2
外包装中间控制记录
页号:2/2
附页
变更记载。

批生产记录模板1. 引言本文档为批生产记录模板,用于记录生产过程中的关键信息和操作步骤,以确保生产过程的可追溯性和一致性。
批生产记录是生产过程中的重要记录,对于质量管理和监督具有重要意义。
2. 批生产记录表格模板序号日期产品批号生产线生产工艺操作员审核员1 yyyy-mm-dd 这里填写产品批号这里填写生产线信息这里填写生产工艺信息这里填写操作员姓名这里填写审核员姓名2 yyyy-mm-dd 这里填写产品批号这里填写生产线信息这里填写生产工艺信息这里填写操作员姓名这里填写审核员姓名…………………3. 批生产记录的内容3.1 生产信息记录包括生产日期、产品批号、生产线、生产工艺等关键信息。
3.2 原料使用记录记录使用的原料的名称、批号、用量等信息,确保生产过程中使用正确的原料。
3.3 设备操作记录记录设备的启动、调整和停机过程,包括设备编号、操作员、操作时间等信息。
3.4 生产操作记录记录生产过程中的关键操作步骤,包括操作员、操作时间、操作内容等信息。
例如:•准备生产原料•混合原料•注入容器•运输产品•包装产品3.5 质量控制记录记录生产过程中的质量控制操作和结果,包括原料检验、产品检验等。
确保产品达到质量标准。
3.6 清洁和消毒记录记录清洁和消毒操作,确保生产环境符合卫生要求。
3.7 销售和分发记录记录产品的销售和分发情况,包括销售日期、销售数量、销售对象等信息。
4. 批生产记录的保存和归档完成生产后,批生产记录应按照规定的归档程序进行保存,确保可追溯性和安全性。
5. 批生产记录的审批和验证批生产记录应经过相应部门的审批和验证,确保内容真实可信。
6. 总结批生产记录是生产过程中的重要记录,对于质量管理和监督具有重要意义。
使用本文档的批生产记录模板可以有效地规范和记录生产过程中的关键信息和操作步骤,保证生产的可追溯性和一致性。
在进行生产过程中,请根据实际情况填写各项信息,并按照归档程序进行保存。


批生产记录
药业有限公司
页号:3/2
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
页号:2/2品名:胶囊文件编号:
备注:
充填中间控制记录
充填中间控制记录
充填中间控制记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
内包装中间控制记录
页号:1/2
内包装中间控制记录
页号:1/2
页号:1/3
页号:2/3
批生产记录
页号:3/3
外包装中间控制记录
页号:1/2
执行外包装S O P(每30箱取2盒检查一次喷码内容、板装半成品、说明书完好、清洁情况)
备注:
外包装中间控制记录
页号:2/2
执行外包装S O P(每30箱取2盒检查一次喷码内容、板装半成品、说明书完好、清洁情况)
备注:
变更记载。


批生产记录批生产记录序言该批生产记录通过详细记录生产过程中各项操作、检验、调整等数据,来确保产品符合规格要求,且生产过程符合质量管理体系要求,是对该批次产品的全面记录和监控,以便追溯产品及其生产过程,确保产品的质量和安全性。
基本信息生产企业:XXX制药有限公司生产地址:XX省XX市XX区XX路XX号产品名称:XXX注射液规格:XXml/支批号:XXX生产时间:XX年XX月XX日-XX年XX月XX日包装时间:XX年XX月XX日生产技术要求原料:所有原材料均符合YY标准。
制剂工艺:先将XX药剂量准确称量,然后溶解于XX溶媒中,再加入必要的配料,调整pH值至合适范围,过滤并灭菌后充填到合适容器中,进行辅料加压灌装和包装封口。
检验要求:严格按照药品质量管理规范中对产前、产中、产后三个阶段进行检验,包括外观检查、容器密封性检查、流变学性质测定、溶出度、物化指标及微生物限度检查等,确保产品性质符合国家药品标准和企业内控标准的要求并达到良好的临床疗效和安全性。
生产过程记录1. 原料准备序号原辅料名称规格数量生产企业批号1 XX 1kg XX有限公司 XXXXX2 XX 1L XX有限公司 XXXXX2. 制剂工艺2.1 准备药剂量将所需药剂量准确称量,记录如下:序号药品名称规格数量1 XX 1g x2 XX 2g x2.2 溶媒准备将所需溶媒准确称量,记录如下:序号溶媒名称用量1 XX 500mL2 XX 500mL2.3 溶解药品将药剂量逐渐添加入溶媒中,并边搅拌边加热至完全溶解。
2.4 加入配料将所需配料,按照配方比例逐个加入溶解好的药品中,并不断搅拌。
2.5 调整pH值随后加入必要的调整剂,逐渐调整药液的pH值至所需范围之内。
2.6 过滤及灭菌将调整好的药液进行滤过,并在100摄氏度下进行灭菌处理。
2.7 充填将灭菌后的药液按计量逐个充填至瓶中,并在容器的顶部进行辅料加压。
2.8 灌装进行容器灌装过程,确保包装完成后瓶内无空气并且密封性能好。

填表指引:
1、编号/品名: 按产品代号加名称填写。
2、生产批号: 根据生产指令批号。
3、规格:根据产品规格要求填写。
4、客户:根据订单客户名称填写。
5、评审签名: 参照表一
格□不合格
表一
6、客户确认: 对非口头订单无须确认; 对于客户的口头订单需客户进行确认。
如: 已传真或回函。
格□不合格
7、乳化时间、灌装时间、包装时间请填写包括日期在内的时间。
如:8.4 AM9:30;或8.5PM3:30;
8、指令签名: 一般由生产厂长负责;
9、领原料单号,与原始领料单号相符;
格
表四
15、喷雾性能检查要求:按泵头3-5次
表五
.
18、生产确认:即为本组生产符合相关要求,同意入库;19、退料:若无,请选择无,若有,请附退料单;20、成品检验报告:请参考成品检验报告流水号21、物料批号:请参照领料单号;22、物料平衡制表人:车间主任;23、物料平衡审核:生产厂长;表六24、车辆检查:为车辆检查人,请参考如表六检查要求后签名:25、放行审核:质量负责人
26、保安:请参阅质量负责人是否同意放行并签名,而后放行;
16、泄露性能检查要求:气压-0.06mpa保压3分钟。
批生产记录
药业有限公司
页号:3/2
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
页号:2/2品名:胶囊文件编号:
备注:
充填中间控制记录
充填中间控制记录
充填中间控制记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
内包装中间控制记录
页号:1/2
内包装中间控制记录
页号:1/2
页号:1/3
页号:2/3
批生产记录
页号:3/3
外包装中间控制记录
页号:1/2
执行外包装S O P(每30箱取2盒检查一次喷码内容、板装半成品、说明书完好、清洁情况)
备注:
外包装中间控制记录
页号:2/2
执行外包装S O P(每30箱取2盒检查一次喷码内容、板装半成品、说明书完好、清洁情况)
备注:
变更记载。
批生产记录产品名称:规格:代号:制定人:拟订日期:年月日审核人:审查日期:年月日审核人:审查日期:年月日批准人:同意日期:年月日文件编号:奏效日期:年月日产品批号:批量:车间审查:QA 审查:药业有限公司页号:1/2品名:胶囊规格:代号:批号:批量:万粒工序:称量文件编号:日期时间操作步骤生产记录操作人复核人称量前准备—对作业场所、环境的检查* 检查操作间温湿度、压差能否切合要求□是□否* 检查工作地区能否有与本批生产没关的物件□无□有* 检查生产地区卫生能否切合要求□切合要求□不切合要求—对电子台秤进行检查* 检查能否完满洁净待用□完满洁净□不完满洁净* 检查能否在其查验有效期内□是□否—检查生产所需物料能否备齐* 批生产指令单中的物料□已备齐□未备齐—洁净准备好的工用具,并用75%的乙醇消毒□已洁净□已消毒□未洁净□未消毒—替代状态标记* 用生产允许证替代清场合格证□已替代称量开始1.检查称量所用物料的品名、代号、批号、性状及查验报告应无□无误差误差* 检查应能过 100 目筛网□切合规定* 检查低代替羟丙基纤维素应能过80 目筛网□切合规定* 检查微晶纤维素应能过80 目筛网□切合规定* 检查淀粉应能过80 目筛网□切合规定* 检查滑石粉应能过80 目筛网□切合规定* 检查碳酸氢钠应能过80 目筛网□切合规定□未替代□有误差(见误差或备注)□不切合规定□不切合规定□不切合规定□不切合规定□不切合规定□不切合规定页号:2/2品名:胶囊规格:代号:批号:批量:万粒工序:称量文件编号:日期时间操作步骤生产记录操作人复核人* 检查硬脂酸镁应能过80 目筛网□切合规定□不切合规定2.按批生产指令单对原辅料进行称量配料见称量单称量结束清场—消除现场与本批生产相关的物件□已消除□未消除—对计量用具进行洁净,并用75%的乙醇消毒*电子台秤—对工作地区进行洁净—对工用具、卫生洁具进行洁净、消毒,并按规定寄存—替代状态标记□已洁净□已消毒□未洁净□未消毒□已洁净□未洁净□已洁净□已消毒□未洁净□未消毒□已定置□不决置* 用清场合格证替代生产允许证□已替代□未替代—检查 BPR 的完好性,相关凭据应已附到BPR 上□完好□不完好备注:称量单页号:1/1品名:胶囊规格:代号:批号:批量:万粒工序:称量文件编号:代号品名处方量分度值批号查考证号称量数目称量人复核人复核数目查对人复核人备注料次:第一料42134237 低代替羟丙基纤维素4241 微晶纤维素4204 淀粉42134237 低代替羟丙基纤维素4241 微晶纤维素4204 淀粉42134237 低代替羟丙基纤维素4241 微晶纤维素4204 淀粉4210 滑石粉4252 碳酸氢钠4207 硬脂酸镁备注:kg kgkg kgkg kgkg kg料次:第二料kg kgkg kgkg kgkg kg料次:第三料kg kgkg kgkg kgkg kg 外加辅料kg kgkg kgkg kgQA :批生产记录页号:1/2品名:胶囊规格:代号:批号:批量:万粒工序:制粒文件编号:日期时间操作步骤生产记录操作人复核人制粒前准备—对作业场所、环境的检查* 检查操作间温湿度、压差能否切合要求□切合要求□不切合要求* 检查工作地区能否有与本批生产没关的物件□无□有* 检查生产地区卫生能否切合要求□切合要求□不切合要求—对生产介质进行检查* 纯化水□正常□不正常* 压缩空气□正常□不正常—对计量用具进行检查* 电子台秤能否完满洁净待用,能否在其查验有效期内□完满洁净□是□不完满洁净□否* 检查酒精计能否完满洁净待用□完满洁净□不完满洁净—对湿法混淆颗粒机进行检查设施型号: SHK-220B 编号:* 检查搅拌桨、切碎刀中心部位的进气气流能否正常□正常□不正常* 调理流量计控制进气气流(气压P 应大于0.5MPa )□切合规定□不切合规定* 检查设施能否洁净,并用浸润75%乙醇的干净抹布擦□已擦抹□未擦抹拭与产品接触的部位□洁净□不洁净* 检查搅拌桨、切碎刀能否正常运行□正常□不正常—洁净准备好的工用具,并用75%的乙醇消毒□已洁净□已消毒□未洁净□未消毒—替代状态标记* 用生产允许证替代清场合格证□已替代□未替代* 用正在运行标记替代已洁净标记□已替代□未替代页号:2/2品名:胶囊规格:代号:批号:批量:万粒工序:制粒文件编号:日期时间操作步骤生产记录操作人复核人制粒开始1.按批生产指令单领取称量好的制粒用原辅料,查对品名、代号、批号、数目应无误差2.向 95%的乙醇中加入适当纯化水,制备 50%的乙醇水溶液(量具:酒精计)3.封闭湿法混淆颗粒机出料活塞;待门信号灯亮后,翻开物料锅盖,将、低代替羟丙基纤维素、微晶纤维素、淀粉倒入锅内;封闭物料锅盖,调整时间继电器为 240 秒,开始搅拌混淆4.将制备好的50%乙醇水溶液均匀洒入湿法混淆颗粒机原辅猜中,按下“启动”按钮,混淆搅拌120-240 秒,混合搅拌过程中切碎 60-180 秒制成适合湿颗粒,要求颗粒可以达到“捏之成团,一弹则散”□无误差□有误差见粘合剂配制记录第一锅第二锅第三锅混淆时间秒秒秒第一锅第二锅Ⅰ速Ⅱ速Ⅰ速Ⅱ速搅拌时间秒秒秒秒切碎时间秒秒秒秒粘合剂用量kg kg 搅拌电流A A第三锅Ⅰ速Ⅱ速搅拌时间秒秒粘合剂用量kg 切碎时间秒秒搅拌电流 A 粘合剂实质总用量:kg制粒结束—检查 BPR 的完好性□完好□不完好备注:品名:胶囊规格:代号:日期时间操作步骤干燥整粒前准备—对作业场所、环境的检查*检查操作间温湿度、压差能否切合要求*检查工作地区能否有与本批生产没关的物件*检查生产地区卫生能否切合要求—对生产介质进行检查*蒸汽—对烘房进行检查*检查能否完满洁净待用*接通电源,开启排水阀门,翻开风机,将烘房温度设定切合要求,翻开预警装置,将烘房试运行—对摇晃式颗粒机进行检查批号:批量:万粒工序:干燥整粒生产记录□切合要求□不切合要求□无□有□切合要求□不切合要求□正常□不正常设施型号: CT-C-Ⅱ编号:□完满洁净□不完满洁净□正常□不正常页号: 1/2文件编号:操作人复核人*检查能否完满洁净待用*装上 24 目铁质筛网,接通电源,按下启动按钮,将摇晃式颗粒机试运行—洁净准备好的工用具,并用75%的乙醇消毒—替代状态标记□完满洁净□不完满洁净实质筛网目数:目□正常□不正常□已洁净□已消毒□未洁净□未消毒* 用正在运行标记替代已洁净标记□已替代□未替代干燥整粒开始1.将湿颗粒均匀摊布于烘盘中;将推车推入烘房,翻开风机,并适当调理排水阀门;开启蒸汽阀;开启预警装置;并控制:页号:2/2品名:胶囊规格:代号:批号:批量:万粒工序:干燥整粒文件编号:日期时间操作步骤生产记录操作人复核人*铺盘厚度≤ 2cm* 湿颗粒进烘房前烘房温度应控制在80-90 ℃*干燥温度≤ 95℃* 干燥时间3-4 小时,每隔 1 小时翻盘一次*干燥结束时水分≤ 1.0%2.将干颗粒送整粒岗位,用摇晃式颗粒机进行整粒,整粒时应随时察看筛网有无破坏,若有破坏应实时改换。
**化妆品有限公司
批生产指令单
表单编号:SW-SC-1-3
**化妆品有限公司
成品放行单
配料工序批生产记录表单编号:SW-SC-1-4
乳化工序批生产记录表单编号:SW-SC-1-5
半成品检验工序批生产记录表单编号:SW-SC-1-7
打码工序批生产记录表单编号:SW-SC-1-6
分装、包装工序批生产记录表单编号:SW-SC-1-8、10
分装、包装工序检验批生产记录表单编号:SW-SC-1-9(11)
巡检单填写标准: 1.各项目必须完整填写,填写内容需清晰明了,状态良好直接画“√”;2.检验项目必须按我公司检验标准进行检验;3.首件确认时如检验结果NG,请在异常记录中填写临时处理方法,并且需再次做首件确认4.员工自主做完首件确认OK后需通知QC再次确认OK后方可批量量产。
5.检验频率:巡检频率统一半小时做产品巡检,每次至少检测3PCS并至少每班2次记录于报表中.
**化妆品有限公司成品检验报告单。
药品批生产记录范文产品名称:XXX片生产日期:2024年1月1日生产工艺流程:制粒、包衣、包装生产设备:制粒机、包衣机、包装机操作人员:李刚、张丽、王明、赵红审批人员:陈静制粒过程记录:1、将XXX原料称量好,按照规定的配方比例加入制粒机中。
2、打开制粒机,将原料进行搅拌和制粒,控制制粒时间为20分钟。
3、制粒完成后,将制粒好的颗粒取出,送入包衣过程。
包衣过程记录:1、将制粒好的颗粒放入包衣机中。
2、加入包衣剂液,根据设定的包衣工艺条件进行包衣。
3、控制包衣温度为40℃,包衣时间为40分钟。
4、包衣完成后,将包衣好的颗粒取出,送入包装过程。
包装过程记录:1、将包衣好的颗粒放入包装机中。
2、根据产品要求进行分装,每瓶装100片,并且每瓶装后进行严格称重。
3、将分装好的瓶装产品进行质量检查,检查项目包括外观、颗粒大小、商标贴合情况等。
4、符合质量要求的产品送入包装箱,按规定的规格进行捆绑。
生产备注:1、本次制粒过程按批记录,制粒机运行正常,无异常情况发生。
2、包衣过程中遵守包衣剂液的使用量和包衣时间要求,包衣质量符合要求。
3、包装过程中质量检查无异常发现,所分装产品的质量完好。
4、生产过程中操作人员严格按照操作规程进行操作,并及时填写相关记录,责任人陈静审查并签字确认。
总结:本次药品批生产过程中,制粒、包衣和包装过程都按照规定的工艺要求进行操作,产品质量符合要求,操作人员严格履行岗位职责,无不良记录。
在生产过程中,加强了质量控制和生产操作规范的执行情况,对产品质量的提升起到了积极的作用。
上述是一份药品批生产记录的示例,药品批生产记录的内容和格式可能有所差异,具体的记录要求根据所生产药品的性质、工艺等因素来确定。
在实际生产中,制定合理的生产记录流程,并严格执行记录要求,有助于保障药品质量和生产安全。
西林瓶、胶塞领料及理瓶记录^编.号: ************批生产记录批号:6)确认(各段与房间压差:预热段与房间压差加热段与房间压差冷却段与房间压差加热段与房间的压差大于预热段、冷却段与房间的压差7)KSZ620/75型隧道式灭菌干燥机标准操作程序8)9)10)检查温控平台参数:烘箱预热段温度:烘箱补风口过滤器1温度:烘箱补风口过滤器2温度:烘箱冷却段温度:烘箱加热器烘箱加热器烘箱加热器烘箱加热器打开夜间启动,打开网带,烘箱内自净20min以上,关闭夜间启动。
点击日间启动”功能键,系统自动工作。
1温度:2温度:3温度:4温度:100C80 C80 C60 C465 C465 C465 C465 C11)班组质检员检查过滤后注射用水应澄清无色,纤毛(>2mm)和白点(>0.5mm)等明显异物,纤毛(w 2mm)和白点(<0.5mn)应W3个。
把理好的西林瓶从传递窗取出装入进瓶网带。
清洗100支供QA人员检查合格。
确认烘箱温度升到设定温度后,关闭网带。
开始连续清洗,西林瓶进入隧道烘箱进行干燥、和除热原。
每小时检查记录一次注射用水压力、循环水的温度和压力、压缩空气压力、洗灌间压差。
12)13)14)15)16)□确认CCCCCCCC□已进行/ :□已进行□合格□已进行□合格□确认□已进行□已进行不得有灭菌注射用水压力/MPa循环水温度厂C循环水压力/MPa压缩空气压力/MPa洗灌压差/Pa西林瓶洗涤、灭菌操作记录(三)班组负责人审核:班组负责人审核: 年月日胶塞洗涤、灭菌操作记录(一)编号. ****** ******批生产记录批号:执行SOP□1)2)3)胶塞洗涤、灭菌操作记录(三)胶塞洗涤灭菌标准操作程序CDDA系列全自动胶塞清洗机标准操作程序CDDA系列全自动胶塞清洗机清洁标准操作程序胶塞洗涤灭菌标准操作程序4)5)6)7)8)9)10)11)12)操作指令第二次洗涤、灭菌:点击再次运行”输入操作密码,进入操作选择界面。