配制一定质量分数的溶液
- 格式:ppt
- 大小:141.50 KB
- 文档页数:10

一定溶质质量分数的氯化钠溶液的配制教学目标1.了解配制一定溶质质量分数溶液的步骤和所需的仪器2.初步学会配制一定溶质质量分数溶液3.练习称量、量取、溶解等操作4.在自主探究、观察比较中,培养学生分析、比较、抽象、概括的思维能力教学重点配制一定溶质质量分数溶液步骤和所需的仪器教学难点误差分析教学方法自学研究法、讨论法、实验法实验用品烧杯、托盘天平、玻璃棒、量筒、药匙、胶头滴管、细口瓶、食盐、水教学过程一、情境引入(展示两个试剂瓶)当我们生病,需要输液时,医生常会给我们输两瓶液体,一瓶是0.9%的生理盐水,还有一瓶是5%的葡萄糖注射液,你知道0.9%和5%指化学中哪个概念吗?具体表达什么意思?你知道食盐水在农业上有什么用途吗?16%的食盐水是什么意思?大家想不想亲自来配制一种溶液呢?这节课我们来学习配制一定溶质质量分数的溶液。
二、投影目标学生体会、理解目标。
三、检查课前预习【投影答案,学生个人解决预习中的问题】1.溶质的质量分数= --------- ×100%2.配制 50g 溶质质量分数为6% 的NaCl溶液时:(1)经计算在上称量 gNaCl并倒入干燥洁净的烧杯里,然后用量取 ml蒸馏水倒入装有NaCl的烧杯里,并用不断搅拌,使NaCl完全溶解,即得所需溶液。
(水的密度约为1g/ml)(2)称量一定质量的NaCl时,先放,后放,砝码放在,NaCl放在,且在托盘两边各放一张。
(3)量筒使用时,量筒必须放,视线要与量筒内保持水平,快接近刻度线时,改用加液体。
3.浓溶液用水稀释时:(1)浓溶液中溶质的质量稀溶液中溶质的质量(填 >、<、= )(2)所用水的质量=还有不明白的地方吗?首先我们来配制50g6%的氯化钠溶液。
合作探究(一)配制质量分数为6%的氯化钠溶液.利用提供的药品如何配制呢?药品有:水、固体氯化钠、20%的氯化钠溶液【学生讨论交流,设计实验方案】方案一:用固体氯化钠溶解配制方案二:20%的氯化钠溶液稀释我们采用方案一配制溶液。
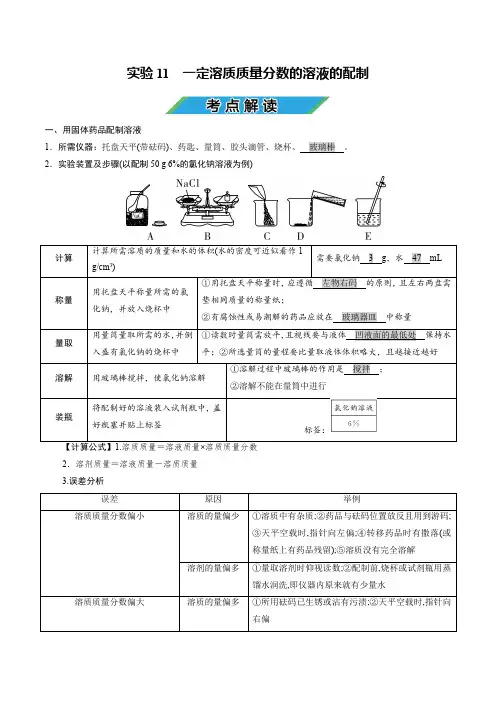
实验11 一定溶质质量分数的溶液的配制一、用固体药品配制溶液1.所需仪器:托盘天平(带砝码)2.实验装置及步骤(以配制50 g 6%的氯化钠溶液为例)标签:2.溶剂质量=溶液质量-溶质质量 3.误差分析【注意】若“左码右物”称量且使用了游码,则固体药品的实际质量=砝码质量-游码示数。
二、用浓溶液配制稀溶液1.所用仪器: 2.实验步骤计算→量取→混匀→装瓶并贴上标签 【计算公式】1.浓溶液的质量=稀溶液的质量×稀溶液的溶质质量分数浓溶液的溶质质量分数2.加入水的质量=稀溶液的质量-浓溶液的质量 3.误差分析(1)浓度偏小:量取水的体积时仰视读数;烧杯中原来有少量的水;在稀释时有部分浓溶液溅出;量取浓溶液时俯视读数。
(2)浓度偏大:量取水的体积时俯视读数;量取浓溶液时仰视读数。
【特别提醒】溶液配制完成后,转移过程中有部分液体洒出,溶液中的溶质质量分数不发生改变。
4.仪器的选用和基本实验操作(1)用硫酸钠固体配制质量分数为5%的硫酸钠溶液时,填字母序号)。
A B C D(2)欲配制质量分数为6%的NaCl 溶液,填字母序号)。
A.取固体B.称固体C.量取水D.溶解4.误差分析配制50 g 溶质质量分数为6%的氯化钠溶液时,填字母序号)。
①称量的氯化钠固体中含有不溶性杂质;②用量筒量取水时俯视读数;③将氯化钠固体放在托盘天平的右盘称量;④往烧杯中加水时有水洒出;⑤转移配好的溶液时有少量溅出。
A.②③B.①④C.②④D.③⑤一、单选题1.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是A.氯化钠固体中含有杂质B.用量筒量取水时仰视读数C.加水溶解固体时有水洒出D.配制好的溶液装瓶中时有少量洒出【答案】C【解析】A、称量的氯化钠固体中含有杂质,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小,不符合题意;B、用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小,不符合题意;C、加水溶解固体时有水洒出,溶剂质量减小,使溶质质量分数偏大,符合题意;D、将配制好的溶液装入试剂瓶中时有少量溅出,溶液具有均一性,溶质质量分数不变,不符合题意。


学生实验五一定溶质质量分数的氯化钠溶液的配
制
实验类型:
验证性实验
实验目的:
1.练习配制一定质量分数的溶液;
2.加深对溶质质量分数概念的理解。
实验用品
托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管;
氯化钠、蒸馏水。
实验过程:
1.配制质量分数为6%的氯化钠溶液
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 g;水 g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水,倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
整个配置过程如下图所示:
2.配制质量分数为3%的氯化钠溶液
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm), 配制50g 质量分数为3%的氯化钠溶液.
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别是:6%的氯化钠溶液 g,体积 mL;水
g。
(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀: 用玻璃棒搅拌,使混合物混合均匀。
3.把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签,放到试剂瓶柜中。
问题与讨论:
1.试剂瓶上贴的标签中应包括哪些内容?
2.实验中,所得溶液中溶质质量分数如果偏小,你认为可能的原因是什么?。

威海大光华国际学校 第九次化学小组活动 【实验一】配制一定质量分数溶液
【定义讲解】溶液、溶质、溶剂、质量分数
一、配制氯化钠溶液:
实验要求:配制50克溶质质量分数14%的NaCl 溶液。
实验装置和药品:天平,烧杯,量筒,胶头滴管,玻璃棒,细口瓶。
氯化钠,水。
实验步骤:
1、计算:NaCl 7g H 2O 43ml
2、称量:天平称量7克氯化钠;量筒量取43ml 水。
3、溶解:玻璃棒搅拌加速溶解。
4、装瓶保存:装入细口瓶并贴标签。
二、配制酒精溶液
实验要求:配制95克10%的酒精溶液
实验装置和药品:量筒,胶头滴管,烧杯,细口瓶,95%的酒精溶液,水。
实验步骤:
1、计算:95%酒精10克,即12.5ml ;水85ml 。
2、量取:分别用合适的量筒量取酒精和水
3、溶解(混合):在烧杯中倒入酒精和水
4、装瓶保存:装入细口瓶并贴标签。


一定溶质质量分数的氯化钠溶液的配制实验报告单实验名称:一定溶质质量分数的氯化钠溶液的配制一、实验目的:1.理解溶质的质量分数的概念;2.学习制备一定质量分数的氯化钠溶液的方法;3.掌握测量质量的准确方法。
二、实验原理:质量分数是溶液中溶质的质量与溶液总质量之比。
设氯化钠溶液的质量分数为x,则氯化钠的质量为x乘以溶液总质量。
质量分数的计算公式为:质量分数(x)=氯化钠质量/溶液总质量本实验采用蒸发法制备一定质量分数的氯化钠溶液,通过加热蒸发溶液中的水,使溶液浓缩,达到目标质量分数。
三、实验器材及试剂:1.氯化钠固体;2.蒸馏水;3.天平;4.烧杯;5.锥形瓶;6.镊子;7.加热器材;8.温度计。
四、实验步骤:1.准备工作:a.将所需器材清洗干净并晾干。
b.打开天平,将烧杯放在天平上,将天平调零。
c.使用镊子取一定质量的氯化钠固体,记录质量。
d.准备适量的蒸馏水。
2.配制溶液:a.将烧杯放在加热器上,将适量的蒸馏水倒入烧杯中。
b.将烧杯放在加热器上进行加热,同时搅拌溶液,直到观察到溶液开始沸腾。
c.一旦溶液开始沸腾,继续加热,直到溶液中的水蒸发至一定程度,使溶液浓缩。
3.测量质量:a.将烧杯从加热器上取下,放置到天平上,将天平调零。
b.将蒸发后的溶液慢慢倒入烧杯中,直到质量稳定。
c.记录溶液质量。
4.计算质量分数:a.使用质量分数公式计算氯化钠的质量分数。
b.记录计算结果。
五、实验数据记录:实验设置目标质量分数为0.2、实验过程中,取得的数据记录如下:质量分数x=氯化钠质量/溶液总质量=0.2质量分数x=0.2氯化钠质量=8g溶液总质量=40g六、实验结果与结论:通过本实验,成功地制备出了质量分数为0.2的氯化钠溶液。
七、实验讨论与思考:1.本实验使用的制备方法是蒸发法,理论上只有水分子被蒸发,而溶质的质量并不变化。
然而,实际操作中可能会有氯化钠固体溶解在水中,导致质量分数略高于理论值。
为了提高实验的准确性,可以在加热后加入少量蒸馏水,使溶液回溶,并进一步搅拌溶液以促进氯化钠的溶解。

溶液的配制及分析1.溶质质量分数(w )的计算公式是什么?提示:溶质质量分数(w )=m 溶质m 溶液×100% 2.如何配制一定质量分数的溶液?提示:一定质量分数溶液的配制步骤:①计算:计算出配制一定质量分数溶液所需溶质的质量和溶剂的质量。
②称量:称取溶质的质量,量取溶剂(水)的体积(将水的质量换算为水的体积)。
③溶解:将称取的溶质放入干净的烧杯中,加入量取的溶剂(水),用玻璃棒搅拌使其溶解,即得一定质量分数的溶液。
[新知探究]探究1 填写空白,认识物质的量浓度。
(1)概念:溶质B 的物质的量浓度是指单位体积溶液中所含溶质B 的物质的量,符号为c B 。
(2)单位:mol·L -1。
(3)表达式:c B =n B V 。
探究2 物质的量浓度与溶质质量分数的比较。
填写表中空白。
内容 物质的量浓度(c )溶质质量分数(w ) 定义 以单位体积溶液里含溶质的物质的量来表示溶液组成的物理量用溶质质量与溶液质量之比来表示溶液组成的物理量特点 ① 同一溶液中,各处的浓度完全相同,即溶液具有均一性②溶液稀释或浓缩后,溶液的浓度发生变化,但是溶质的质量和物质的量不变化计算公式 c =n 溶质V 溶液 w =m 溶质m 溶液×100%c (mol·L -1)=1 000 mL×ρ溶液g·mL -1×w M 溶质g·mol -1×1 L [必记结论]正确理解物质的量浓度(1)以单位体积溶液作标准,即1 L 溶液,不是1 L 溶剂,也不是溶液的质量是1 000 g 。
(2)以溶质的物质的量为标准,而不是溶质的质量。
(3)溶质可以是单质、化合物、离子或其他特定组合。
(4)从一定物质的量浓度的溶液中取出任一体积的溶液,其浓度不变,但所含溶质的物质的量或质量会因体积的不同而不同。
[成功体验]1.下列说法中正确的是( )A .1 L 水中溶解1 mol NaCl 所形成溶液的物质的量浓度是1 mol·L -1B .标准状况下,22.4 L HCl 溶于1 L 水中形成溶液的体积是1 LC .标准状况下,将33.6 L HCl 溶于水形成1 L 溶液所得溶液的物质的量浓度是1.5 mol·L -1D .1 mol BaCl 2溶于水配成1 L 溶液,所得溶液中c (Cl -)等于1 mol·L -1解析:选C 此题是概念性选择题,应逐个分析每个选项。

考点3 配制一定物质的量浓度溶液的方法及误差分析【考点定位】本考点考查配制一定物质的量浓度溶液的方法及误差分析,涉及物质的量浓度配制的基本操作要点、仪器的作用及误差分析等要点。
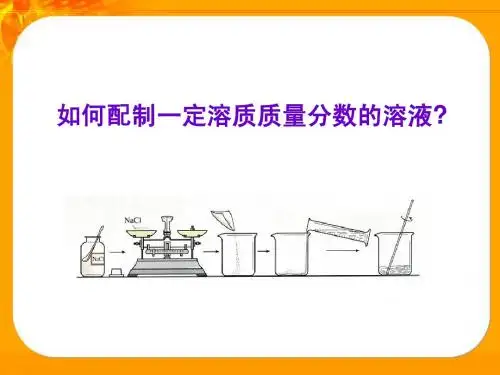
【精确解读】一、配制一定溶质质量分数的溶液的方法:1.实验用品:托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等.2.实验步骤:计算→称量药品→量取水→搅拌溶解(1)计算所需溶质和水的质量;(2)用托盘天平称量所需溶质,倒入烧杯中;(3)把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解;(4)把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中.3.误差分析(1)所配溶液溶质质量分数偏小的原因:①从计算错误角度考虑:水的质量算多了,溶质的质量算少了;②从用托盘大平称量的角度考虑:天平读数有问题.药品和砝码放颠倒了,左盘放纸片但右盘没有放纸片,调零时,游码未拨回“0”刻度等;③从用量筒量取液体的角度考虑:量取溶剂时,仰视读数了;④从转移药品角度考虑:烧杯不干燥或烧杯内有水,量筒中的液体溶质未全部倒人烧杯中;⑤从药品的纯度角度考虑:溶质中含有杂质。
(2)所配溶液溶质质量分数偏大的原因①称量时,所用砝码已生锈或沾有油污;②量取溶剂时,俯视读数了;二、配制一定物质的量浓度溶液的方法:1.容量瓶的选择和注意事项:①容量瓶是为配制准确的一定物质的量浓度的溶液用的精确仪器.常和移液管配合使用.以把某种物质分为若干等份.通常有25,50,100,250,500,1000mL等数种规格,实验中常用的是100和250mL 的容量瓶.2.注意事项:①容量瓶上标有:温度、容量、刻度线,使用时检验容量瓶容积与所要求的是否一致.②为检查瓶塞是否严密,不漏水.3.具体操作:在瓶中放水到标线附近,塞紧瓶塞,使其倒立2min,用干滤纸片沿瓶口缝处检查,看有无水珠渗出.如果不漏,再把塞子旋转180°,塞紧,倒置,试验这个方向有无渗漏;这样做两次检查是必要的,因为有时瓶塞与瓶口,不是在任何位置都是密合的.密合用的瓶塞必须妥为保护,最好用绳把它系在瓶颈上,以防跌碎或与其他容量瓶搞混;4.溶液配制:(1)实验仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管(2)实验原理:c=n/V(3)实验步骤:①计算:所称取固体的质量或所量取液体的体积.②称量:称量固体时要注意天平的精确程度,同样量取液体时,也要注意量筒和滴定管的精确程度.如托盘天平就不能称出5.85 g固体NaCl,量筒就不能量出5.25 mL液体的体积.因为他们的精确程度为0.1.建议使用电子天平.③溶解:一般在烧杯中进行,在溶解过程中有的有热效应,故还要冷却,这是因为容量瓶的容量、规格是受温度限制的,如果未冷却,会因为热胀效应而产生误差.④移液:转移液体时要用玻璃棒引流,且其下端一般应靠在容量瓶内壁的刻度线以下部位.⑤洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,其目的是使溶质尽可能地转移到容量瓶中,以防产生误差.⑥定容:当向容量瓶中加水至刻度线1 cm~2 cm处时,再改用胶头滴管至刻度处.⑦摇匀:这时如果液面低于刻度线,不要再加水⑧装瓶:容量瓶不能长时间盛放液体,应盛装在指定的试剂瓶中,并贴好标签。

一定溶质质量分数的氯化钠溶液的配置操作
要制备一定溶质质量分数的氯化钠溶液需要按照以下步骤进行:
1. 准备需要的材料和工具:实验室天平、容量瓶、量筒、滴定管、氯化钠固体、去离子水。
2. 确定目标溶液质量分数。
假设需要制备10%(质量分数)的氯化钠溶液。
3. 计算需要加入的氯化钠固体的质量。
假设需要制备100 mL的10%氯化钠溶液,则所需氯化钠质量为100 mL ×0.1 ×58.44 g/mol = 0.5844 g。
4. 操作步骤:
- 使用实验室天平称取0.5844 g氯化钠固体。
- 将氯化钠固体加入容量瓶中。
- 加入一定量去离子水(通常为稀释到最终体积的80%),摇匀使氯化钠完全溶解。
- 用去离子水稀释至最终体积(即100 mL),再次摇匀使溶液均匀。
5. 测定溶液的质量分数。
将少量溶液吸入滴定管中,滴在电子天平上测量其质量。
以上就是一定溶质质量分数的氯化钠溶液的配置操作的步骤。
需要注意的是,在制备过程中一定要遵守实验室安全操作规程,保证实验操作的安全性。
《配置一定溶质质量分数的溶液》教学设计点拨。
)学生实验:通过刚才这个小案例的分析,同学们更加关注配制一定溶质质量分数的溶液时精准度的问题了,那接下来请你与小组同学合作,试试自己能否准确的配制出500mL 0.9%的氯化钠溶液。
动手之前先要做好准备,请在实验报告单中填写你需要的仪器和药品,并检查组内实验用品是否齐全,然后简要呈现实验方案(即步骤)。
(教师抽查几组准备情况)★【学生分组实施实验】【学生完成实验后展示自己的成果】生活拓展(教师随机抽取一个小组配好的氯化钠溶液,追问学生)你认为自己配制的氯化钠溶液的溶质质量分数是不是比xx同学的更准确?你敢不敢用自己配制的这份溶液给病人注射?为什么?(播放视频)自制生理盐水注射后的严重后果【学生观看,体会严格地定量溶液组成对医疗的重要性,感悟科学生活保障生命安全的意义。
】(播放课件)定量配制溶液在农业、科研、生活中的应用和价值分析。
学生在质疑、交流、讨论之后关注到了实验的注意事项,同时明确了自己的实验任务,源于学生内心的竞争心理,学生势必满怀激情、信心十足的投入到实验活动中,活动本身也是对学生的一次运筹能力、执行能力的训练。
通过观看微视频,让学生认识到严格的精准定量对生命安全的意义。
结合图片等信息,感受定量配制溶液在农业、科研、生活中的应用和《配置一定溶质质量分数的溶液》学情分析学生通过本单元的学习,已经对溶液的组成有了初步了解,能够理解“溶质质量分数”这一定量表示溶液组成方法的含义,学生能够进行溶质质量分数的简单计算。
而且该实验学生已经在课堂上观察过老师的演示,所以再次到实验室完成配制溶液的任务并不困难。
但是,作为初中化学为数不多的定量实验之一,该内容对学生的思维严密性和操作准确度都有较高的要求,而目前来看,学生在这方面的能力和意识还存在欠缺,学生还需在具体任务的驱动下,通过交流讨论和动手实验,培养他们的运筹、分析、执行、合作能力以及精准的定量意识。
因此,教师在情境创设、问题分析和活动反思环节需精心设计,以力求实现该教学内容所承载的教育价值。
探究配制溶质质量分数一定的溶液实验题目:碘酒的溶质质量分数为2%,如何配制200 g这种碘酒?已知酒精的密度是0.8 g/cm3。
实验:(1)复习有关溶质质量分数的计算①溶液的质量×溶质的质量分数= ;②溶液的质量-溶剂的质量= ;③溶剂的质量/溶剂的密度= 。
(2)复习托盘天平的使用方法,思考并回答以下问题:①用托盘天平称量前,首先应该把游码放在处,检查天平是否左右平衡。
如果天平未达到平衡,可以调节,使天平平衡。
②称量时,把称量物放在盘。
如果称量物与砝码放反了位置,而称量时又没有使用游码,是否会影响称量结果?如果移动了游码,称量结果将会受到怎样的影响?实际质量可怎样推算出来?③称量物不能直接放在托盘上。
称干燥固体药品时,必须;称易潮解的药品,必须放在里称量。
④称量质量一定的药品时,先把砖码放在右盘,游码移至预定示数,再用药匙添加药品,直至天平平衡。
(3)复习量筒的使用方法,思考并回答以下问题:①实验时不直接用天平称量液体的质量,而是换算成后用量筒量取;②量取液体的量筒需选用大小合适的。
量筒的量程应比量液量略大,这样可减少误差;③在使用量筒量液时,先将液体倾倒入量筒,接近所需刻度时,改用逐滴滴加。
读数时,量筒必须放,视线必须。
(4)按图9-11所示的顺序进行实验并填写下列各空白处。
图9-11①计算:计算配制200 g溶质质量分数为2%的碘酒所需碘和酒精的质量。
其中碘g;酒精g,酒精的体积mL。
②称量:用托盘天平称量所需碘的质量,倒入中溶解。
③配制溶液:用量筒量取所需酒精的量,倒入盛有碘的烧杯里,用搅拌,使碘溶解。
这样得到的溶液即为200 g质量分数为2%的碘酒。
④贴标签:把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
解析:本题是综合性练习题,涉及内容广泛,但大致有以下三个方面:(1)与溶质的质量分数有关的计算:溶质的质量分数=溶质质量溶液质量×100%或溶质质量=溶液质量×溶质的质量分数、溶剂质量+溶质质量=溶液质量。
实验室操作:配制一定溶质质量分数的溶液目标本实验的目标是通过实验室操作,配制一定溶质质量分数的溶液。
实验设备和试剂- 称量器:用于准确测量溶质和溶剂的质量。
- 烧杯或容量瓶:用于容纳和混合溶质和溶剂。
- 搅拌棒或磁力搅拌器:用于混合溶质和溶剂。
- 试剂:根据需要选择相应的溶质和溶剂。
实验步骤1. 准备实验设备和试剂。
2. 使用称量器准确测量所需溶质的质量。
3. 将溶质加入烧杯或容量瓶中。
4. 使用称量器准确测量所需溶剂的质量。
5. 将溶剂加入烧杯或容量瓶中。
6. 使用搅拌棒或磁力搅拌器将溶质和溶剂充分混合直至完全溶解。
7. 根据需要,可以进行温度调节或pH调节等操作。
8. 完成溶液配制后,可进行进一步的实验或分析。
注意事项1. 在实验操作过程中,要注意安全,避免溶剂的飞溅或溶质的接触。
2. 按照实验要求准确测量溶质和溶剂的质量,以保证溶液配制的准确性。
3. 在混合溶质和溶剂时,可以使用适当的搅拌速度和时间,以确保充分混合和溶解。
4. 根据需要,可以调节溶液的温度或pH值,但要注意操作规范和安全。
5. 完成溶液配制后,及时清理实验设备,并按照实验室规定进行废弃物处理。
结论通过以上步骤,我们可以在实验室中配制一定溶质质量分数的溶液。
这个实验操作相对简单,只需要准确测量溶质和溶剂的质量,并进行充分混合即可。
在操作过程中要注意安全,并按照实验要求进行操作。
完成实验后,及时清理设备并进行废弃物处理。