溶液的质量分数与配制
- 格式:pptx
- 大小:143.95 KB
- 文档页数:43


溶液的配制及分析一.溶液的组成定量表示方法1.用质量分数来表示。
(属于质量浓度)(1)溶质的质量分数表示单位质量溶液中所含溶质的质量(2)a%=m(溶质)/m(溶液)×100%(3)单位:2.物质的量浓度(1)定义(2)公式:注意:V是溶液的体积而不是水的体积.nB为溶质的物质的量。
(属于体积浓度)二.关于物质的量溶液的配制例:配制0.2mol/L的氯化钠溶液100mL1.所需仪器天平或量筒(滴定管)、容量瓶、烧杯、玻璃棒、胶头滴管、药匙等。
容量瓶的使用要注意以下事项:注意:①.容量瓶为细颈磨口梨形平底瓶,带有与磨口吻合的玻璃塞或塑料塞②.容量瓶上标有刻度线、体积和温度(一般为20℃)③.体积有1000mL、500mL、250mL、100mL、50mL等多种,配制溶液时应与之相匹配④.容量瓶不可以用来长期存放溶液,不能加热,更不能用来做反应容器。
2.步骤(1)计算:(2)称量或量取:固体用托盘天平(易潮解物质如何称量?),液体用量筒(或滴定管/移液管)移取。
(3)溶解或稀释(4)移液:把烧杯液体引流入容量瓶。
(5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。
(6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。
(7)盖好瓶塞,反复上下颠倒,摇匀。
注意:因洗涤是将剩余溶液转移到容量瓶中,所以(4)和(5)可合并为一步,称为“转移”。
3.重点注意事项:(1)容量瓶使用之前一定要检查;(2)配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积;(3)把溶质直接放入容量瓶中溶解或稀释;(填能或不能)(4)溶解时放热的必须后才能移液;(5)定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时(填能或不能)再向容量瓶中加入蒸馏水。
因为定容后液体的体积刚好为容量瓶标定容积。
上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失;(6)如果加水定容时超过了刻度线,(填能或不能)将超出部分再吸走,必须练习:用98%的浓硫酸(=1.84g/cm3)配制250mL10mol/L的稀硫酸。

预习溶质质量分数和溶液配制考点 溶质质量分数1.溶质质量分数的计算(1)所有溶液: 溶质质量溶液质量×100%=溶质质量溶质质量+溶剂质量×100%(2)饱和溶液: 溶解度溶解度+100 g ×100%2.关于溶液稀释问题的计算计算原理:稀释溶液的过程中, 的质量不会发生变化。
计算公式:浓溶液质量×浓溶液中溶质的质量分数=稀溶液质量×稀溶液中溶质的质量分数。
[注意] ①两种溶液混合时,质量可以相加减,但体积不可以相加减。
②将溶质种类相同但质量分数不同的两种溶液混合时,存在以下关系:浓溶液质量×浓溶液中溶质的质量分数+稀溶液质量×稀溶液中溶质的质量分数=混合溶液质量×混合溶液中溶质的质量分数。
③计算时单位要保持一致。
3.一定溶质质量分数的溶液的配制(1)仪器的选用及各仪器的作用 ①所用仪器:托盘天平(带砝码)、药匙(溶质为固体时)、 、胶头滴管、 、玻璃棒。
②玻璃棒作用:搅拌, 固体溶质溶解速率(或使液体溶质与溶剂混匀)。
③量筒作用:量取液体的体积。
选取量筒时量程要比量取液体的体积略 ,且越接近越好。
(2)操作步骤所配制溶液的溶质为固体(如图9-2所示)。
① :计算所需溶质的质量和水的体积。
② :用托盘天平称取一定质量的固体;用量筒量取一定体积的水。
③ :将固体倒入烧杯中,将量取的水倒入烧杯中,用玻璃棒不断搅拌至固体完全溶解。
④ :将配制好的溶液装入试剂瓶中并贴上标签。
(3)注意事项①托盘天平的使用:用托盘天平称量时要遵循“ ”的原则,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的药品应放在玻璃器皿中称量。
②量筒的使用:用量筒量取液体,读数时视线应与量筒内液体 保持水平。
(4)误差分析4.用浓溶液稀释配制一定溶质质量分数的溶液(1)操作步骤①:计算所需浓溶液的体积和所需水的体积。
②:用量筒(很接近所需体积时改用胶头滴管)量取浓溶液和水。

溶液的配置实验原理溶液的配置是化学实验中常见的操作,也是化学实验中最基本的实验之一。
溶液的配置实验原理主要包括以下几个方面,浓度的计算、配制方法和注意事项。
首先,我们来看浓度的计算。
溶液的浓度通常用质量分数、摩尔浓度、体积分数等来表示。
其中,质量分数是指溶质的质量与溶液总质量的比值,摩尔浓度是指溶质的摩尔数与溶液的体积的比值,体积分数是指溶质的体积与溶液总体积的比值。
在实际操作中,我们需要根据实验要求和已知条件来计算所需的浓度,然后按照计算结果来进行配制。
其次,配制方法也是溶液配置实验中的关键步骤。
一般来说,我们可以采用溶质固体直接溶解、溶质溶液稀释等方法来进行配制。
在配制溶液的过程中,需要注意控制溶质的溶解速度和配制溶液的稳定性,避免出现结晶、沉淀或气泡等情况,影响溶液的浓度和稳定性。
此外,配制溶液时还需要注意一些细节和注意事项。
例如,在配制溶液的过程中,应该使用准确的称量仪器和容量瓶,保证溶质的准确称量和溶液的准确配制。
另外,需要注意的是在配制溶液的过程中,要严格按照实验要求和操作规程来进行,避免出现误操作或者操作失误,导致实验结果不准确或者出现安全隐患。
综上所述,溶液的配置实验原理涉及到浓度的计算、配制方法和注意事项。
在实际操作中,我们需要根据实验要求和已知条件来计算所需的浓度,然后按照计算结果来进行配制。
在配制溶液的过程中,需要注意控制溶质的溶解速度和配制溶液的稳定性,避免出现结晶、沉淀或气泡等情况。
另外,在配制溶液的过程中,要使用准确的称量仪器和容量瓶,保证溶质的准确称量和溶液的准确配制。
最后,在配制溶液的过程中,要严格按照实验要求和操作规程来进行,避免出现误操作或者操作失误,导致实验结果不准确或者出现安全隐患。
通过以上的原理和方法,我们可以更好地进行溶液的配置实验,保证实验结果的准确性和安全性。



溶液的配制1.概述(1)溶液分类根据溶液所含溶质是否确知,溶液可分为两种,一种是浓度准确已知的溶液,称为标准溶液,这种溶液的浓度可准确表示出来(有效位数一般为4位或4位以上)。
另一种浓度不是确知的,称为一般溶液,这种溶液的浓度一般用1—2位有效数字表示出来。
这两种溶液适用于不同的要求,如在定量测定实验中,需要配制标准溶液,在一般物质化学性质实验中,则使用一般溶液即可。
这两种溶液的配制方法不同,下面简单说明它们的配制方法。
1)标准溶液的配制①直接法:用分析天平准确称取一定量基准物质,溶解后配成一定体积(溶液的体积需用容量瓶精确确定)的溶液,根据物质的质量和溶液体积,即可计算出该标准溶液的准确浓度。
在直接法中必须要用基准物质配制,作为基准物质必须符合以下要求:a.物质的组成与化学式相符;若含结晶水,例如H2C2O4·2H2.O等,其结晶水的含量也应与化学式相符。
b.试剂应稳定、纯净,要使用分析纯以上的试剂。
c.基准物参加反应时,应按反应式定量进行。
另外,基准物质最好有较大的摩尔质量,这样,配制一定浓度的标准溶液时,称取基准物较多,称量相对误差较小。
常用的基准物质有草酸、氯化钠、无水碳酸钠、重铬酸钾等。
②标定法:有很多物质(如NaOH,HCl等)不是基准物质,不能用来直接配制标准溶液,可按照一般溶液的配制方法配成大致所需浓度的溶液,然后再用另一种标准溶液测出它的准确浓度,这个过程叫做标定,这种配制标准溶液的方法叫做标定法。
实验中有时也用稀释方法,将浓的标准溶液稀释为稀的标准溶液。
具体作法为:准确量取(通过移液管或滴定管)一定体积的浓溶液,放入适当的容量瓶中,用去离子水稀释到刻度,即得到所需的标准溶液。
2)一般溶液的配制在配制一般溶液时,用台秤称取所需的固体物质的量,用量筒量取所需液体的量。
不必使用量测准确度高的仪器。
(2)溶液浓度常用的几种表示方法1)、物质的量浓度(或简称物质的浓度)某物质的物质的量浓度为某物质的物质的量除以混合物的体积。


溶液配制实验报告无机化学实验第四版实验三:溶液的配制实验报告实验名称:溶液的配制实验日期: 温度: 气压:一. 实验目的1. 学习比重计,移液管,容量瓶的使用方法2. 掌握溶液的质量分数,质量摩尔浓度,物质的量浓度等一般配制方法和基本操作3. 了解特殊溶液的配制二.基础知识(详细见课本)1. 由固体试剂配制溶液2. 由液体(或浓溶液)试剂配制溶液三. 基本操作1. 容量瓶的使用(参见第四章二)2. 移液管的使用(参见第四章二)3. 比重计的使用(参见第四章三)4. 托盘天平及分析天平的使用((参见第四章一)四. 实验内容(以下的数据供参考)1. 用硫酸铜晶体粗略配制50ml0.2mol/L的硫酸铜溶液。
(涉及粗略配制的知识)根据前面的计算公式:硫酸铜的质量=CVM=0.2*0.05*160=1.6g配制过程:用托盘天平称取1.6g的硫酸铜晶体,倒入烧杯,再用量筒量取50ml 蒸馏水也倒入烧杯,搅动,使晶体完全溶解,即得50ml0.2mol/L的硫酸铜溶液,将其倒入试剂瓶,贴上标签备用。
2. 准确配制100ml质量分数为0.90%的生理盐水。
按氯化钠:氯化钾:氯化钙:碳酸氢钠=45:2.1:1.2:1的比例,在氯化钠溶液中加入氯化钾,氯化钙,碳酸氢钠,经消毒后即得0.90%的生理盐水。
(涉及准确配制的知识)根据前面的计算公式:溶质的质量=(WV溶剂)/(1-W)根据比例算出各自所需的质量配制过程:用分析天平准确称取它们各自的质量,把称取出的氯化钠倒入干净的烧杯中,加入适量的蒸馏水使其完全溶解,再加入氯化钾,氯化钙,碳酸氢钠,搅拌,使它们完全溶解于氯化钠的溶液中,将溶液转移到100/ml的人容量瓶中,用少量蒸馏水洗涤烧杯二至三次,冲洗液也倒入容量瓶中,再加蒸馏水至标线处,盖上塞子,将溶液摇匀,即是所配溶液,经消毒后移入试剂瓶中,贴上标签备用。
五. 数据记录m=_______,c=_______六. 实验习题配制50ml0.1mol/LSbCl3溶液(粗略配制)m=CVM=0.1*0.05*228.5=1.1425g配制过程:用托盘天平称取1g固体,倒入带有刻度烧杯中加入少量蒸馏水,搅动,使固体完全溶解后,再加蒸馏水至50ml刻度线处即得所要配制的溶液,将其倒入试剂瓶中,贴上标签备有。

愴解决和质董今敖的针專【罟司n株】1. 学会浓溶液稀释的计算。
2. 知道配制某一溶质的质量分数的溶液的方法和步骤。
3. 稳固对溶解度的涵义的理解。
4. 理解溶解度计算的根本思路。
一、配制溶质质量分数一定的溶液1. 用固体配制溶液:①步骤:计算、称量、溶解。
②所用仪器:托盘天平、胶头滴管、量筒、药匙、烧杯、玻璃棒。
例:配制溶液的质量分数为10%的氯化钠溶液50g.步骤:〔1〕计算:溶质的质量:50gxl0% = 5g;溶剂的质量:50g—5g=45g:水的体积:二込\g/ niL〔2〕称量:用托盘天平称量5g氯化钠倒入烧杯中,用50mL M简量取45mL水倒入烧杯中. 〔3〕溶解:用玻璃棒搅拌,加速固体物质的溶解速率,待氯化钠完全溶解得到的溶液即为10%的氯化钠溶液50g.实验操作步骤如以下图所示.2. 用浓溶液配制稀溶液:①步骤:计算、量取、溶解。
②所用仪器:胶头滴管、量筒、烧杯、玻璃棒。
二、有关溶液的计算依据溶液浓缩方法:参加溶质,蒸发溶剂,参加髙浓度的浓溶液.溶液稀释方法:参加溶剂,参加低浓度的稀溶液。
1. 加溶剂稀释和蒸发溶剂浓缩〔没有晶体析岀〕的计算依据,变化前后溶液中溶质的质量相等,可用以下关系式表示:也卄二加2><闪2,三量通过方程可求另一量.2. 加溶质增浓的计算:参加溶质溶解后,溶质和溶液质量都增加.原溶质质量+参加的洛质质量原溶液质量+参加的洛液的质量3.两种浓度不同的同种溶质的溶液混合后,所得的溶液中溶质的质量分数一圧大于小浓度,小于大浓度的溶质的质量分数。
溶液1中洽质质量+»容液2中溶质质量溶液1的质量+溶液2的质量溶液中溶质质虽:二溶液质量x 该溶液中溶质的质量分数.三、溶解度与饱和溶液中溶质、溶液、溶剂的关系一泄温度下,一世量的溶剂中所溶解物质的质量是一立的,反之,任意量的饱和溶 液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一左的,如果耙一定温度下溶剂的 量规立为100g,此时所溶解溶质形成饱和溶液时的质量称为溶解度。
如何计算溶液的质量分数
溶液的质量分数是衡量溶质在溶液中含量的指标,计算公式为:质量分数(%)=(溶质质量/溶液总质量)×100%
下面详细介绍如何计算溶液的质量分数:
1.确定溶质和溶液的质量
首先,需要知道溶质的质量和溶液的总质量。
溶质质量指的是溶解在溶剂中的溶质的质量,溶液总质量是溶质质量和溶剂质量之和。
2.计算质量分数
根据质量分数的计算公式,将溶质质量和溶液总质量代入公式,即可得到溶液的质量分数。
3.举例说明
假设有一溶液,其中溶质质量为10g,溶液总质量为100g。
那么,该溶液的质量分数为:
质量分数=(10g /100g)×100% =10%
4.注意问题
在计算质量分数时,要确保溶质质量和溶液总质量的单位一致,例如都使用克(g)作为单位。
此外,质量分数的单位通常是百分比(%)。
总之,计算溶液的质量分数需要知道溶质质量和溶液总质量,然后按照质量分数的计算公式进行计算。
掌握这个方法,就可以轻松计算各种溶液的质量分数。
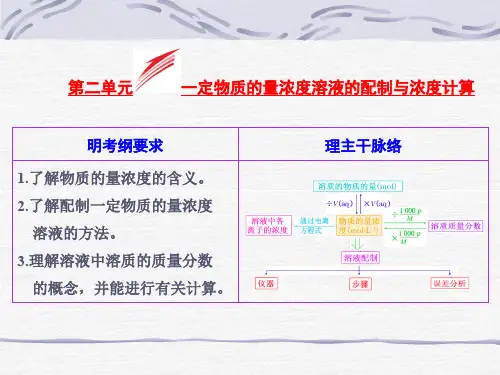
溶液的浓度及溶液配制教学指导意见核心素养1.了解溶液的组成及饱和溶液的概念。
2.理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行相关计算。
3.掌握一定溶质质量分数溶液和物质的量浓度溶液的配制方法。
1.宏观辨识与微观探析:能从不同层次认识物质的多样性,能根据溶液体积和溶质的物质的量浓度计算溶质的物质的量、溶质微粒数目。
2.科学探究与创新意识:能从问题和实际出发,确定探究目的,设计配制一定物质的量浓度溶液的方案,进行实验探究;在探究中学会合作,能够正确分析实验过程中可能存在的误差问题。
考点一溶液的浓度及相关计算[学在课内]1.溶液组成的两种表示方法(1)物质的量浓度[名师点拨]①物质的量浓度中的体积是指溶液的体积,而不是指溶剂的体积,不能用水的体积代替,如溶液混合,也不是两份溶液体积和。
②对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数不变,但所含溶质的物质的量、质量则因体积不同而改变。
③溶质的浓度和离子的浓度不一定相同,要注意根据化学式具体分析计算。
例如:1 mol·L -1 CaCl 2溶液中Cl -的物质的量浓度不是1 mol·L -1,而是2__mol·L-1。
(2)质量分数①概念:用溶质的质量与溶液的质量的比值来表示溶液组成的物理量,一般用百分数表示。
②表达式:饱和溶液(溶质的溶解度用S 表示)w =SS +100×100%2.有关物质的量浓度计算的两大类型(1)溶液中溶质的质量分数与物质的量浓度的换算。
计算公式:c =1 000ρw M(c 为溶质的物质的量浓度,单位:mol·L -1,ρ为溶液密度,单位g·cm -3,w 为溶质的质量分数,M 为溶质的摩尔质量,单位g·mol -1)。
[名师点拨]两种溶液浓度换算关系推导以n 为核心⎩⎨⎧质量分数溶液n =ρ×V ×wM物质的量浓度溶液n =c ×V ,故ρ×w ×V M=c ×V如ρ单位为g·L -1,c =ρwM ,如ρ单位为g·cm -3,c =ρw ×1 000M(2)溶液稀释、同种溶质的溶液混合的计算。
理解质量分数溶液的配制过程引言质量分数溶液是指以溶质的质量与溶液总质量之比来表示溶液中溶质的含量的一种浓度表示方法。
在实验室和工业生产中,我们经常需要配制质量分数溶液来满足不同的需求。
本文将介绍质量分数溶液的配制过程。
配制过程配制质量分数溶液的过程可以分为以下几个步骤:1. 确定质量分数首先,我们需要确定所需的质量分数。
质量分数是指溶液中溶质的质量与溶液总质量之比。
例如,如果我们需要制备质量分数为0.2的盐酸溶液,那么溶液中盐酸的质量应为溶液总质量的0.2倍。
2. 计算所需质量根据所需的质量分数和溶液总质量,我们可以计算出所需溶质的质量。
假设我们需要制备100g质量分数为0.2的盐酸溶液,那么盐酸的质量应为100g乘以0.2,即20g。
3. 配置溶液将计算得到的溶质质量加入适量的溶剂中,搅拌均匀。
在本例中,我们需要将20g的盐酸加入适量的溶剂中,直至溶解并搅拌均匀。
4. 检验溶液配制完成后,应当对溶液进行检验以确保其符合所需的质量分数。
可以使用适当的检测方法,如酸碱滴定法或分光光度法来测定质量分数。
注意事项在配制质量分数溶液时,需要注意以下事项:1. 溶质的纯度在计算所需质量时,应当考虑溶质的纯度。
如果溶质的纯度不是100%,则需要根据纯度进行适当的修正。
2. 溶液的稳定性有些溶质在溶液中可能会发生反应或分解,导致溶液不稳定。
在配制溶液时,应当注意溶液的稳定性,并避免使用不稳定的溶质。
结论配制质量分数溶液是实验室和工业生产中常见的操作。
通过确定质量分数、计算所需质量、配置溶液和检验溶液,我们可以成功地配制出所需浓度的溶液。
在操作过程中需要注意溶质的纯度和溶液的稳定性。