关于氢氧化钠、氢氧化钙的变质资料
- 格式:ppt
- 大小:3.96 MB
- 文档页数:8


氢氧化钠变质的探究1、变质原因与成分分析原因:氢氧化钠和空气中的二氧化碳发生反应。
化学方程式为成分分析:没有变质:NaOH;部分变质:NaOH和Na2CO3;全部变质:Na2CO3.2、检验是否氢氧化钠变质的方法:题目:一次用餐中,小丽同学对“固体酒精”产生好奇,于是她决定买回一袋,对其进行研究.【收集资料】通过阅读标签及查阅资料,她获得如下信息:(1)该固体酒精中含有酒精、氯化钙、氢氧化钠三种物质;(2)酒精的化学式为C2H5OH;(3)氯化钙、氯化钡的水溶液均呈中性.【提出问题】(1)酒精的化学式与NaOH相比,都有“OH”,那么酒精的水溶液是不是显碱性?(2)固体酒精中的氢氧化钠是否变质及变质的程度如何?【实验探究】实验一:她取少量酒精溶液于试管中,滴加硫酸铜溶液,未观察到蓝色沉淀,说明酒精溶液(填“显”或“不显”)碱性.实验二:(1)她先取少量固体酒精于烧杯中,加入足量水溶解后静置,发现烧杯底部有白色沉淀,再取沉淀于试管中加稀盐酸,观察到,说明氢氧化钠已变质.请写出氢氧化钠在空气中变质的化学方式.(2)她取上述烧杯中上层清液于试管中,先滴加足量澄清石灰水,发现生成白色沉淀,再滴入几滴无色酚酞溶液,液体呈红色,她认为氢氧化钠部分变质.老师发现后,提示她由该实验得出的结论不可靠.你认为只要将上述实验中的澄清石灰水变为(填化学式)溶液,即可得到氢氧化钠部分变质的结论.【拓展应用】除去部分变质的氢氧化钠溶液中的杂质,方法是(化学方程式表示)题目:实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。
某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?【提出猜想】通过分析,提出如下猜想:猜想Ⅰ:已完全变质,该样品中只含Na2CO3;猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为。
【查阅资料】①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;②CO2在饱和碳酸氢钠溶液中几乎不溶解。

氢氧化钠和氢氧化钙变质的探究一、氢氧化钠和氢氧化钙变质氢氧化钠变质:氢氧化钠变质的化学方程式_______________________________。
证明方法:(1)取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和 Na2CO3+2HCl=2NaCl+H2O+CO2↑(2)取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(3)取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓(或) Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓氢氧化钙变质:氢氧化钙变质的化学方程式______________________________。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+CO2↑氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
二、氢氧化钠和氢氧化钙部分变质氢氧化钠部分变质的证明方法:1、取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钡(或氯化钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na2CO3+BaCl2=2NaCl+BaCO3↓ Na2CO3+CaCl2 =2NaCl+CaCO3↓2、过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
氢氧化钙固体部分变质的证明方法:取样,加适量水使固体溶解,过滤,得滤渣和滤液。
向滤渣中加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在,向滤液中滴加酚酞,溶液变红,证明有氢氧化钙存在在。
CaCO3+2HCl=CaCl2+H2O+CO2↑例1:(2014鄂州)化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。


【2022年中考复习】氢氧化钠和氢氧化钙的变质问题探究一、氢氧化钠变质的知识归纳氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、除去杂质得到就纯净的氢氧化钠。
变质程度分别有:①全部变质:Na2CO3;②部分变质:N a2CO3和NaOH。
1.氢氧化钠变质的原因:如果敞口放置,与空气中的二氧化碳反应,生成了碱性的碳酸钠。
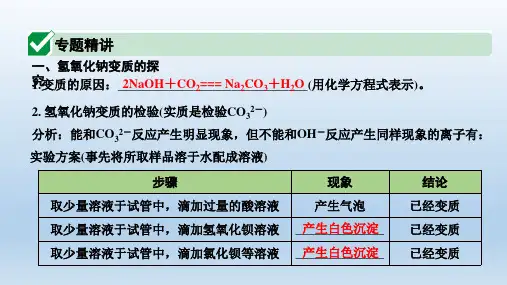
化学原理用化学方程式表示为:2NaOH+CO2=Na2CO3+ H2O2.检验氢氧化钠是否变质的方法(分别滴加酸、碱、盐溶液,各为一种方法)。
取少量样品于试管中,滴加足量稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
无明显现象,说明未变质。
化学原理用化学方程式表示为:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑。
②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
化学原理用化学方程式表示为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③取少量样品于试管中,滴加氯化钙溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
3.检验氢氧化钠变质程度的方法:取少量样品于试管中,滴加足量的中性的CaCl2溶液,有白色沉淀生成;过滤,向滤液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
分析原理:⑵氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
还可以加入:MgCl2(白色沉淀)、CuCl2(蓝色沉淀)、FeCl3(红褐色沉淀)、FeCl2(白色沉淀)、NH4Cl(刺激性气味)、紫色石蕊溶液等。




初三化学专题复习—NaOH 、Ca(OH)2变质问题【探究1:NaOH变质问题】氢氧化钠没密封保存会因吸收空气中的二氧化碳,生成碳酸钠而变质。
2NaOH+C O2===Na2CO3+H2O.一、氢氧化钠的变质存在这样三种情况(猜想):(1)没有变质:(成分NaOH)(2)部分变质:(成分NaOH 和Na2CO3)(3)完全变质:(成分Na2CO3)二、证明变质:(取样----加试剂---说操作---描现象---下结论)检验是否有碳酸钠有三种不同的方法:(1)加入盐酸有气泡冒出:2HCl + Na2CO3=2NaCl+ H2O+CO2↑(2)加入石灰水有沉淀产生:Ca(OH)2 + Na2CO3 = CaCO3↓+2NaOH(3)加入氯化钙有沉淀产生:Na2CO3 +CaCl2= CaCO3↓+2NaCl取少许固体物质溶于水,配成溶液与试管中;可分别向其中滴加酸、碱、盐溶液中的一种。
【方法(1)】:取少许固体物质溶于水,配成溶液与试管中,向其中滴加稀盐酸或稀硫酸,如果产生气泡,说明已经变质。
原理:碳酸钠会与酸反应生成二氧化碳气体,而氢氧化钠与酸反应没有明显现象。
Na2CO3+2HCl=== 2NaCl+H2O+ CO2↑〖NaOH+HCl== NaCl+H2O〗【方法(2)】:取少许固体物质溶于水,配成溶液与试管中,向其中滴加氢氧化钡溶液或氢氧化钙溶液,如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氢氧化钡或氢氧化钙反应生成白色沉淀,而氢氧化钠与氢氧化钡或氢氧化钙不反应,没有明显现象。
Na2CO3+Ba(OH)2== BaCO3↓+ 2NaOH;NaOH+ Ba(OH)2≠【方法(3)】:取少许固体物质溶于水,配成溶液与试管中,向其中滴加氯化钡溶液或氯化钙溶液(或硝酸钡等其他可溶性钙盐、钡盐溶液),如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氯化钡或氯化钙反应生成白色沉淀,而氢氧化钠与氯化钡或氯化钙不反应,没有明显现象。
氢氧化钠变质的探究1、变质原因:氢氧化钠暴露在空气中会吸收空气中的二氧化碳而变质,2NaOH + CO2=Na2CO3+ H2O2、变质情况:氢氧化钠暴露在空气中一段时间后,剩余物的可能组成有:(1)全部是NaOH(一点都没变质);(2)全部是Na2CO3(全部变质);(3)是NaOH和Na2CO3的混合物(部分变质)。
3、检验是否变质:(1)方法一:加酸,(稀盐酸、稀硫酸、稀硝酸均可),现象:有气泡产生。
2HCl + Na2CO3=2NaCl+ H2O+CO2↑HCl+NaOH=NaCl+H2O (无气泡产生)(2)方法二:加碱,【可溶性碱,Ba(OH)2、Ca(OH)2】,现象,产生白色沉淀。
Ca(OH)2 + Na2CO3 = CaCO3↓+2NaOHCa(OH)2与NaOH 不反应,无现象。
(3)方法三:加盐,【可溶性钡盐和钙盐,CaCl2、】,现象,产生白色沉淀。
Na2CO3 +CaCl2= CaCO3↓+2Na ClNa2CO3与NaOH 不反应,无现象4、检验是部分变质还是完全变质【思路】氢氧化钠已经变质,所以Na2CO3一定存在,只是需要鉴定NaOH,是否存在即可。
由于CO32-会对OH-的检验造成干扰,所以,先让CO32-全部沉淀,再检验OH-的存在。
【方法】步骤一:使碳酸根离子全部沉淀将氢氧化钠样品溶于水,加入过量CaCl2溶液【或Ca(NO3)2、BaCl2、Ba(NO3)溶液】,充分反应后过滤。
【不能加入Ba(OH)2、Ca(OH)2,因为加入的OH-离子,2会影响后面对氢氧化钠的检验】。
步骤二:检验氢氧根离子的存在向滤液中滴加酚酞溶液,若溶液变红色,说明氢氧化钠存在,说明样品部分变质;若溶液不变红色,说明氢氧化钠不存在,说明样品已经全部变质。
【步骤二,也可以向滤液中滴加硫酸铜溶液】专项练习1、实验室中有一瓶烧碱固体,打开瓶盖在空气中一段时间后,小王认为它可能变质,请你和他一起探究。
化学中考专题:NaOH 变质问题1. 原理:氢氧化钠与空气中的二氧化碳反应生成碳酸钠2NaOH + CO 2 Na 2CO 3 + H 2O2. 变质程度:3. 探究NaOH 溶液是否变质:① 方法一:加入足量的稀盐酸,若有气泡产生,证明NaOH 溶液已经变质。
Na 2CO 3 + 2HCl 2NaCl + H 2O + CO 2↑② 方法二:加入Ca(OH)2溶液或Ba(OH)2溶液,若产生白色沉淀,证明NaOH 溶液已经变质。
Ca(OH)2 + Na 2CO 3 CaCO 3↓+ 2NaOH Ba(OH)2 + Na 2CO 3BaCO 3↓+ 2NaOH③ 方法三:加入CaCl 2溶液或BaCl 2溶液,若产生白色沉淀,证明NaOH 溶液已经变质。
CaCl 2 + Na 2CO 3 CaCO 3↓+ 2NaCl BaCl 2 + Na 2CO 3BaCO 3↓+ 2NaCl4. 探究NaOH 溶液变质程度:加入足量CaCl 2或BaCl 2溶液,产生白色沉淀,再向上层清液中滴入几滴酚酞试液,若溶液变红,则说明NaOH 溶液部分变质;若溶液不变红,则说明NaOH 溶液完全变质。
加入足量CaCl 2或BaCl 2溶液作用:验证碳酸钠的存在并将碳酸钠除尽,防止其对氢氧化钠的验证产生干扰。
(思考:是否可以使用Ca(OH)2或Ba(OH)2溶液)加入酚酞试液的作用:验证氢氧化钠的存在。
可使用可溶性铜盐、铁盐、镁盐溶液、石蕊溶液等替代是否变质部分变质 NaOH 、Na 2CO 3 完全变质 Na 2CO 3未变质变质变质程度变质程度1.(2020.怀化)化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。
该小组的同学进行了如下实验探究:【提出问题】猜想Ⅰ:没变质,全部是;猜想Ⅱ:部分变质,既含有NaOH又含有Na2CO3;猜想Ⅲ:完全变质,全部是Na2CO3。
【查阅资料】i.已知反应: BaCl2 + Na2CO3 = BaCO3↓+ 2NaClⅱ.部分盐溶液在常温下的pH如下:【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题:滴加过量BaCl2溶液的目的是。