氢氧化钠和氢氧化钙的化学方程式知识分享
- 格式:doc
- 大小:32.51 KB
- 文档页数:1

氢氧化钠与氢氧化钙化学性质相似的原因
氢氧化钠和氢氧化钙是两种重要的无机物化合物,它们之间既有共同点也有明
显的不同之处。
这其中最值得一提的是它们在化学性质上的相似之处。
首先,氢氧化钠和氢氧化钙都属于无机无毒的化合物。
它们的相对分子质量,
比它们的溶解度及热稳定性等参数,均极为接近。
其次,这两种物质都能产生氢氧化体,在石灰的0.5mol/L中可同时共存,永不分解。
同时这两种物质的水溶液均
呈碱性,表达式分别为NaOH和Ca(OH)2。
再次,这两种物质都能发生盐析反应,能与氢氢氯化物反应生成氢氧化盐,反应式分别为NaCl+NaOH=NaOH+Cl-,
CaCl2+Ca(OH)2=Ca(OH)2+2Cl-。
究其原因,主要是由于氢氧化钠和氢氧化钙的分子结构有共性的部分。
考虑到
它们的结构,可以发现它们二者有着一个共同的单元组成:金属离子和一个氢氧根。
在这两种化合物中,金属离子是同类型的Ca2+、Na+,而氢氧根为OH-,它们构成
了分子结构上的相似性。
一般来说,无论是氢氧化钠还是氢氧化钙,它们都具备极高的抗腐蚀性,耐酸
碱耐久性良好,并且在软水系统中以及不同腐蚀性浓度的环境中都保持着良好的化学性能。
因此,氢氧化钠和氢氧化钙的化学形态在许多工业应用中具有很高的应用价值。
总之,由于氢氧化钠和氢氧化钙的分子结构具有相似之处,它们的化学性质也
十分相似。
它们除了具有多种化学性质的共同点外,在工业领域中还具有广泛的应用。

氢氧化钠和氢氧化钙区别方法氢氧化钠和氢氧化钙属于常见的无机化学物质,两者都是强碱性物质,但它们之间存在很多区别。
本文将从化学性质、物理性质、用途等方面进行详细分析和比较,探讨氢氧化钠和氢氧化钙的区别方法。
一、化学性质氢氧化钠,化学式为NaOH,分子量为40.00,是一种强碱性物质,能与酸反应,产生盐和水。
在大量水中溶解度高,生成氢氧化钠水溶液,其中氧化钠离子和氢离子反应产生水和盐,释放大量热量。
氢氧化钙,化学式为Ca(OH)2,分子量为74.09,也是一种强碱性物质,能与酸反应,产生盐和水。
与氢氧化钠不同的是,氢氧化钙的水溶液相对较不稳定,容易分解产生氢氧化钙,因此在制备氢氧化钙的过程中,需要将氢氧化钙的水溶液快速浓缩干燥,以免水分进一步分解产生氢氧化钙。
二、物理性质氢氧化钠是一种无色透明的液体,呈腐蚀性,有刺激性气味,易吸取水分和二氧化碳,产生碳酸钠。
氢氧化钙是一种白色粉末状物质,有弱腐蚀性,易吸湿,能吸收二氧化碳而变成碳酸钙。
在处理上,氢氧化钠需要小心谨慎,因为它很容易导致严重的腐蚀伤害,而氢氧化钙相对更容易处理,虽然还是有一定的腐蚀性。
另外,氢氧化钙的密度比氢氧化钠大,而且在高温下会慢慢分解成氧化钙和水蒸气。
三、用途氢氧化钠和氢氧化钙的用途也不完全一致。
氢氧化钠常用于金属加工、造纸、石油加工等领域,可用作清洁剂、催化剂、中和剂等。
水溶液还可用于制药、食品添加剂等工业用途。
而氢氧化钙则用于制造水泥、催化剂、陶瓷、玻璃、造纸等工业领域,也可用于农业领域中作为土壤酸碱调节剂和干燥剂。
氢氧化钠和氢氧化钙的区别方法虽然比较复杂,但在实际应用中也是十分关键的。
一般来说,我们可以通过测定pH值、电导率、可溶性等物理化学参数的方法检测样品,从而判断其是否为氢氧化钠或氢氧化钙。
此外,氢氧化钠和氢氧化钙颜色和形态也有一定的区别,在实际操作中可以通过目测的方式初步区分。
此外,在使用时还应该注意到这两种化学物质的使用要求,特别是在工业制造过程中,使用者必须正确理解两种物质的化学性质和特点,合理规划生产工艺,以保证安全高效地完成工作。
《氢氧化钠和氢氧化钙》知识点比较
常见的碱:氢氧化钠(NaOH)、氢氧化钠(Ca(OH)2)、氨水(NH3·H2O)
注意点:①氨水具有挥发性,有氨臭味。
②氢氧化钠固体要放在玻璃器皿中称量。
③氢氧化钠有强烈的腐蚀性。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲
碱的通性
碱之所以具有共同的相似性,是因为碱在溶液中电离出的阴离子都是共同的的氢氧根离
子。
因此碱的通性,可以认为是氢氧根离子(OH )表现出来的性质。
1. 紫色石蕊试液遇可溶性碱变蓝色,无色酚酞试液遇可溶性碱变红色。
2. 非金属氧化物+碱→盐+H2O
凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物。
由非金属元素组成的酸性氧化物中,多数能溶解于水,并跟水起反应生成对应的水化物—酸。
3. 碱+酸→盐+H2O
4. 碱+盐→新碱+新盐
注意点:
①能跟酸性氧化物反应生成盐和水的碱必须是可溶性碱。
②碱跟盐要发生反应的条件是二者必须可溶且生成物中必须有沉淀、气体、水三者之一。

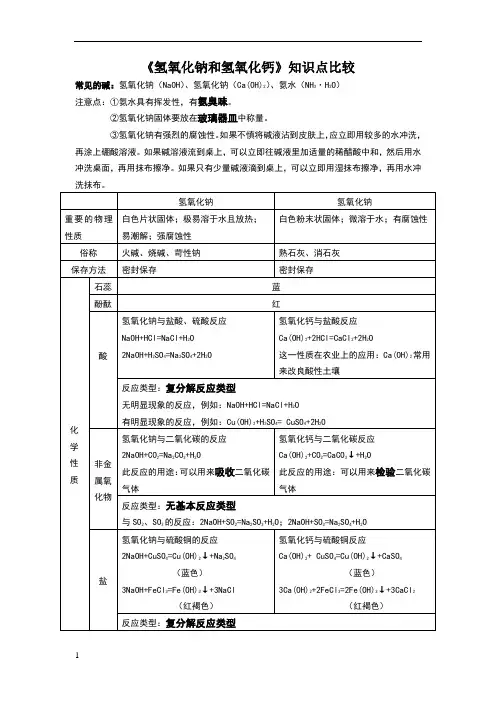
《氢氧化钠和氢氧化钙》的重要知识点1.化学式与结构:氢氧化钠的化学式为NaOH,氢氧化钙的化学式为Ca(OH)2、氢氧化钠是钠离子(Na+)与氢氧根离子(OH-)的化合物,而氢氧化钙则是钙离子(Ca2+)与两个氢氧根离子的化合物。
2.性质与溶解度:氢氧化钠是一种强碱,具有腐蚀性。
它可以与酸反应,产生盐和水。
氢氧化钠的溶解度随温度的升高而增加,室温下100g水可溶解约109g氢氧化钠。
氢氧化钙也是一种碱性物质,但相比氢氧化钠来说较为温和。
氢氧化钙的溶解度较低,室温下100g水只能溶解约0.17g氢氧化钙。
3.制备方法:氢氧化钠可以通过钠金属与水反应而制备。
钠金属与水反应,生成钠氢氧化物(NaOH)和氢气(H2)。
氢氧化钙可以通过石灰石(CaCO3)与水反应而制备。
石灰石与水反应,生成氢氧化钙(Ca(OH)2)和二氧化碳(CO2)。
4.应用:氢氧化钠和氢氧化钙在许多领域都有重要的应用。
氢氧化钠常用于工业生产中,如纸浆和纸张制造、肥皂和清洁剂制造、铝的制取等。
此外,氢氧化钠也用于水处理、制备实验室试剂等。
氢氧化钙广泛应用于工业制备和环境改善中。
在工业制备中,氢氧化钙可用于制备石灰、石膏和水泥等。
在环境改善中,氢氧化钙可用于调节土壤酸碱性、净化污水和废水。
5.安全注意事项:氢氧化钠和氢氧化钙都是腐蚀性物质,使用时要注意安全。
接触到皮肤或眼睛时,应立即用大量清水冲洗,并就医处理。
避免吸入其粉尘或蒸气,使用时应佩戴安全防护设备。
总结:氢氧化钠和氢氧化钙是常见的无机化合物。
它们在工业制备和实验室中具有重要的应用。
氢氧化钠是一种强碱,氢氧化钙则相对较为温和。
学习和了解氢氧化钠和氢氧化钙的性质和应用,有助于我们更好地理解化学基础知识和应用价值。

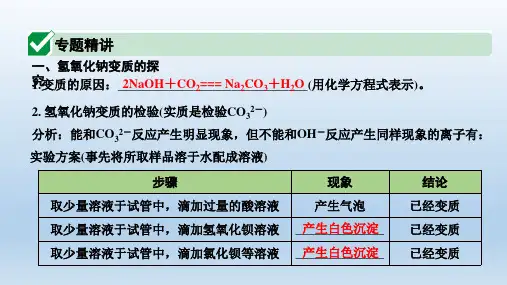
【2022年中考复习】氢氧化钠和氢氧化钙的变质问题探究一、氢氧化钠变质的知识归纳氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、除去杂质得到就纯净的氢氧化钠。
变质程度分别有:①全部变质:Na2CO3;②部分变质:N a2CO3和NaOH。
1.氢氧化钠变质的原因:如果敞口放置,与空气中的二氧化碳反应,生成了碱性的碳酸钠。
化学原理用化学方程式表示为:2NaOH+CO2=Na2CO3+ H2O2.检验氢氧化钠是否变质的方法(分别滴加酸、碱、盐溶液,各为一种方法)。
取少量样品于试管中,滴加足量稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
无明显现象,说明未变质。
化学原理用化学方程式表示为:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑。
②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
化学原理用化学方程式表示为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③取少量样品于试管中,滴加氯化钙溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
3.检验氢氧化钠变质程度的方法:取少量样品于试管中,滴加足量的中性的CaCl2溶液,有白色沉淀生成;过滤,向滤液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
分析原理:⑵氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
还可以加入:MgCl2(白色沉淀)、CuCl2(蓝色沉淀)、FeCl3(红褐色沉淀)、FeCl2(白色沉淀)、NH4Cl(刺激性气味)、紫色石蕊溶液等。

九年级氢氧化钠和氢氧化钙知识点学习中的困难莫过于一节一节的台阶,虽然台阶很陡,但只要一步一个脚印的踏,攀登一层一层的台阶,才能实现学习的理想。
下面是作者给大家带来的氢氧化钠和氢氧化钙知识点,欢迎大家浏览参考,我们一起来看看吧!中学化学——氢氧化钠属性探究一、名称氢氧化钠俗名苛性钠、烧碱、或火碱二、物理性质氢氧化钠为白色固体,易溶于水,溶解时能放出大量的熱。
它的水溶液有涩味和滑腻感。
氢氧化钠在空气中放置时易潮解,它还有强烈的腐蚀性。
三、固体氢氧化钠为何要密封储存?这有两个原因:一是避免氢氧化钠吸取空气中的水分产生潮解,二是避免氢氧化钠和空气中的二氧化碳反应生成碳酸钠。
四、氢氧化钠为何能做干燥剂?由于氢氧化钠能吸取空气或其它气体中的水分,所以能做干燥剂。
它可用来干燥NH3、O2、H2、CH4等气体,但不能用来干燥CO2、SO2等酸性气体。
五、氢氧化钠在溶解时为何会放出大量的热?这是由于氢氧化钠在溶于水时会产生两个进程:一个是物理进程,即Na﹢和OHˉ在水里的分散进程,这个进程要吸取热量;另一个进程是化学进程,即Na﹢和OHˉ的水合进程,这一进程要放出热量。
并且放出的热远远大于吸取的热,所以氢氧化钠溶解时会产生大量的热。
六、化学性质1、氢氧化钠能使紫色的石蕊试液变蓝色,使无色的酚酞试液变红色。
2、氢氧化钠+酸性氧化物→钠盐+水例如氢氧化钠和二氧化硫反应:2NaOH+SO2=Na2SO3+H2O。
这个反应可用于处理废气二氧化硫。
3、氢氧化钠+酸→盐+水例如氢氧化钠和盐酸反应:NaOH+HCl=NaCl+H2O4、氢氧化钠+某些盐→新碱+新盐例如氢氧化钠和硫酸铜反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4说明:碱和盐、盐和盐起反应时必须两边看,前边反应物必须都是可溶的,后边生成物必须符合复分解反应产生的三个条件其中之一。
七、氢氧化钠的用处氢氧化钠是一种重要的化工原料,广泛运用于制肥皂、炼石油、造纸、纺织、印染等各个行业。



氢氧化钠和氢氧化钙反应方程式
氢氧化钠和氢氧化钙是常见的化学物质,它们之间可以发生反应,其反应方程式为:
2NaOH + Ca(OH)2 ⇌ Ca(Na)2 + 2H2O 。
氢氧化钠是一种无色有机物,外观呈白色粉末或颗粒状。
氢氧化钠是碱性溶剂,其熔点为323K,摩尔体积为40.0g/mol。
它在水中易溶,可以与氢氧化钙反应形成盐溶液。
氢氧化钙也是一种无色有机物,外观呈白色粉末或颗粒状,它的熔点高达990K,摩尔体积仅为37.0g/mol,与氢氧化钠比较略微轻,它在水中也有良好的溶解性。
在此反应中,氢氧化钠和氢氧化钙发生化学反应产生钠钙氢氧化物Ca(Na)2和水,该反应中涉及的物质特性十分复杂,如果由相对微计量性的物质发生反应,可以合成丰富的化学物。
氢氧化钠它的氧化还原可以在多种物质中被调解。
由合成Ca(Na)2产生的温和减压还能满足一定的合成物的要求,成为制备质量优良、用途广泛的化工产品的理想原料。
总而言之,氢氧化钠和氢氧化钙之间会发生反应,该反应可能产生丰富多彩的物质,并有广泛的应用前景。

氢氧化钠与氢氧化钙的反应
嘿,小伙伴们,今天咱们来聊聊一个化学小趣事,保证让你觉得既神奇又接地气——那就是氢氧化钠和氢氧化钙这对“化学兄弟”碰面时会发生什么?
想象一下,氢氧化钠,咱们俗称的烧碱,那可是个火暴脾气的主儿,工业上、清洁上,哪儿都能见到它的身影,强碱性让它威力十足。
而氢氧化钙呢,听起来温柔点,石灰乳、熟石灰都是它的别名,虽然平时看起来挺文静的,但也是个碱性界的狠角色。
这俩要是搁一块儿,嘿,那场面可就热闹了!它们一见面,就像是久别重逢的老友,非要来个热烈的“拥抱”。
但这个拥抱可不是简单的拍拍肩,而是化学反应级别的“亲密接触”。
它们会互相交换离子,生成两种新的物质——碳酸钠和氢氧化钙沉淀(这里简化一下,实际上反应条件可能更复杂,但咱们就图个乐呵嘛)。
想象一下,原本两个清澈的溶液,一混合,就开始变得浑浊,那是因为氢氧化钙开始沉淀下来了,就像是天空突然飘起了雪花,只不过这雪是白色的沉淀物罢了。
这个过程,就像是两个性格迥异的朋友,碰撞出了不一样的火花,虽然外表看起来有点“混乱”,但内里却藏着化学的奥秘和乐趣。
而且啊,这反应还有点儿像咱们生活中的“化学反应”,有时候,两个看似不合拍的人,一旦找到了共同话题,也能碰撞出意想不到的精彩。
化学世界就是这样,充满了未知和惊喜。
下次当你再看到氢氧化钠和氢氧化钙的实验时,不妨想象一下它们之间的“友情岁月”,是不是觉得化学也没那么枯燥了呢?
说不定,你还能从中找到一些生活的小哲理呢!总之,化学的世界,就是这么奇妙,这么接地气,这么充满人情味。
co2与氢氧化钠和氢氧化钙反应离子方程式概述说明1. 引言1.1 概述本文旨在研究CO2与氢氧化钠和氢氧化钙的反应离子方程式,并探讨这些反应的概述、过程和机理。
CO2是一种常见且重要的气体,其与碱性溶液中的氢氧化物反应能产生有趣的化学变化。
而钠和钙的氢氧化物作为碱性溶液,它们与CO2反应会引发一系列离子间的转换和生成。
1.2 文章结构本文将从三个主要部分展开讨论:CO2与氢氧化钠反应离子方程式、CO2与氢氧化钙反应离子方程式以及实验数据分析与讨论。
在第一部分中,我们将介绍这两种反应的概述、过程和机理。
接下来,我们将对实验数据进行分析,并解释和讨论结果。
最后,我们将总结研究的主要结果,并就进一步深入研究的方向提出建议。
1.3 目的本文旨在深入探究CO2与碱性溶液中的氢氧化物(包括钠和钙)之间的反应机制,并揭示这些反应的潜在应用和意义。
通过实验数据分析与讨论,我们将推测这些反应的化学性质,并提出进一步研究的方向建议。
这有助于扩展对CO2与碱性溶液反应的理解,并为未来减少CO2排放和开发新型碱性溶液技术提供参考依据。
2. CO2与氢氧化钠反应离子方程式:2.1 反应概述:CO2是一种常见的无机气体,而氢氧化钠(NaOH)则是一种碱性物质。
这两者之间的反应可以产生一个新的化合物,并释放出水和二氧化碳。
2.2 反应过程:当CO2气体通过水溶液中的氢氧化钠时,发生以下反应:CO2 + 2 NaOH -> Na2CO3 + H2O在这个反应中,一个分子的CO2与两个分子的NaOH进行反应。
产物是碳酸钠(Na2CO3)和水。
2.3 反应机理:这个反应可以分为两个步骤:- 首先,二氧化碳与水发生一个简单的酸碱中和反应,生成碳酸:CO2 + H2O -> H2CO3这个步骤中,二氧化碳与水生成了一种叫做碳酸(H2CO3)的物质。
- 然后,生成的碳酸与氢氧化钠发生酸碱反应,生成盐和水:H2CO3 + 2 NaOH -> Na2CO3 + H20在这个步骤中,上一步骤生成的碳酸与氢氧化钠反应,产生了碳酸钠(Na2CO3)和水。
少量氢氧化钙和氢氧化钠反应的离子方程式
嘿,朋友们!你们问少量氢氧化钙和氢氧化钠反应的离子方程式啊?哈哈,这可得好好讲讲呢!首先咱得知道,氢氧化钙是个微溶性的碱,氢氧化钠可是个强碱性的家伙。
那它们碰到一起会咋样呢?少量的氢氧化钙和氢氧化钠在溶液中啊,其实并不会发生化学反应哦!就好像两个性格相似的人,可能并不会产生什么特别的“火花”呀!你想想,它们都是碱性的物质,没有那种能促使它们强烈反应的因素存在呢。
比如说,咱生活中有很多类似的情况呀。
就好比你有一堆苹果,再给你几个苹果,它们也不会突然变成香蕉呀,对吧?这氢氧化钙和氢氧化钠也是这个道理。
它们在溶液中各自以离子的形式存在着,钙离子、氢氧根离子,钠离子、氢氧根离子,大家都相安无事呢。
要是它们真能反应,那这世界不就乱套啦?那我们学化学不就头疼死啦!所以呀,少量氢氧化钙和氢氧化钠就是这么和谐共处着,没有什么特别的反应发生。
但是哦,如果情况变一变,加入了其他的物质或者条件改变了,那可就说不定啦!就像生活中,原本平静的局面,可能因为一个小小的变化,就变得完全不一样了呢。
化学的世界就是这么神奇,充满了各种可能性和变化。
你们明白了吗?哈哈,要是还不明白,随时来问我呀,我这个专家随时给你们解答疑惑!。
概念性质的理解①氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沽到皮肤.上或洒在衣服上。
如果不慎将碱液沽到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
②浓硫酸、氢氧化钠固体溶于水放热,属于物理变化;而氧化钙溶于水放热是氧化钙与水反应放出大量的热,属于化学变化;生石灰具有强烈的吸水性,可以作某些气体的干燥剂。
③由于NaOH易潮解,同时吸收空气中的CO2发生变质,所以NaOH必须密封保存。
④保存碱溶液的试剂瓶应用橡胶塞、不能用玻璃塞,以防止长期不用碱溶液,碱溶液腐蚀玻璃造成打不开的情况。
⑤只有可溶性碱溶液才能使指示剂变色,如NaOH溶液能使无色酚酞变红;但不溶性碱不能使指示剂变色,如Mg(OH)2中滴加无色酚酞,酚酞不变色。
⑥盐和碱的反应,反应物中的盐和碱必须溶于水,生成物中至少有一种难溶物、气体或H2O。
铵盐与碱反应生成的碱不稳定,分解为NH3和H2O。
⑦碱与酸的反应中碱可以是不溶性碱,如Cu(OH)2+H2SO4==CuSO4+2H2O。
氢氧化钠和氢氧化钙的鉴别:NaOH与Ca(OH)2的水溶液都能使酚酞变红,故鉴别NaOH和Ca(OH)2不能用指示剂,通常情况下,可采用以下两种方法来鉴别NaOH和Ca(OH)2方法一:通入CO2气体,NaOH溶液与CO2气体反应后无明显现象,但Ca(OH)2溶液即澄清石灰水与CO2反应生成白色沉淀。
方法二:滴加Na2CO3溶液或K2CO3溶液,NaOH溶液与K2CO3,Na2CO3溶液不反应,但Ca(OH)2溶液与Na2CO3、K2CO3溶液反应均生成白色沉淀。
Ca(OH)2+ Na2CO3==CaCO3↓+2NaOH,Ca(OH)2+K2CO3==Na2CO3+2KOH。
检验二氧化碳气体是否与氢氧化钠溶液反应的方法通常情况下,将二氧化碳气体直接通人装有氢氧化钠溶液的试管中,很难直接判断二氧化碳气体是否与氢氧化钠溶液反应。
因。
鉴别氢氧化钠和氢氧化钙
物理溶解的方法,氢氧化钠在水中溶解度较大。
化学的方法区分,主要原理是钙离子与钠离子的区别,钙离子可以与碳酸根离子生成白色沉淀。
向配置好的两种不同溶液中,分别加入等量的碳酸钾溶液,有白色沉淀生成的即是氢氧化钙溶液。
氢氧化钠
氢氧化钠,无机化合物,化学式NaOH,也称苛性钠、烧碱、固碱、火碱、苛性苏打。
氢氧化钠具有强碱性,腐蚀性极强,可作酸中和剂、配合掩蔽剂、沉淀剂、沉淀掩蔽剂、显色剂、皂化剂、去皮剂、洗涤剂等,用途非常广泛。
工业生产氢氧化钠的方法有苛化法和电解法两种。
苛化法按原料不同分为纯碱苛化法和天然碱苛化法;电解法可分为隔膜电解法和离子交换膜法。
氢氧化钙
氢氧化钙是一种无机化合物,化学式为Ca(OH)2,俗称熟石灰或消石灰。
是一种白色粉末状固体,加入水后,分上下两层,上层水溶液称作澄清石灰水,下层悬浊液称作石灰乳或石灰浆。
上层清液澄清石灰水可以检验二氧化碳,下层浑浊液体石灰乳是一种建筑材料。
氢氧化钙是一种强碱,具有杀菌与防腐能力,对皮肤,织物有腐蚀作用。
氢氧化钙在工业中有广泛的应用。
它是常用的建筑材料,也用作杀菌剂和化工原料等。
1 碱 的 化 学 方 程 式
1.氢氧化钠溶液与二氧化碳反应:________________________________________
2.氢氧化钠溶液与二氧化硫反应:________________________________________
3.氢氧化钠溶液与三氧化硫反应:________________________________________
4.氢氧化钠溶液与盐酸反应:___________________________________________
5.氢氧化钠溶液与稀硫酸反应:_________________________________________
6.氢氧化钠溶液与硫酸铜溶液反应:_____________________________________
7.氢氧化钠溶液与氯化铁溶液反应:_____________________________________
8.氢氧化钙溶液与二氧化碳反应:________________________________________
9.氢氧化钙溶液与盐酸反应:___________________________________________
10.氢氧化钙溶液与碳酸钠溶液反应:____________________________________
11.氢氧化钙溶液与碳酸钾溶液反应:____________________________________
12.氢氧化钾溶液与二氧化碳反应:______________________________________
13.氢氧化钾溶液与盐酸反应:__________________________________________
14.氧化钙和水反应:__________________________________________________
15.氢氧化铝与盐酸反应:______________________________________________
16. 构建知识网络是一种重要的学习方法。
下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“
”表示一种物质转化成另一种物质,A 、C 属于不同类...别.
的化合物。
完善这个知识网络:
(1)写出A 、B 、C 的化学式:A ;B ;C 。
(2)根据自己得出的知识网络写出一个复分解反应.....
化学方程式:。