氢氧化钠和氢氧化钙的变质专题
- 格式:docx
- 大小:14.17 KB
- 文档页数:6


氢氧化钠和氢氧化钙变质的探究一、氢氧化钠和氢氧化钙变质氢氧化钠变质:氢氧化钠变质的化学方程式_______________________________。
证明方法:(1)取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和 Na2CO3+2HCl=2NaCl+H2O+CO2↑(2)取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(3)取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓(或) Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓氢氧化钙变质:氢氧化钙变质的化学方程式______________________________。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+CO2↑氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
二、氢氧化钠和氢氧化钙部分变质氢氧化钠部分变质的证明方法:1、取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钡(或氯化钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na2CO3+BaCl2=2NaCl+BaCO3↓ Na2CO3+CaCl2 =2NaCl+CaCO3↓2、过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
氢氧化钙固体部分变质的证明方法:取样,加适量水使固体溶解,过滤,得滤渣和滤液。
向滤渣中加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在,向滤液中滴加酚酞,溶液变红,证明有氢氧化钙存在在。
CaCO3+2HCl=CaCl2+H2O+CO2↑例1:(2014鄂州)化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。


氢氧化钠氢氧化钙变质问题
氢氧化钠和氢氧化钙是两种常见的化学物质,它们在工业生产
和日常生活中都有着重要的应用。
然而,当它们发生变质时可能会
带来一些问题。
首先,让我们了解一下氢氧化钠和氢氧化钙的性质。
氢氧化钠,化学式为NaOH,是一种强碱,常见的用途包括制造肥皂、纸张和清
洁剂等。
而氢氧化钙,化学式为Ca(OH)2,也被称为熟石灰,常用
于水处理、建筑材料和农业等领域。
当氢氧化钠和氢氧化钙发生变质时,可能会导致以下问题:
1. 化学反应,氢氧化钠和氢氧化钙在一定条件下可能会发生化
学反应,产生新的化合物,这可能会影响到原本预期的使用效果。
2. 安全隐患,变质后的氢氧化钠和氢氧化钙可能会导致安全隐患,如释放有害气体或导致火灾等危险情况。
为了避免氢氧化钠和氢氧化钙的变质问题,我们需要注意以下
几点:
1. 储存条件,储存氢氧化钠和氢氧化钙时,应该避免高温、潮湿和阳光直射,以防止其发生变质。
2. 使用期限,在使用氢氧化钠和氢氧化钙时,应该注意其使用期限,避免使用过期或变质的产品。
3. 化学储存分开,在储存氢氧化钠和氢氧化钙的时候,应该避免与其他化学品混合储存,以免发生意外的化学反应。
总的来说,氢氧化钠和氢氧化钙是重要的化学物质,但是在使用和储存时需要注意其变质问题,以确保安全和有效地使用。


氢氧化钠与氢氧化钙变质问题专项练习()1、氢氧化钠变质的原因,发生反应的化学方程式。
2、证明氢氧化钠变质的方法(1)可以加,现象,说明氢氧化钠变质。
(2)可以加,现象,说明氢氧化钠变质。
(3)可以加,现象,说明氢氧化钠变质。
3、氢氧化钙变质的原因是,反应的化学方程式。
4、某同学在实验时发现一瓶盛装氢氧化钠溶液的试剂瓶口有白色粉末, 他推测该白色粉末可能是残留在瓶口的氢氧化钠变质形成的新物质.(1)为验证自己的推测, 进行了下列实验:取少量白色粉末滴加稀盐酸, 有气泡产生. 上述实验可以得出的结论是 , 理由是 .(2)为进一步探究该白色粉末中是否含有氢氧化钠, 该同学又进行了下列实验:取少量白色粉末溶于水, 加入澄清石灰水至恰好完全反应. 取上层清液滴入酚酞试液, 溶液呈红色.他得出白色粉末中还存在氢氧化钠的结论, 你认为是否正确并说明理由.5、(6分)端午阳节后,小丽带着快乐的心情返回学校。
当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。
【提出问题】这瓶NaOH溶液一定变质了,其变质程度如何呢【提出猜想】小丽的猜想:NaOH溶液部分变质你的新猜想:。
_____________________________。
【实验反思】⑴下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代小丽实验中CaCl2溶液的是_____ ___(填序号)。
⑵小丽第二次滴加的试剂除用指示剂外,还可以用________________替代。
【拓展应用】保存NaOH溶液的方法是。
6.(8分)氢氧化钙和氢氧化钠都因与空气中的二氧化碳反应而变质.对实验室中的两份已变质的氢氧化钙和氢氧化钠固体,某同学提出了猜想并探究其组成,请你与他一起完成探究过程.(1)对已变质的氢氧化钙进行探究[猜想]①可能完全变成了碳酸钙.②可能部分变质,其成分是氢氧化钙和碳酸钙的混合物.[猜想]①可能完全变成了碳酸钠.②可能部分变质,其成分是。

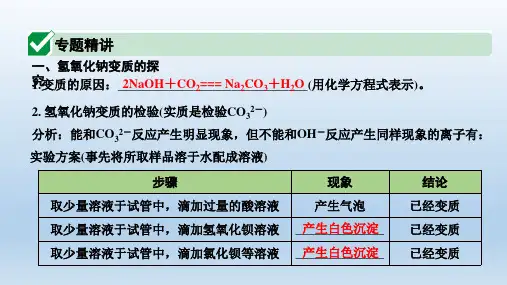
【2022年中考复习】氢氧化钠和氢氧化钙的变质问题探究一、氢氧化钠变质的知识归纳氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、除去杂质得到就纯净的氢氧化钠。
变质程度分别有:①全部变质:Na2CO3;②部分变质:N a2CO3和NaOH。
1.氢氧化钠变质的原因:如果敞口放置,与空气中的二氧化碳反应,生成了碱性的碳酸钠。
化学原理用化学方程式表示为:2NaOH+CO2=Na2CO3+ H2O2.检验氢氧化钠是否变质的方法(分别滴加酸、碱、盐溶液,各为一种方法)。
取少量样品于试管中,滴加足量稀盐酸(或者稀硫酸),如果产生气泡,说明已变质。
无明显现象,说明未变质。
化学原理用化学方程式表示为:Na2CO3+ 2HCl = 2NaCl + H2O + CO2↑。
②取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生白色沉淀,说明已变质。
化学原理用化学方程式表示为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③取少量样品于试管中,滴加氯化钙溶液(或者硝酸钙等其它可溶性钙盐、钡盐溶液)。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
3.检验氢氧化钠变质程度的方法:取少量样品于试管中,滴加足量的中性的CaCl2溶液,有白色沉淀生成;过滤,向滤液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
分析原理:⑵氢氧化钠和变质后生成的碳酸钠溶液都呈碱性,滴加足量的氯化钙溶液是为了除尽生成的碳酸钠,这时会产生白色沉淀,然后滴加酚酞溶液,如果溶液呈红色,说明溶液呈碱性,有未变质的氢氧化钠,部分变质。
如果溶液不变红,说明没有氢氧化钠了,完全变质了。
化学原理用化学方程式表示为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
还可以加入:MgCl2(白色沉淀)、CuCl2(蓝色沉淀)、FeCl3(红褐色沉淀)、FeCl2(白色沉淀)、NH4Cl(刺激性气味)、紫色石蕊溶液等。



初三化学专题复习—NaOH 、Ca(OH)2变质问题【探究1:NaOH变质问题】氢氧化钠没密封保存会因吸收空气中的二氧化碳,生成碳酸钠而变质。
2NaOH+CO2===Na2CO3+H2O。
一、氢氧化钠的变质存在这样三种情况(猜想):(1)没有变质:(成分NaOH)(2)部分变质:(成分NaOH 和Na2CO3)(3)完全变质:(成分Na2CO3)二、证明变质:(取样—-—-加试剂-——说操作——-描现象———下结论)检验是否有碳酸钠有三种不同的方法:(1)加入盐酸有气泡冒出:2HCl + Na2CO3=2NaC l+ H2O+CO2↑(2)加入石灰水有沉淀产生:Ca(OH)2 + Na2CO3 = CaCO3↓+2NaOH(3)加入氯化钙有沉淀产生:Na2CO3 +CaCl2= CaCO3↓+2NaCl取少许固体物质溶于水,配成溶液与试管中;可分别向其中滴加酸、碱、盐溶液中的一种。
【方法(1)】:取少许固体物质溶于水,配成溶液与试管中,向其中滴加稀盐酸或稀硫酸,如果产生气泡,说明已经变质。
原理:碳酸钠会与酸反应生成二氧化碳气体氧化钠与酸反应没有明显现象。
Na2CO3+2HCl=== 2NaCl+H2O+ CO2↑〖N l== NaCl+H2O〗【方法(2)】:取少许固体物质溶于水,配与试管中,向其中滴加氢氧化钡溶液或氢氧化如果产生白色沉淀,说明已经变质。
原理:碳酸钠会与氢氧化钡或氢氧化钙反应白色沉淀,而氢氧化钠与氢氧化钡或氢氧化钙应,没有明显现象。
Na2CO3+Ba(OH)2== BaCO3↓+ 2NaOH;NaO (OH)2≠【方法(3)】:取少许固体物质溶于水,液与试管中,向其中滴加氯化钡溶液或氯化钙(或硝酸钡等其他可溶性钙盐、钡盐溶液),生白色沉淀,说明已经变质.原理:碳酸钠会与氯化钡或氯化钙反应生沉淀,而氢氧化钠与氯化钡或氯化钙不反应,显现象。
Na2CO3+BaCl2== BaCO3↓+ 2NaCl;NaOH+ 2≠〖但是不能加指示剂来判断,因为NaOH 和3的溶液都显示碱性〗三、确定成分1. 没有变质(成分NaOH)的探究方法:取少许固体物质溶于水,配成溶液置与试管中,向其中滴加氯化钙溶液看到溶液无变化,滴无色酚酞试液显红色,说明没变质;Na2CO3+CaCl2== CaCO3↓+ 2NaCl ;NaOH+ Ca C l2≠2. 部分变质(成分NaOH 和Na2CO3)的探究方法:取少许固体物质溶于水,配成溶液与试管中,向其中滴加足量的氯化钙溶液,溶液变浑浊,向反应后的溶液滴加无色酚酞试液,溶液显红色,说明是部分变质;Na2CO3+CaCl2== CaCO3↓+ 2NaCl3。
一、氢氧化钠和氢氧化钙变质(理论)氢氧化钠变质:是因为与空气中的反应生成。
化学方程式1.氢氧化钠变质证明方法:a),滴加 (或者稀硫酸),如果产生,说明。
方程式和b)取少量样品于试管中,滴加氢氧化钙溶液(或者氢氧化钡溶液),如果产生,说明已变质。
方程式和c),滴加或硝酸钙)溶液,如果有产生,说明NaOH已经变质:方程式或2.氢氧化钙变质氢氧化钙变质是因为与空气中的反应生成。
证明方法:,加入,如果有气泡产生,说明氢氧化钙已经变质:方程式3.氢氧化钠固体和氢氧化钙固体变质时,固体质量都会。
二、氢氧化钠和氢氧化钙部分变质1.氢氧化钠部分变质的证明方法:①,(如果是固体,就需要加适量,使固体),加2.(或硝酸钙)溶液,如果有产生,说明有存在:方程式:或②,向,如果滤液变红,说明存在,氢氧化钠。
反之,如果滤液无明显现象,完全变质。
3.氢氧化钙固体部分变质的证明方法:①,加适量水使固体完全溶解,加入,如果有气泡产生,说明存在:方程式②,,如果闻到味,说明存在,氢氧化钙部分变质:方程式或3.如何除去部分变质的氢氧化钠中的碳酸钠。
,然后,就得到氢氧化钠溶液,再,就得到氢氧化钠固体。
反应方程式(注意:①不能选用盐酸或硫酸等酸液,因为酸与碳酸钠反应的同时也会与氢氧化钠反应,而且会生成NaCl或Na2SO4,引入了。
②不能用氯化钙等盐溶液,因为它们会碳酸钠反应生成了,引入了新的杂质。
)※专项训练※1、化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:[提出问题1] 该氢氧化钠溶液是否变质了呢?[实验探究1]实验操作实验现象实验结论取少量该溶液于试管中,向溶液中滴加有气泡冒出。
氢氧化钠溶液一定变质了。
稀盐酸,并不断振荡。
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?[猜想与假设] 猜想1:氢氧化钠溶液部分变质。
猜想2:氢氧化钠溶液全部变质。
[查阅资料] (1)氯化钙溶液呈中性。
实验探究:有关氢氧化钠和氢氧化钙变质的探究(一)练习题组A1.(2012年湛江)实验室有一瓶保管不当的试剂(如右图),其残缺的标签中只剩下“Na”和“10%”的字样。
已知它是无色液体,是初中化学常用的试剂。
小欣和小芳同学很感兴趣,决定对其成分进行探究。
【提出猜想】(1)这瓶试剂可能是什么溶液呢?①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液。
(2)根据受损标签的情况判断,这瓶试剂不可能是________(填字母代号)。
A.酸B.碱C.盐【收集资料】Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.测定室温(20 ℃)时,四种物质的溶解度的数据如下:物质NaCl NaOH Na2CO3 NaHCO3溶解度/g 36 109 215 9.6【得出结论】(3)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是________(填物质名称)。
【设计实验】(4)①小芳用胶头滴管吸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是______。
②小欣为了检验该溶液是NaOH溶液还是Na2CO3溶液,她又进行了如下实验:操作步骤实验现象结论及化学方程式取样于试管中,滴加氢氧化钙溶液__________________ 猜想②正确,相关的化学方程式:__________________________________________________________________(5)请你选择与小欣不同类别的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择__________ 溶液。
2.(2013年广州)实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。
某研究性学习小组发现一瓶未密闭保存的KOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH和K2CO3; 假设3:只含K2CO3。
学习目标:
1识记氢氧化钠和氢氧化钙的主要的性质。
2.能灵活运用酸碱盐的相关性质分析问题。
学习重难点:
熟练运用氢氧化钠和氢氧化钙的变质分析问题学习过程及
要求:
一.基础知识梳理(5分钟)
1、氢氧化钠的变质及检验
2.氢氧化钙的变质及检验
注意:氧化钙变质后的成分可能是氧化钙、氢氧化钙、碳酸钙等。
4 •因氢氧化钠、氢氧化钙、氧化钙能与空气中的成分发生反应,因而需___________________
题型点拨
题型1氢氧化钠变质
【例1】(湖南娄底)化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1 :氢氧化钠溶液部分变质;猜想 2 :氢氧化钠溶液全部变质。
【查阅资料】(1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:
CaCb+ NE2CG=CaCQj+ 2NaCI
【实验探究2】
【实验结论】该氢氧化钠溶液____________________ (填“部分”或“全部”)变质
【反思与评价】(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学^方式:
(2)在上述【实验探究2】中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案(填“可行”或“不可行”)。
【理解与应用】氢氧化钠溶液容易变质,必须密封保存。
实验室必须密封保存的药品还有很多,试另举一例:___________________________________________________
点拨:检验氢氧化钠是否变质,滴加足量的盐酸观察是否有气泡产生便可以知道。
而检验部分变质还是全部变质,就需要用到可溶且中性钙盐、钡盐。
注意不能用氢氧化钙和氢氧化钡,因为它们与碳酸钠反应都生成
NaOH干扰氢氧化
钠是否完全变质的确定。
题型2氢氧化钙变质
【例2】小明和小艳在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟石灰样品已经变质。
小艳同学不同意他的判断,你认为小艳
同学的理由是________________________
针对该熟石灰样品的成分同学们展开了讨论,请你参与讨论并完成实验报告
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(0H)2;乙同学猜想是CaCO;
你认为是 _________________________________________________________
熟石灰
题型3生石灰变质
【例3】“旺旺雪饼”袋内有一个小纸袋,上面写着“干燥剂,主要成分是生
石灰”。
(1)生石灰(CaO)可作干燥剂的理由是_______________________________ 用化学方
程式表示)
(3)我对它还有一个要再探究的新问题:变质后的物质中有多少碳酸钙生成?
(或完全变质需要多长时间?或此时的固体是否全部变成碳酸钙……)
点拨:氧化钙溶于水中能放出大量的热,若把样品溶于水中容器不发烫,证明没有氧化钙存在。
检验是否变成了氢氧化钙还是碳酸钙,或是两者都有,可用检验氢氧化钙变质的方法。
中考链接
1. (2014) (4分)NaOH是化学实验中常用的试剂。
(1)将某NaOH溶液逐滴滴人一定量的某盐酸中,右边图像合理的是 ____________________
(填“甲”或“乙”) 。
(2)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因。
(3)向足量某NaOH溶液中通入CO,反应后溶液中的溶质可能只有NaCO,也可能还有NaOH请设计实验检验溶质的成分,简要写出实验步骤、现象和结论。
(提示:NaCO溶液呈碱性)
2. (2015) (4 分)已知2NQQ+2HO=4NaOH+0; 2Ns2Q+2CO=2NaCO+Q。
实验室敞口放置的过氧化钠(NaO)已部分变质,取少量该固体样品于试管中,加足量水,可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要写出实验步骤和现象)
3.(2016)(4)下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
①B装置玻璃管里可观察到的现象是______________________
②C装置中反应的化学方程式为__________________________
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案, 简要写出实验步骤、现象和结论。
(提示:Na2CO3 溶液呈碱性)
4. (2017)为了除去粗盐中CaC b、MgC2、NaSQ等可溶性杂质,需进行如下操作:①溶解;②依次加过量的
BaCb、NaQH NaCQ溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。
[提示:Mg(QH)、BaSG BaCQ难溶于水;微溶物不形成沉淀;NaCQ溶液呈碱性]
1)以上操作中所发生的复分解反应共有 ______________ 个
(2)操作①、③、⑤要用到同一种玻璃仪器,该仪器在操作⑤中的作用是什么?
(3)请设计实验方案证明操作③所得溶液中含有NaQH (写出实验步骤和现象)。