氢氧化钠和氢氧化钙的比较
- 格式:ppt
- 大小:104.50 KB
- 文档页数:2


氢氧化物的物理性质氢氧化物是一类化合物,由氢元素和氧元素组成,化学式为OH-。
常见的氢氧化物包括氢氧化钠、氢氧化钙、氢氧化铜等。
这些物质在自然界中广泛存在,也是人类日常生活中常用的化学品。
本文将围绕氢氧化物的物理性质进行分析和探讨。
1. 相态和颜色氢氧化物通常呈固态或者溶液态存在。
在常温下,大多数氢氧化物是白色固体,例如氢氧化钙、氢氧化铝等。
但也有一些氢氧化物呈现其他颜色,比如氢氧化铜呈现蓝色,氢氧化钴呈现粉红色等。
当氢氧化物溶解于水中时,其溶液呈现透明或者浑浊的状态,浓度越高,溶液越浑浊。
2. 密度和溶解度氢氧化物的密度一般较高,比水大。
例如,氢氧化钠的密度约为2.13 g/cm³,高于水的密度。
而氢氧化铝的密度约为2.42 g/cm³,同样也高于水。
这是因为氢氧化物分子中含有较重的原子,使得其相对密度较大。
氢氧化物在水中的溶解度与温度有关。
通常情况下,氢氧化物在水中可以完全溶解,并产生氢氧化物离子(OH-)。
但溶解度随温度的升高而增大。
温度越高,溶解度越大。
3. 熔点和沸点不同的氢氧化物熔点和沸点有所不同。
以氢氧化钠为例,其熔点约为318°C,沸点约为1388°C。
而氢氧化钙的熔点约为580°C,沸点约为2850°C。
可以看出,氢氧化物的熔点和沸点普遍较高,需要较高的温度才能使其熔化或者汽化。
4. pH值氢氧化物溶液呈碱性,可以通过测量其pH值来反映其酸碱性。
氢氧化物溶液的pH值通常大于7,越接近14则越强碱。
例如,氢氧化钠溶液的pH值一般在12-14之间,而氢氧化铝溶液的pH值较低,约为8-9之间。
5. 导电性氢氧化物溶液具有良好的导电性。
这是因为氢氧化物在水中解离为氢氧化物离子(OH-),这些离子可以运动并带电。
氢氧化物溶液中的离子具有良好的导电性,能够导电。
但固体状态的氢氧化物通常是不导电的。
总结起来,氢氧化物具有一系列的物理性质,包括相态和颜色、密度和溶解度、熔点和沸点、pH值以及导电性。


氢氧化钠、氢氧化钙哪个碱性更强徐州一中高一21班:张天野初中化学曾说过:溶液碱性强弱与其中OH-浓度有关,OH-浓度越大,碱性就越强。
而且初中化学里面介绍:氢氧化钙是微溶的。
初中实验也似乎证明了通过PH试纸显示,氢氧化钠的水溶液中OH-浓度远远大于氢氧化钙的水溶液的OH-浓度,结论似乎显而易见:氢氧化钠比氢氧化钙碱性强。
这个感觉伴随了整个初三化学的学习过程。
暑假开始了我也开始了高一新课程的预习,各种新知识新观念天天在脑海中激烈地碰撞着,甚至是冲突着,尤其是这个碱性强弱的问题:怎么氢氧化钙竟然是强碱,为什么呢?!带着一股子拧劲我一个通宵在百度上面恶补了这方面的知识,原来关于碱性强弱的讨论在百度上也是如此的激烈啊。
下面是我的学习体会,请老师给予指正。
通过网络学习的结论:氢氧化钙碱性比氢氧化钠更强1、首先,先说说我们最熟悉的金属活动性:钾、钡、钙、钠。
(由强到弱)也就是化学元素周期表所说:同周期,从左到右,元素对应的水化物的的酸性增强(碱性减弱);同主族,从上到下,元素对应的水化物的碱性增强(酸性减弱)。
金属活动性就是综合两个因素的综合排序,我们中学四个最常见的强碱:氢氧化钾,氢氧化钡,氢氧化钙,氢氧化钠。
这四个的碱性依次减小,但都是强碱(钾钙钡钠正好符合我们的金属活动性顺序)。
所以结论:氢氧化钙碱性强于氢氧化钠。
2、全面深入地理解下面几个方面的概念就可以更好地理解碱性强弱这个概念了。
关于强碱:在水中或熔融状态下完全电离,且电离出的阴离子只有氢氧根离子的无机化合物。
一方面:溶解不等于电离,一种物质完全溶解到一种溶剂中,但不一定完全电离。
溶解是一群分子均匀分布到另一群分子的过程。
而电离则是电解质中的阴阳离子被分开了,变成自由移动的阴离子和阳离子。
因此,溶解是分子的分布问题,电离是“分子”的拆开问题。
这显然是两种不同的过程。
虽然氢氧化钙弱溶于水,但是溶在水中的那部分是完全电离的,所以是强碱。
碱性强弱看的最终是电离程度,实质也就是初中书本所说:OH-浓度有关,OH-浓度越大,碱性就越强。

氢氧化钠氢氧化钙成本-概述说明以及解释1.引言1.1 概述氢氧化钠和氢氧化钙是广泛应用于各个领域的化学物质。
氢氧化钠(NaOH)通常被称为苛性钠或烧碱,而氢氧化钙(Ca(OH)2)则被称为石灰。
它们都是强碱,具有重要的酸碱中和和中和反应的性质。
在工业生产中,氢氧化钠和氢氧化钙被广泛应用于多个工艺和行业。
氢氧化钠是一种重要的化学原料,用于制造清洁剂、肥皂、纸浆和纸张、染料、塑料等。
氢氧化钙则是建筑业中常用的物质,被用作水泥和石膏的生产原料,也是土壤改良剂和废水处理中常见的添加剂。
在氢氧化钠的生产过程中,常见的方法包括氯碱法和电解法。
氯碱法利用氯气和氢气的电解反应产生氢氧化钠,但这种方法会产生大量的氯气和氯酸,对环境造成不可忽视的危害。
电解法则利用电流通过含有氯化钠的溶液,将氯离子和钠离子分离出来,从而产生氢氧化钠。
这种方法相对环保,但生产成本相对较高。
氢氧化钙的生产过程则更为简单。
它通常是通过将水与生石灰反应来制备的。
生石灰是一种由石灰石加热得到的物质,它与水反应会产生氢氧化钙。
这种反应相对简单且成本较低,因此氢氧化钙的生产成本一般较为稳定。
市场价格方面,氢氧化钠和氢氧化钙都受到供需关系的影响。
随着工业的迅速发展,对氢氧化钠和氢氧化钙的需求也在逐渐增加。
因此,在市场竞争激烈的情况下,其价格也会有所波动。
综上所述,氢氧化钠和氢氧化钙作为重要化学物质,具有广泛的应用领域和市场需求。
它们的成本受到生产过程、市场供需以及其他因素的影响。
了解这些因素对氢氧化钠和氢氧化钙的成本具有重要意义,可帮助我们更好地理解其在各个行业中的应用和市场价值。
1.2文章结构文章结构部分的内容可以包括以下几点:1.2 文章结构本文分为引言、正文和结论三个部分。
引言部分提供了对整篇文章的概述和目的进行介绍。
首先,会对氢氧化钠和氢氧化钙这两种化学物质进行简要介绍,包括其用途和重要性。
然后,会说明文章的结构和内容安排。
正文部分分为2.1 氢氧化钠的成本和2.2 氢氧化钙的成本两个小节。

氢氧化钠氢氧化钙变质问题
氢氧化钠和氢氧化钙是两种常见的化学物质,它们在工业生产
和日常生活中都有着重要的应用。
然而,当它们发生变质时可能会
带来一些问题。
首先,让我们了解一下氢氧化钠和氢氧化钙的性质。
氢氧化钠,化学式为NaOH,是一种强碱,常见的用途包括制造肥皂、纸张和清
洁剂等。
而氢氧化钙,化学式为Ca(OH)2,也被称为熟石灰,常用
于水处理、建筑材料和农业等领域。
当氢氧化钠和氢氧化钙发生变质时,可能会导致以下问题:
1. 化学反应,氢氧化钠和氢氧化钙在一定条件下可能会发生化
学反应,产生新的化合物,这可能会影响到原本预期的使用效果。
2. 安全隐患,变质后的氢氧化钠和氢氧化钙可能会导致安全隐患,如释放有害气体或导致火灾等危险情况。
为了避免氢氧化钠和氢氧化钙的变质问题,我们需要注意以下
几点:
1. 储存条件,储存氢氧化钠和氢氧化钙时,应该避免高温、潮湿和阳光直射,以防止其发生变质。
2. 使用期限,在使用氢氧化钠和氢氧化钙时,应该注意其使用期限,避免使用过期或变质的产品。
3. 化学储存分开,在储存氢氧化钠和氢氧化钙的时候,应该避免与其他化学品混合储存,以免发生意外的化学反应。
总的来说,氢氧化钠和氢氧化钙是重要的化学物质,但是在使用和储存时需要注意其变质问题,以确保安全和有效地使用。
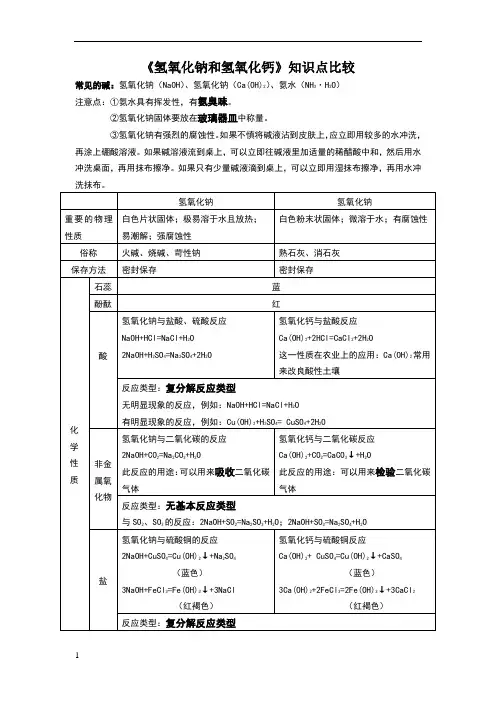
《氢氧化钠和氢氧化钙》知识点比较
常见的碱:氢氧化钠(NaOH)、氢氧化钠(Ca(OH)2)、氨水(NH3·H2O)
注意点:①氨水具有挥发性,有氨臭味。
②氢氧化钠固体要放在玻璃器皿中称量。
③氢氧化钠有强烈的腐蚀性。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲
碱的通性
碱之所以具有共同的相似性,是因为碱在溶液中电离出的阴离子都是共同的的氢氧根离
子。
因此碱的通性,可以认为是氢氧根离子(OH )表现出来的性质。
1. 紫色石蕊试液遇可溶性碱变蓝色,无色酚酞试液遇可溶性碱变红色。
2. 非金属氧化物+碱→盐+H2O
凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物。
由非金属元素组成的酸性氧化物中,多数能溶解于水,并跟水起反应生成对应的水化物—酸。
3. 碱+酸→盐+H2O
4. 碱+盐→新碱+新盐
注意点:
①能跟酸性氧化物反应生成盐和水的碱必须是可溶性碱。
②碱跟盐要发生反应的条件是二者必须可溶且生成物中必须有沉淀、气体、水三者之一。


氢氧化钠和氢氧化钙的反应方程式1. 反应的基本概念嘿,朋友们!今天我们要聊聊氢氧化钠和氢氧化钙之间的化学反应。
这两个化学家族的成员可不是闲人,他们在化学反应中可是各显神通呢!首先,咱们得知道氢氧化钠(NaOH)和氢氧化钙(Ca(OH)₂)这两位主角的基本情况。
氢氧化钠是个性比较强的家伙,常常在我们的清洁用品里露脸,比如说肥皂和洗洁精。
氢氧化钙呢,相对温文尔雅,它常见于建筑和农业中,像是石灰水就是它的“亲戚”。
1.1 氢氧化钠的“性格特点”氢氧化钠,简直就是化学界的“小霸王”,它的溶液是强碱性,能和几乎所有的酸反应,搅得天翻地覆。
它在水中溶解后,会释放出钠离子(Na⁺)和氢氧根离子(OH⁻)。
想象一下,它在水里搅和,泡泡四溅,酥酥的酸碱反应简直让人眼花缭乱。
1.2 氢氧化钙的“风格特点”氢氧化钙则比较低调些,虽然它的溶解度不如氢氧化钠,但在土壤改良和建筑中却是不可或缺的“老前辈”。
它在水中溶解时,放出钙离子(Ca²⁺)和氢氧根离子(OH⁻)。
想象一下它在水中“慢悠悠”地扩散,形成了一种淡淡的碱性环境,十分温和。
2. 反应方程式的揭示接下来,我们来点儿干货——氢氧化钠和氢氧化钙反应的方程式。
其实,这个反应不复杂,主要就是酸碱中和反应的一种。
它们碰面后,就会产生氢氧化钠和氢氧化钙的酸碱反应,形成氢氧化钠和氢氧化钙的沉淀,释放出水。
具体方程式如下:2 NaOH + Ca(OH)2 → Ca(OH)2 + 2 NaOH 。
是不是觉得方程式看起来很简单?其实,它背后藏着化学的奥秘呢!这个反应中,钙离子和氢氧根离子碰撞,形成了氢氧化钙的沉淀,而氢氧化钠的“善后工作”就是留下了原来的碱性。
2.1 实验中的“火花”在实验室里,这两个化学品混合时,你可以看到白色的氢氧化钙沉淀出现,像是大自然的魔法表演。
两者混合时,溶液中的白色沉淀显示了它们的反应过程。
这个过程简单明了,就像两位老朋友见面,聊完天就各自散场,留下的是一片白色的氢氧化钙。

氢氧化钠和氢氧化钙区别方法
氢氧化钠和氢氧化钙是两种常见的碱性化合物,它们在化学性质和用途上有所不同。
以下是它们的区别方法:
1. 化学式:氢氧化钠的化学式为NaOH,氢氧化钙的化学式为Ca(OH)2。
2. 溶解度:氢氧化钠的溶解度相对较高,1克氢氧化钠可以溶解于1毫升水中。
而氢氧化钙的溶解度较低,1克氢氧化钙只能溶解于630毫升水中。
3. 酸碱度:氢氧化钠是一种强碱,可以中和酸性物质。
而氢氧化钙的碱性相对较弱,一般用于中和较弱的酸性物质。
4. 用途:氢氧化钠广泛用于化学实验、肥皂制作、纤维素制造等领域。
而氢氧化钙主要用于水处理、建筑材料、食品添加剂等领域。
总之,氢氧化钠和氢氧化钙虽然都是碱性化合物,但它们在化学性质和用途上有所不同,需要根据具体情况选择使用。
- 1 -。

九年级氢氧化钠和氢氧化钙知识点学习中的困难莫过于一节一节的台阶,虽然台阶很陡,但只要一步一个脚印的踏,攀登一层一层的台阶,才能实现学习的理想。
下面是作者给大家带来的氢氧化钠和氢氧化钙知识点,欢迎大家浏览参考,我们一起来看看吧!中学化学——氢氧化钠属性探究一、名称氢氧化钠俗名苛性钠、烧碱、或火碱二、物理性质氢氧化钠为白色固体,易溶于水,溶解时能放出大量的熱。
它的水溶液有涩味和滑腻感。
氢氧化钠在空气中放置时易潮解,它还有强烈的腐蚀性。
三、固体氢氧化钠为何要密封储存?这有两个原因:一是避免氢氧化钠吸取空气中的水分产生潮解,二是避免氢氧化钠和空气中的二氧化碳反应生成碳酸钠。
四、氢氧化钠为何能做干燥剂?由于氢氧化钠能吸取空气或其它气体中的水分,所以能做干燥剂。
它可用来干燥NH3、O2、H2、CH4等气体,但不能用来干燥CO2、SO2等酸性气体。
五、氢氧化钠在溶解时为何会放出大量的热?这是由于氢氧化钠在溶于水时会产生两个进程:一个是物理进程,即Na﹢和OHˉ在水里的分散进程,这个进程要吸取热量;另一个进程是化学进程,即Na﹢和OHˉ的水合进程,这一进程要放出热量。
并且放出的热远远大于吸取的热,所以氢氧化钠溶解时会产生大量的热。
六、化学性质1、氢氧化钠能使紫色的石蕊试液变蓝色,使无色的酚酞试液变红色。
2、氢氧化钠+酸性氧化物→钠盐+水例如氢氧化钠和二氧化硫反应:2NaOH+SO2=Na2SO3+H2O。
这个反应可用于处理废气二氧化硫。
3、氢氧化钠+酸→盐+水例如氢氧化钠和盐酸反应:NaOH+HCl=NaCl+H2O4、氢氧化钠+某些盐→新碱+新盐例如氢氧化钠和硫酸铜反应:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4说明:碱和盐、盐和盐起反应时必须两边看,前边反应物必须都是可溶的,后边生成物必须符合复分解反应产生的三个条件其中之一。
七、氢氧化钠的用处氢氧化钠是一种重要的化工原料,广泛运用于制肥皂、炼石油、造纸、纺织、印染等各个行业。
酸和碱考点一:常见的酸和碱1.稀盐酸和稀硫酸具有相似的化学性质,其本质原因是()A.都能与指示剂作用B.都能解离出酸根离子C.都能解离出氢离子D.都含有氢元素2.氢氧化钙是一种微溶于水的白色固体粉末。
下列关于氢氧化钙的叙述中正确的是()A.氢氧化钙的俗名叫做生石灰、消石灰B.氢氧化钙粉末可用作某些气体的干燥剂C.氢氧化钙溶液俗称石灰水,其溶质的溶解度随温度的升高而增大D.农业上用石灰乳和硫酸铜溶液配制农药波尔多液3.对比是学习化学的重要方法。
下列关于氢氧化钠和氢氧化钙的比较,不完全正确的是()A.分类:氢氧化钠和氢氧化钙都是常见的碱,其溶液都使紫色石蕊溶液变蓝B.性质:氢氧化钠和氢氧化钙化学性质相似,是因为其溶液中都含有金属离子C.用途:炉具清洁剂中氢氧化钠可去油污;氢氧化钙溶液可检验二氧化碳D.保存:氢氧化钠溶液和氢氧化钙溶液敞口放置都会变质,需要密封保存4.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。
下列说法错误的是()A.该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中B.m点表示氧化铜与稀盐酸恰好完全反应C.m点和n点对应溶液中铜元素的质量不相等D.m点和n点对应溶液蒸发结晶后得到的固体成分相同5.盐酸是一种重要的化工产品。
下列有关盐酸的用途中,能用硫酸代替盐酸的是()A.金属表面除锈B.实验室制取二氧化碳C.制造药物氯化锌D.除去氯化钠中的少量氢氧化钠6.能把稀硫酸、氢氧化钠和氯化钠三种溶液一次性鉴别出来的试剂是()A.紫色石蕊溶液B.无色酚酞溶液C.碳酸钠溶液D.硝酸钾溶液7.下列有关氢氧化钠性质的说法错误的是()A.氢氧化钠有腐蚀性B.固体氢氧化钠有挥发性C.氢氧化钠能吸收二氧化碳而变质D.固体氢氧化钠能吸收水蒸气而潮解8.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是()A.浓盐酸B.氯化钾溶液C.浓氨水D.氢氧化钠溶液9.危险化学品要在包装标签上印有警示性标志。
第十单元课题1常见的酸和碱同步测试题一、选择题1.下列“水”能使紫色石蕊溶液变蓝的是()A.氨水 B.汽水 C.冰水 D.糖水2.某同学在化学晚会上用毛笔蘸取一种无色液体在白纸上写了“化学魔术”四个字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四个字。
该同学所用的两种无色液体可能是()A.NaOH溶液、酚酞溶液 B.白醋、紫色石蕊试液C.食盐水、酚酞溶液D.“雪碧”饮料、酚酞溶液3.下列关于盐酸、硫酸的叙述正确的是()A.打开浓盐酸试剂瓶瓶塞,瓶口冒白雾B.浓盐酸敞口放置后,其溶质质量分数增大C.浓硫酸具有脱水性,故能做干燥剂D.浓硫酸溶于水时会吸热4.氢氧化钙是一种微溶于水的白色固体粉末。
下列关于氢氧化钙的叙述中正确的是()A.氢氧化钙的俗名叫做生石灰、消石灰B.氢氧化钙粉末可用作某些气体的干燥剂C.氢氧化钙溶液俗称石灰水,其溶质的溶解度随温度的升高而增大D.农业上用石灰乳和硫酸铜溶液配制农药波尔多液5.对比是学习化学的重要方法。
下列关于氢氧化钠和氢氧化钙的比较,不完全正确的是()A.分类:氢氧化钠和氢氧化钙都是常见的碱,其溶液都使紫色石蕊溶液变蓝B.性质:氢氧化钠和氢氧化钙化学性质相似,是因为其溶液中都含有金属离子C.用途:炉具清洁剂中氢氧化钠可去油污;氢氧化钙溶液可检验二氧化碳D.保存:氢氧化钠溶液和氢氧化钙溶液敞口放置都会变质,需要密封保存6.下列物质长期放置在空气中,溶液质量因发生化学变化而减小的是()A.NaCl溶液B.NaOH溶液C.浓硫酸D.石灰水7.要使如图装置中的小气球鼓起来,则使用的固体和液体可以是()①石灰石和稀盐酸②锌和稀硫酸③固体氢氧化钠和水④生石灰和水⑤硝酸铵和水A.①②③④B.①②③C.①②④⑤D.②③④8.向CuO和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤,在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化。
据此判断,下列结论正确的是()A.滤液中一定含有FeSO4、H2SO4B.滤渣里一定有CuC.滤液中可能有CuSO4、H2SO4D.滤渣里一定有Cu和Fe二、非选择题9.硫酸是一种实验室常用的化学试剂,许多化学实验需要使用硫酸。
常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。