高考化学二轮复习知识点专题解析5---浓度、压强对化学平衡移动的影响
- 格式:pdf
- 大小:383.32 KB
- 文档页数:16


高考化学第二轮复习化学平衡常数知识点总结均衡常数一般有浓度均衡常数和压强均衡常数。
以下是化学均衡常数知识点总结,请考生认真学习。
1、化学均衡常数(1)化学均衡常数的化学表达式(2)化学均衡常数表示的意义均衡常数数值的巨细可以反应可逆反响举行的程度巨细,K 值越大,反响举行越完全,反响物转化率越高,反之则越低。
2、有关化学均衡的基本谋略(1)物质浓度的变化干系反响物:均衡浓度=肇始浓度-转化浓度生成物:均衡浓度=肇始浓度+转化浓度此中,各物质的转化浓度之比即是它们在化学方程式中物质的计量数之比。
(2)反响的转化率():= 100%(3)在密闭容器中有气体到场的可逆反应,在谋略时通常用到阿伏加德罗定律的两个推论:恒温、恒容时:恒温、恒压时:n1/n2=V1/V2(4)谋略模式浓度(或物质的量) aA(g)+bB(g) cC(g)+dD(g)肇始 m n O O转化 ax bx cx dx均衡 m-ax n-bx cx dx(A)=(ax/m)100%(C)= 100%(3)化学均衡谋略的要害是准确掌握相关的基本概念及它们相互之间的干系。
化学均衡的谋略步骤,通常是先写出有关的化学方程式,列出反响肇始时或均衡时有关物质的浓度或物质的量,然后再议决相关的转换,分别求出其他物质的浓度或物质的量和转化率。
概括为:建立解题模式、建立均衡状态方程。
说明:①反响肇始时,反响物和生成物可能同时存在;②由于肇始浓度是人为控制的,故不同的物质肇始浓度不一定是化学计量数比,若反响物肇始浓度呈现计量数比,则隐含反响物转化率相等,且均衡时反响物的浓度成计量数比的条件。
③肇始浓度,均衡浓度不一定呈现计量数比,但物质之间是按计量数反响和生成的,故各物质的浓度变化一定成计量数比,这是谋略的要害。
高考化学2019第二轮温习化学均衡常数知识点总结的内容便是这些,查字典化学网预祝考生可以考上理想的大学。

第1课时浓度、压强变化对化学平衡的影响——浓度变化对化学平衡的影响一、教学目标:知识与技能:知道化学平衡移动的概念。
理解浓度、温度、压强等因素对化学平衡的影响,并能判断平衡移动的方向。
过程与方法:通过化学实验的演示,探究浓度对化学平衡的移动的影响。
创设相关的生活中的情境,加深学生对相关化学知识的理解。
情感态度与价值观:通过实验直观反映相关的化学知识,增强学生对化学的学习兴趣。
重点:化学平衡移动的概念并判断平衡是如何移动的。
浓度、温度、压强等因素对平衡移动的影响。
难点:浓度对化学平衡的移动的速率图的绘画。
教学方法:讲授法,实验法,多媒体辅助法二、教学过程环节一:回顾旧知,引入新课【回顾旧知】:我们学习了可逆反应的概念,同时我们也知道了可逆反应是有一定的限度的,当反应进行到一定的程度时,反应就会处于化学平衡状态。
同时我们也具体的了解了化学平衡状态下的反应所具备的五个特征,它们分别是?(逆,动,等,定,变)。
每个字代表的具体的含义大家得记住的,它的最后的一个特征是“变”,我们一起来说下变表达的含义。
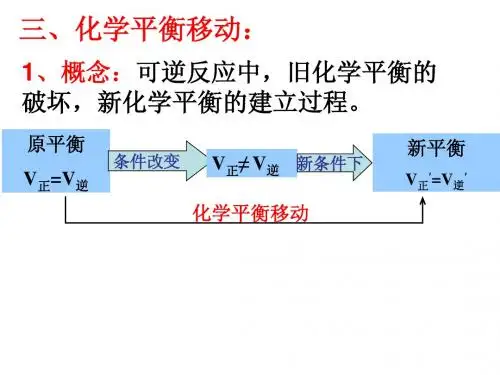
所谓的变指的是当反应条件改变时,原的化学平衡状态被破坏,一段时间后达到新的平衡状态。
我们称这个过程为化学平衡的移动。
【引入新课】:今天我们就需要具体的学习下关于化学平衡的移动是如何进行的。
环节二:概念解析,层层深入【教师活动】:接下来我们结合PPT上的这个移动的过程一起来看下,首先是经过一段时间,反应达到平衡,改变外界的条件,然后促使v正不等于v逆。
这个时候平衡就被破坏了,但我们知道可逆反应是有限度的,所以经过一段时间后,它就会达到另一种新的平衡。
我们把这个过程称为平衡的移动。
那么现在我们为文字来准确的给它下个定义。
即改变外界条件,破坏原有的平衡状态,建立新的平衡状态的过程。
现在我们在集合PPT上的这个过程再具体的分析下平衡会如何移动的。
那么只有原有的反应平衡被破坏了,平衡才会移动,那么平衡被破坏体现在正反应速率和你反应速率不相等。


2022年高考化学二轮复习专题——化学反应原理综合题1.(2021·全国·高考真题)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。
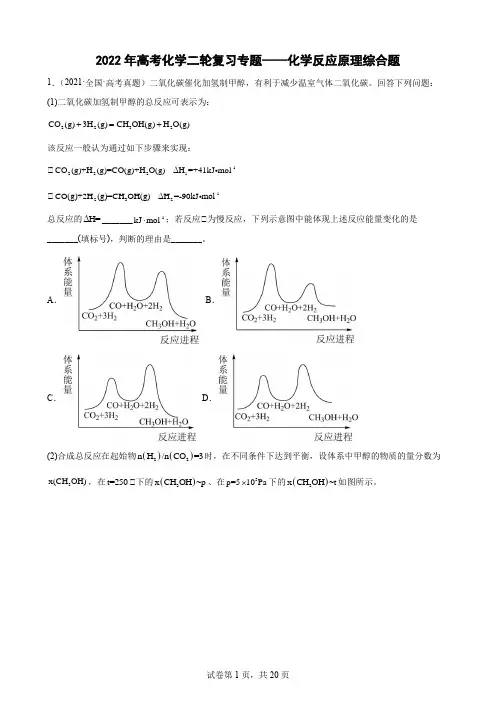
回答下列问题: (1)二氧化碳加氢制甲醇的总反应可表示为: 2232CO (g)3H (g)CH OH(g)H O(g)+=+该反应一般认为通过如下步骤来实现:①-12221CO (g)+H (g)=CO(g)+H O(g)ΔH =+41kJ mol ①-1232CO(g)+2H (g)=CH OH(g)ΔH =-90kJ mol总反应的ΔH=_______-1kJ mol ⋅;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填标号),判断的理由是_______。
A .B .C .D .(2)合成总反应在起始物()()22n H /n CO =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为3x(CH OH),在t=250①下的()3x CH OH ~p 、在5p=510Pa ⨯下的()3x CH OH ~t 如图所示。
①用各物质的平衡分压表示总反应的平衡常数,表达式p K =_______; ①图中对应等压过程的曲线是_______,判断的理由是_______;①当()3x CH OH =0.10时,2CO 的平衡转化率α=____,反应条件可能为___或___。
2.(2021·福建·高考真题)(1)元素M 的离子与NH 4+所含电子数和质子数均相同,则M 的原子结构示意图为_ 。
(2)硫酸铝溶液与过量氨水反应的离子方程式为 _。
(3)能证明Na 2SO 3溶液中存在SO 32-+H 2OHSO 3-+OH -水解平衡的事实是_(填序号)。
A .滴人酚酞溶液变红,再加入H 2SO 4溶液后红色退去B .滴人酚酞溶液变红,再加入氯水后红色退去C .滴人酚酞溶液变红,再加入BaCl 2溶液后产生沉淀且红色退去(4)元素X 、Y 在周期表中位于向一主族,化合物Cu 2X 和Cu 2Y 可发生如下转化(其中D 是纤维素水解的最终产物):① 非金属性X Y(填“>”或“<”)① Cu 2Y 与过量浓硝酸反应有红棕色气体生成,化学方程式为 (5)在恒容绝热(不与外界交换能量)条件下进行2A ( g ) + B ( g )2C ( g ) + D ( s )反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。




化学平衡中的浓度与压力化学平衡是指在封闭容器内化学反应达到动态平衡时,反应物与生成物的浓度保持稳定的状态。
浓度与压力是影响化学平衡的重要因素,它们之间存在着密切的关系。
一、浓度对化学平衡的影响浓度对化学平衡的影响主要体现在平衡位置的改变上。
当我们向平衡体系中添加某种物质时,平衡会向反应生成物的方向移动,以消耗掉这种物质。
相反,若某种物质的浓度减少,平衡就会向反应物的方向移动,以生成更多的这种物质,以达到平衡。
例如,在N2 + 3H2 ⇌ 2NH3的平衡反应中,当我们向平衡体系中添加N2或减少NH3的浓度时,平衡会向反应生成物NH3方向移动,生成更多的NH3。
而当我们向平衡体系中添加NH3或减少N2与H2的浓度时,平衡则会向反应物N2与H2的方向移动,以生成更多的N2与H2。
二、压力对化学平衡的影响压力对化学平衡的影响主要体现在涉及气体的反应中。
根据Le Chatelier原理,增加系统压力会使平衡移动到压力减少的方向,以减少系统总压力。
相反,减小系统压力会使平衡移动到压力增加的方向,以增加系统总压力。
在涉及气体的反应中,平衡位置的改变与气体的摩尔数有关。
根据气体的物理性质,摩尔数越多的气体对总压力的贡献越大。
因此,增加一个摩尔数较多的气体的压力,会使平衡向反应物的方向移动,生成更少的此气体。
减少一个摩尔数较多的气体的压力,会使平衡向生成物的方向移动,生成更多的此气体。
例如,在2SO2 + O2 ⇌ 2SO3的平衡反应中,SO3的生成会导致体系中总摩尔数减少,从而降低体系的压力。
因此,增加体系中SO3的压力会使平衡向反应物SO2与O2的方向移动,生成更多的SO2与O2。
相反,减少体系中SO3的压力会使平衡向生成物SO3的方向移动,生成更多的SO3。
三、浓度与压力之间的关系在涉及气体的反应中,浓度与压力之间存在着一定的关系。
根据理想气体状态方程PV=nRT(P为压力,V为体积,n为摩尔数,R为气体常数,T为温度),可以得到PV与n的关系:PV = (n/V)RT = cRT(c为摩尔浓度)。
2020年高考化学二轮专题复习6:化学反应速率与化学平衡(附解析)考纲指导1.了解化学反应速率的概念及反应速率的定量表示方法。
2.了解化学反应的可逆性及化学平衡的建立。
3.掌握化学平衡的特征,了解化学平衡常数的含义,能够利用化学平衡常数进行相关计算。
4.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
5.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
Ⅰ.客观题(1)考查化学反应速率、化学平衡常数的简单计算。
(2)外界条件对化学反应速率和化学平衡的影响,化学平衡状态的判断。
(3)以图像表格考查化学反应速率、化学平衡的综合应用。
Ⅱ.主观题常常与基本理论,工业生产相联系,通过图像或表格提供信息进行命题,主要考查化学反应速率的表示方法、外界条件对速率和平衡的影响规律、化学平衡常数的应用以及平衡转化率、起始或平衡浓度的计算等。
知识梳理一、化学反应速率及影响因素1.对化学反应速率计算公式的理解对于反应m A(g)+n B(g)===c C(g)+d D(g)(1)计算公式:v (B)=Δc (B)Δt =Δn (B)V Δt 。
(2)同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。
不同物质表示的反应速率,存在如下关系:v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶c ∶d 。
(3)注意事项①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
②化学反应速率是某段时间内的平均反应速率,而不是即时速率,且计算时取正值。
2.外界条件对化学反应速率的影响3.稀有气体对反应速率的影响(1)恒容:充入“惰性气体”总压增大―→物质浓度不变(活化分子浓度不变)―→反应速率不变。
(2)恒压:充入“惰性气体”体积增大物质浓度减小(活化分子浓度减小)反应速率减小。
二、平衡的判定与平衡移动原理1.化学平衡状态的判断标志(1)速率标志①同一物质在同一时间内生成速率与消耗速率相等。