压强对化学平衡的影响.
- 格式:ppt
- 大小:132.00 KB
- 文档页数:4

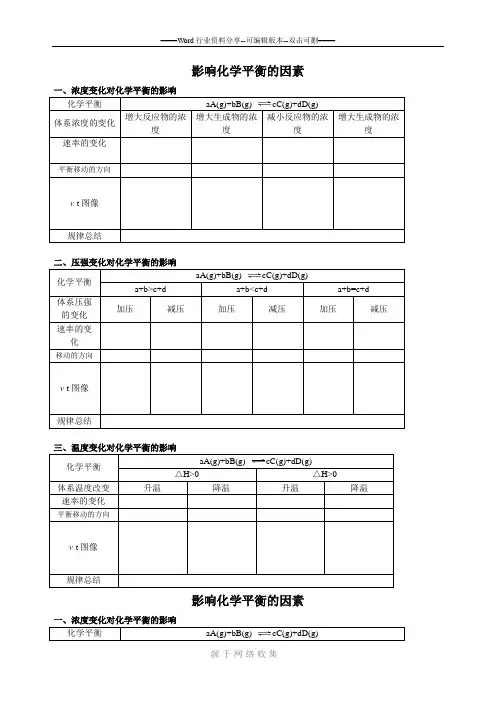
影响化学平衡的因素一、浓度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结三、温度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像规律总结影响化学平衡的因素化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像规律总结。

化学平衡的压强与平衡常数的关系化学平衡是指在封闭系统中,正反应速度相等时,反应物和生成物的浓度保持不变的状态。
在化学平衡中,存在着压强与平衡常数之间的关系,本文将探讨这种关系及其影响因素。
一、压强与平衡常数的定义在考虑气相反应时,压强是一个重要的平衡参数。
对于理想气体反应,我们可以用克氏方程来描述:aA + bB ↔ cC + dD在封闭容器中,气体的压强可以用气体的摩尔分数表示,例如p_A 表示反应物A的分压。
平衡常数K是描述反应物浓度与生成物浓度的比例关系,可以用以下公式表示:K = (p_C^c × p_D^d) / (p_A^a × p_B^b)其中,p_C、p_D、p_A、p_B分别表示生成物C、D和反应物A、B的分压。
二、压强对平衡常数的影响压强对平衡常数有重要的影响,主要体现在以下两个方面。
1. 通过Le Chatelier定律影响平衡常数根据Le Chatelier定律,当系统处于平衡状态时,任何影响平衡的因素产生的效应都会被系统以某种方式来抵消。
对于气相反应来说,增加或减少压强会引起平衡的移动。
当增加反应物的分压时,平衡会向生成物的方向移动,平衡常数增大;反之,当减少反应物的分压时,平衡会向反应物的方向移动,平衡常数减小。
2. 压强决定反应的方向平衡常数还可以用来判断反应的方向。
当反应物和生成物的分压相等时,平衡常数K等于1,此时系统处于平衡状态。
如果反应物的分压大于生成物的分压,平衡常数K大于1,反应会向生成物的方向移动;相反,如果反应物的分压小于生成物的分压,平衡常数K小于1,反应会向反应物的方向移动。
三、其他影响因素除了压强,温度也是影响平衡常数的重要因素。
根据Van't Hoff方程,温度的增加或减小会引起平衡常数的变化。
对于放热反应,温度的升高会使平衡常数减小,反应向反应物的方向移动;对于吸热反应,温度的升高会使平衡常数增大,反应向生成物的方向移动。




温度、压强对二氧化氮、四氧化二氮化学平衡的影响
二氧化氮和四氧化二氮是空气中重要的气体,它们不仅参与全球热量循环,还可能魔发生
反应,产生臭氧和污染物。
因此,了解它们的化学平衡特性非常重要。
参与二氧化氮和四
氧化二氮之间的化学反应的是生物酶、温度和压强。
温度是影响这种反应的重要因素,当温度升高时,四氧化二氮的转化率就会增加,从而改变反应的平衡。
与缩小反应物分子空间和增加化学反应速率有关的是压强。
当压强升高时,含气量增加,因此也会影响反应平衡。
在这种情况下,当温度升高时,二氧化氮和四氧化二氮之间的反应偏向越来越强烈,从而导致四氧化二氮更容易生成。
并且温度升高时,二氧化氮转化率很快。
这就意味着二氧化氮被更快地消耗掉。
增加压强会使含气量增加,使反应物的活化能降低,从而使反应的速
率增加,进而增加2O2的转化率。
总之,温度和压强对二氧化氮和四氧化二氮之间的化学平衡有很大的影响。
因此,温度和压强必须适当地调控,才能使这种反应正确地恢复平衡。



压强变化对化学平衡的影响化学平衡这个话题听上去可能有点严肃,但其实我们可以轻松聊聊它,尤其是压强变化对化学平衡的影响。
想象一下,你在厨房做饭,正在煮一锅汤。
汤里的气味四处飘散,惹得你肚子咕噜咕噜叫。
突然,你打开锅盖,蒸汽涌出,那一瞬间,锅里的气压就发生了变化,对吧?化学反应也是一样,压强的变化会让反应的结果大相径庭,就像你在厨房里加了太多盐,瞬间味道变得咸得要命。
咱们得搞清楚,什么是化学平衡。
简单来说,就是反应物和生成物之间达成一种“默契”,它们的浓度保持不变。
就像两个人谈恋爱,吵吵闹闹,但总是能和好如初。
当你改变了压强,这种“恋爱关系”就可能受到影响,反应物可能会向生成物倾斜,或者反过来。
举个例子,想象一下你在玩气球,往里面吹气,气球鼓起来,最终它要么会继续膨胀,要么会爆掉。
这就是压强在起作用。
说到压强,咱们得记住“勒夏特列原则”。
这个原则就像是化学界的小秘方,告诉我们在一个平衡反应中,如果你增加压强,系统会试图减小这个压强,从而推动反应向着气体分子较少的一方移动。
像是你在拥挤的地铁上,想要多点空间,就得往外挤,或者干脆下车找个空位。
压力越大,反应越想往人少的地方走,真是个简单易懂的道理。
再聊聊气体反应。
很多气体反应在高压下表现得特别活跃。
比如,氢气和氧气结合生成水,这个反应在高压下进行得飞快,简直像是在开火箭。
如果压强不够,那这两个“小伙伴”可能就懒得搭理彼此了。
就像你请朋友吃饭,结果他又说“我不饿”,那你也没办法。
反应物之间的“亲密度”大大降低,平衡就会向反方向发展。
化学反应不仅仅是数字和公式的堆砌,很多时候它们跟我们的生活息息相关。
比如,汽车排放的气体,和大气中的压强变化有着密切关系。
汽车的尾气如果在高压环境中进行反应,可能会影响到周围的空气质量,这可不是小事。
环境保护就是这样,压强变化不仅影响化学反应,还可能影响我们的健康和生活质量。
不过,压强的变化不是单纯的“加减法”,而是一个复杂的平衡过程。

化学平衡与压强的关系公式
1. 化学平衡与压强的关系
a) 绝对压强与化学平衡的关系:
由分子动力学理论可以知道,两个物质间的物理性质有一定的关系,特别是在物质的化学反应方向大多受其反应物和产物间分子的有效受力和绝对压强的影响。
绝对压强可以通过均衡物质分GA(kJ/mol)从而影响其反应方向,这是化学平衡与绝对压强间的直接联系。
b) 偏压强与化学平衡的关系:
偏压强是指当一种或多种受力物质以恒定量加入时,其他受力物质之间的压强变化而影响受力物质之间的反应方向。
也就是说,偏压强可以刺激受力物质间的反应变化,从而使化学平衡发生变化。
因此,一个较低的偏压强可以使现有的反应最先发生,而较高的偏压强则会使反应提前发生,从而影响化学平衡。
2. 压强对化学平衡的影响
Kp可以从 Gibbs- Duhem方程式算出:Kp=PA/PB=PC/PD,可以看出压强的变化直接影响到KP值,并且KP值影响到反应物和生成物之间的关系,从而影响化学反应的发展方向。
因此压强的改变也会使化学反应的方向改变,从而引起化学平衡的改变。
3. 其他与压强密切相关的参数
a)温度:根据分子动力学的原理,温度的升高会使汞板法则的常数K
值减小,从而影响物质间的反应方向,因此也可以改变化学平衡。
b)活度:根据分子动力学原理,活度可以改变受力物质之间活度值,而能量变化也可以影响化学反应的速度,因此改变活度也会改变反应物
和生成物之间的关系及化学平衡。
c)势能:势能是指某物质在存在某种受力物质的过程中发生的能量变化。
由此可知,受力物质间的反应受势能的影响,因此改变势能会影响反
应物和生成物的关系,因此也可以改变化学平衡。
压强对化学平衡移动的影响规律1. 啥是化学平衡呀。
咱得先搞清楚啥叫化学平衡哈。
想象一下,化学反应就像是一场拔河比赛,反应物和生成物这两方在那较着劲呢。
当反应进行到一定程度的时候啊,反应物变成生成物的速度和生成物变回反应物的速度变得一样啦,这时候就达到了一种平衡状态,就好像拔河比赛两边僵持住了一样,谁也不占上风。
这个状态就是化学平衡,是不是还挺好理解的呀?2. 压强和化学平衡有啥关系呢。
那压强这个家伙又是怎么掺和到化学平衡里来的呢?这里面可有门道哦!压强的改变主要是通过改变气体的浓度来影响化学平衡的。
比如说,当你把一个装着气体反应物和生成物的容器给压缩了,就好像把大家都挤到了一个更小的空间里,那气体的浓度可不就变大了嘛。
这时候啊,化学平衡就可能会受到影响,就像拔河比赛的场地突然变小了,两边的人得重新调整策略啦。
3. 压强增大时的情况。
当压强增大的时候呀,化学平衡会朝着气体分子数减少的方向移动。
这是为啥呢?你可以这么想哈,压强增大了,空间变小了,大家都觉得有点挤。
那为了让自己能舒服点,反应就会倾向于往那种能让气体分子变少的方向进行,这样空间就相对宽松一点啦。
比如说,一个反应左边有3个气体分子,右边有2个气体分子,当压强增大的时候,反应就会更愿意往右边进行,因为这样气体分子总数就减少啦,就不那么挤啦,是不是挺有趣的呀?4. 压强减小时的情况。
那要是压强减小了呢?这时候就反过来啦,化学平衡会朝着气体分子数增加的方向移动。
就好比原来大家都挤在一个小房间里,现在房间突然变大了,有更多的空间啦,那反应就会倾向于生成更多的气体分子,去填满这个大空间。
还是刚才那个例子,当压强减小的时候,反应就会更倾向于往左边进行,让气体分子数增多。
5. 特殊情况要注意哦。
不过呢,这里面也有一些特殊情况要注意哈。
如果一个化学反应里,反应物和生成物的气体分子数是一样的,那压强的改变对化学平衡就没有影响啦。
就好比拔河比赛两边的人数一样多,场地大小变了,对比赛的僵持状态也没啥影响,还是会保持平衡。
谈谈压强对于化学平衡的影响先看看中学化学教科书上是怎么说的:全日制普通高级中学教科书(必修加选修)化学第二册【人民教育出版社化学室编著人民教育出版社2007年1月第2版】P38:我们可以合成氨反应为例来说明压强对化学平衡的影响:N2(g)+3H2(g)2NH3(g)在该反应中,1体积N2与3体积H2反应生成2体积NH3,即气态物质的总体积发生了变化,反应后气体总体积减少了。
表2-1列入的是450℃时N2与H2反应生成NH3的实验数据。
表2-1 450℃时N2与H2反应生成NH3的实验数据压强/MPa 1 5 10 30 60 100NH3 / % 2.0 9.2 16.4 35.5 53.6 69.4从上述实验数据可以看出,对于反应前后气体总体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使化学平衡向着气体体积增大的方向移动。
在有些可逆反应里,反应前后气态物质的总体积没有变化,例如:2HI(g) H2(g) +I2(g)(2体积)(1体积)(1体积)在这种情况下,增大或者减小压强都不能使化学平衡发生移动。
*实验数据好像很明显地验证了结论的正确性,但是增大压强的确切意思并未明确地揭示出来。
再来看:普通高中课程标准实验教科书化学选修4 化学反应原理【人民教育出版社课程教材研究所化学课程教材研究开发中心编著人民教育出版社2007年2月第3版】P21:正数第五行:对于气体反应来说,增大压强(减小容器容积)……减小压强(增大容器容积)……*这几句话虽然是针对反应速率说的,但实际上谈到对化学平衡的影响时,意义也是一样的【注意括号中的内容!】●讨论一下上面的内容:合成氨工业上是怎样增大气体压强的呢?合成氨时,是用压缩机把氮氢混合气(一般为物质的量之比为1 :3),压入合成塔中,合成塔的容积是一定的,所以增大压强就是继续往进鼓气,也就是说,如果1MPa时,合成塔中一共有amol混合气的话,5MPa时,合成塔中一共就得有5amol混合气【此时,氮气、氢气的浓度都是1MPa时的5倍!】,根据测出的氨气的体积分数,可以知道,该反应在(温度都是450℃)5MPa压强下的平衡点比1MPa压强下的平衡点靠右。
第8讲浓度、压强对化学平衡移动的影响一、浓度对化学平衡移动的影响1.实验探究浓度对化学平衡的影响按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:b溶液颜色,平衡向逆反应c溶液颜色,平衡向正反应发生Fe+2Fe3+===3Fe2+,Fe3+浓度减小,Q=c[Fe SCN3]c Fe3+·c3SCN-增大,Q>K,平衡逆向移动c(SCN-)增大,Q=c[Fe SCN3]c Fe3+·c3SCN-减小,Q<K,平衡正向移动2.(1)概念:在一定条件当可逆反应达到后,如果浓度、压强、温度等反应条件,原来的平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的。
这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的。
(2)化学平衡移动的特征:新平衡与原平衡相比,平衡混合物中各组分的、发生改变。
(3)化学平衡移动的过程分析(4)化学平衡移动方向的判断当Q=K时:反应处于平衡状态,;当Q<K时:反应向正反应方向进行,;当Q>K时:反应向逆反应方向进行,。
知识梳理3.浓度对化学平衡的影响规律及解释 (1)浓度对化学平衡移动的影响规律 当其他条件不变时:①c (反应物)增大或c (生成物)减小,平衡向正反应方向移动。
②c (反应物)减小或c (生成物)增大,平衡向逆反应方向移动。
(2)用平衡常数分析浓度对化学平衡移动的影响:①⎭⎪⎬⎪⎫增大c 反应物减小c 生成物Q 减小,则 ,平衡向 方向移动 ②⎭⎪⎬⎪⎫增大c 生成物减小c 反应物Q 增大,则 ,平衡向 方向移动 二、压强变化对化学平衡移动的影响1.实验探究压强对化学平衡移动的影响按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:实验原理2NO 2红棕色⇌N 2O 4无色实验步骤活塞Ⅱ处→Ⅱ处,压强活塞Ⅱ处→Ⅱ处,压强减小实验现象 混合气体的颜色先变深又逐渐变浅 混合气体的颜色先 又逐渐 实验结论活塞往里推,体积减小,压强 ,c (NO 2)增大,颜色 ,但颜色又变浅,说明c (NO 2)减小,平衡向 方向移动。