中考化学复习八单元海水中的化学训练海洋化学资源练习鲁教版(1)
- 格式:docx
- 大小:71.55 KB
- 文档页数:8


第八单元 海水中的化学重难点1 海洋化学资源和海水“晒盐”(2017·连云港)海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。
实验室中除去粗盐中不溶性杂质获得精盐的步骤是溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻地斜靠在__三层滤纸__一边。
蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是__左右移动酒精灯或间歇加热__。
②下列操作可能导致精盐产率偏高的是__b__(填字母)。
a .食盐没有完全溶解即过滤 b .过滤时液面高于滤纸边缘c .器皿上粘有的精盐没有全部转移到称量纸上(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。
下图是从海水中获得氯化镁溶液的流程。
①在海水中加入石灰乳后,发生反应的化学方程式是__MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2__。
②上述过程中试剂A 与沉淀B 发生的是中和反应,则试剂A 是__盐酸__(填名称)。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4·n H 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于__混合物__(填“纯净物”或“混合物”)。
②若某种可燃冰中CH 4与H 2O 的质量比是1∶9,则该可燃冰中n =__8__。
③可燃冰中甲烷完全燃烧的化学方程式是__CH 4+2O 2=====点燃CO 2+2H 2O__。
(2017·青岛)为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。
过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。
实验操作过程如下图所示:下列说法错误的是(C)A .实验操作步骤也可以是①③④②⑤⑥B .操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH 调为7C .在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒D .操作⑤得到的沉淀中共有四种物质 重难点2 海水“制碱”(2017·湘潭)我国制碱工业先驱侯德榜发明了“侯氏制碱法”。

第八单元 第一节 海洋化学资源一、选择题1.为了保护海洋资源,以下措施不正确的选项是( )A .建立海洋自然保护区B .制止工业“三废〞排放到大海中C .健全海洋环境污染监测系统D .在海上倾弃和燃烧危险物质2.以下关于海水的说法正确的选项是( )A .海水中含有大量的盐,指的是海水中含有大量的氯化钠B .海水中盐的含量很小,没有提取利用的价值C .海水是一种混合物D .海水中含量最高的元素是氯3.以下化学反响不属于海水中提取镁的是( )A .MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2B .Mg(OH)2+2HCl===MgCl 2+2H 2OC .MgCl 2=====通电Mg +Cl 2↑D .Ca(OH)2+CO 2===CaCO 3↓+H 2O4.以下操作不能用来淡化海水的是( )A .过滤B .使海水结冰脱盐C .加热蒸馏D .多级闪急蒸馏5.“可燃冰〞又称天然气水合物。
以下关于“可燃冰〞的表达中,不正确的选项是() A .“可燃冰〞有可能成为人类将来的重要能源B .“可燃冰〞是一种比拟干净的能源C .“可燃冰〞提供了水可能变成油的证据D.“可燃冰〞的可燃成分是甲烷6.关于多金属结核的表达正确的选项是()A.多金属结核储量丰富,开发前景好B.多金属结核与锰结核不是一回事C.锰结核中只含有一种金属D.全世界多金属结核含量微乎其微7.为了区分海水和淡水,可以参加以下哪种试剂链接听/14例2方法点拨()A.紫色石蕊试液B.硝酸银溶液C.氢氧化钠溶液D.酚酞试液8.以下关于利用海水的表达中,正确的选项是()A.海洋是个宏大的能源宝库,不需要开发更多的新能源了B.之所以可以大规模地利用海水提取镁,是因为海水中含有较多的镁元素C.电解氯化镁溶液也可以得到金属镁,只是本钱太高D.通过淡化海水可以得到淡水,节约用水的理念已经过时了9.海水是一种重要的资源,利用海水可制取镁等物质。

—————————— 教育资源共享 步入知识海洋 ————————第八单元 海水中的化学重难点1 海洋化学资源和海水“晒盐”(2017·连云港)海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。
实验室中除去粗盐中不溶性杂质获得精盐的步骤是溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻地斜靠在__三层滤纸__一边。
蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是__左右移动酒精灯或间歇加热__。
②下列操作可能导致精盐产率偏高的是__b__(填字母)。
a .食盐没有完全溶解即过滤 b .过滤时液面高于滤纸边缘c .器皿上粘有的精盐没有全部转移到称量纸上(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。
下图是从海水中获得氯化镁溶液的流程。
①在海水中加入石灰乳后,发生反应的化学方程式是__MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2__。
②上述过程中试剂A 与沉淀B 发生的是中和反应,则试剂A 是__盐酸__(填名称)。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4·n H 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于__混合物__(填“纯净物”或“混合物”)。
②若某种可燃冰中CH 4与H 2O 的质量比是1∶9,则该可燃冰中n =__8__。
③可燃冰中甲烷完全燃烧的化学方程式是__CH 4+2O 2=====点燃CO 2+2H 2O__。
(2017·青岛)为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。
过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。

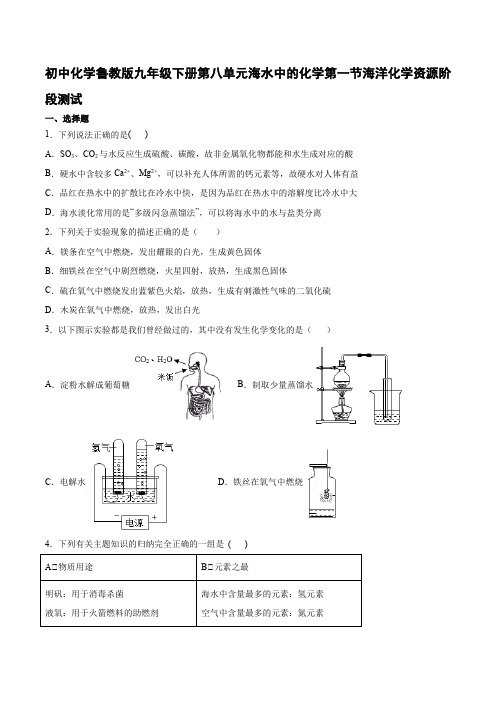
初中化学鲁教版九年级下册第八单元海水中的化学第一节海洋化学资源阶段测试一、选择题1.下列说法正确的是( )A.SO3、CO2与水反应生成硫酸、碳酸,故非金属氧化物都能和水生成对应的酸B.硬水中含较多Ca2+、Mg2+,可以补充人体所需的钙元素等,故硬水对人体有益C.品红在热水中的扩散比在冷水中快,是因为品红在热水中的溶解度比冷水中大D.海水淡化常用的是“多级闪急蒸馏法”,可以将海水中的水与盐类分离2.下列关于实验现象的描述正确的是()A.镁条在空气中燃烧,发出耀眼的白光,生成黄色固体B.细铁丝在空气中剧烈燃烧,火星四射,放热,生成黑色固体C.硫在氧气中燃烧发出蓝紫色火焰,放热,生成有刺激性气味的二氧化硫D.木炭在氧气中燃烧,放热,发出白光3.以下图示实验都是我们曾经做过的,其中没有发生化学变化的是()A.淀粉水解成葡萄糖B.制取少量蒸馏水C.电解水D.铁丝在氧气中燃烧4.下列有关主题知识的归纳完全正确的一组是( )A .AB .BC .CD .D5.海水淡化可采用膜分离技术,如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡化池,而海水中的各种离子不能通过淡化膜,从而得到淡水.对加压后右侧海水成分变化进行分析,正确的是( )A .溶质的质量增加B .溶液的质量不变C .溶剂的质量减少D .以上三种情况都有可能 6.从海水中提取镁的主要步骤如图:下列说法正确的是A.①中操作必须使用的仪器是烧杯、漏斗、玻璃棒、铁架台、试管夹B .①中发生反应的基本类型是复分解反应C .②中发生反应的化学方程式是222Mg OH +2HCl=MgCl +H O ()D .③中可以电解MgCl 2溶液得到金属Mg 7.下列实验操作正确的是A .制取蒸馏水时,将温度计水银球插入水中B .过滤时,将玻璃棒轻靠在单层滤纸的一边C .给试管中的液体加热时,试管中的液体不应超过试管容积的二分之一D .量取一定体积的液体时,视线要与液体凹液面的最低处保持水平8.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( ) A .Na 2SO 4B .NaClC .CaCl 2D .Na 2CO 39.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是 A .蒸发B .吸附C .过滤D .溶解10.化学与生活息息相关,下列说法正确的是( ) A .pH 小于7的雨水就是酸雨B .活性炭的吸附作用可使海水转化成淡水C .“钻木取火”的原理是通过摩擦生热,提高木材的着火点D .燃气灶火焰出现黄色,锅底出现黑色时,可增大灶具进风口 11.下列方法中,可使海水转化为饮用水的是( )。
第八单元第1节海洋化学资源一课一练一、选择——基础知识运用1.为了区分海水和淡水,可以加入下列那种试剂()A.紫色石蕊试液B.硝酸银溶液C.氢氧化钠溶液D.酚酞试液2.目前我国已开发利用的海洋化学资源有( )A.钾、钠、镁B.镁、溴、碘C.氮、磷、钾D.钙、溴、碘3.以下对自然资源利用的过程中,只发生物理变化的是( )A.铝土矿炼铝B.天然气燃烧C.木材制桌椅D.海水提取镁4.下列关于海水提取镁盐来制取镁的过程中,叙述正确的是()A.直接蒸发海水得到氯化镁B.将石灰乳加入海水或卤水中沉淀出氢氧化镁C.电解氯化镁溶液D.利用钠将氯化镁中的镁置换出来5.青岛是一座美丽的海滨城市,减少海洋污染是每个公民的责任。
下列情况中不会造成海洋污染的是( )A.垃圾填海B.油轮泄漏C.海水“晒盐”D.生活污水排入海洋6.近年来,科学家探明我国南海又巨大的可燃冰带,它是在海底低温高压下甲烷分子和水分子形成的晶体。
关于可燃冰的下列说法正确的是()A.它是一种矿物燃料B.它的化学式可写为H2OC.他的开采能解决能源问题,不需要再研究新的能源D.由于甲烷无毒,不必关注开采造成的能源问题7.关于多金属结核的叙述正确的是()A.多金属结核是锰的合金B.多金属结核也称锰结核C.锰结核中只有一种金属D.全世界多金属结核含量微乎其微二、解答——知识提高运用8.海底的资源非常丰富,不仅含有常规的化石燃料――___、_____、______,还含有新发现的新型矿产资源――______,又称为______,还被科学家誉为______、______;还有一种含有多种金属的矿物――______,又称为______。
9.如图表示的是海水中溶解的盐分中各种离子的质量分数。
请你根据图示回答下列问题:(1)海水中含量最多的金属离子是________(填离子符号)。
(2)镁离子的含量为________。
(3)其中含量最多的非金属离子和含量第二多的金属离子形成的化合物的化学式是________。
第八单元 海水中的化学重难点1 海洋化学资源和海水“晒盐”(2017·连云港)海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。
实验室中除去粗盐中不溶性杂质获得精盐的步骤是溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻地斜靠在__三层滤纸__一边。
蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是__左右移动酒精灯或间歇加热__。
②下列操作可能导致精盐产率偏高的是__b__(填字母)。
a .食盐没有完全溶解即过滤 b .过滤时液面高于滤纸边缘c .器皿上粘有的精盐没有全部转移到称量纸上(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。
下图是从海水中获得氯化镁溶液的流程。
①在海水中加入石灰乳后,发生反应的化学方程式是__MgCl 2+Ca(OH)2===Mg(OH)2↓+CaCl 2__。
②上述过程中试剂A 与沉淀B 发生的是中和反应,则试剂A 是__盐酸__(填名称)。
(3)2017年5月18日,在中国南海海域实现可燃冰(CH 4·n H 2O)试采成功,这将使人类能源格局翻开新篇章。
①可燃冰中,水分子形成一种空间笼状结构,甲烷和少量N 2、CO 2等分子填入笼内空隙中,无固定的化学计量关系,因此可燃冰属于__混合物__(填“纯净物”或“混合物”)。
②若某种可燃冰中CH 4与H 2O 的质量比是1∶9,则该可燃冰中n =__8__。
③可燃冰中甲烷完全燃烧的化学方程式是__CH 4+2O 2=====点燃CO 2+2H 2O__。
(2017·青岛)为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。
过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。
实验操作过程如下图所示:下列说法错误的是(C)A .实验操作步骤也可以是①③④②⑤⑥B .操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH 调为7C .在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序可以颠倒D .操作⑤得到的沉淀中共有四种物质 重难点2 海水“制碱”(2017·湘潭)我国制碱工业先驱侯德榜发明了“侯氏制碱法”。
2023年中考鲁教版化学第8单元海水中的化学二轮复习训练含答案鲁教版第8单元海水中的化学一、选择题。
1、下列说法错误的是()A. 海水是混合物B. 海水是纯净物C. 海水是溶液D. 海水晒盐的原理是蒸发溶剂2、如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是()A.三种物质的溶解度都随温度升高而增大B..t1℃时20g 丙加入50g 水中,充分搅拌得到70g 溶液C.甲的饱和溶液中混有少量乙,可通过降温结晶获得较纯净的甲D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中甲和丙的溶质质量分数相等3、有三瓶失去标签的无色溶液,只知道它们分别是稀盐酸、NaNO3溶液和BaCl2溶液中的各一种。
下列四种试剂中,能将上述三种无色溶液一次鉴别出来的是()A.K2CO3溶液B.稀硫酸C.AgNO3溶液D.NaCl溶液4、为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥砂,可将粗盐溶于水,然后进行下列五项操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液.下列操作顺序中最合适的是()A.②④⑤①③B.⑤④②③①C.⑤②④③①D.②⑤④①③5、下列海洋资源中属于可再生资源的是()A. 海底石油、天然气B. 潮汐能C. 滨海砂矿D. 锰结核6、M、N两种固体的溶解度曲线如图甲。
20℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙,升温到40℃时,现象如图丙。
下列说法不正确...的是()A.烧杯a中加入的固体为MB.所加固体质量大于20g小于或等于30gC.40℃时,烧杯a、b中溶液均为不饱和溶液D.40℃时,烧杯a、b中溶液的溶质质量分数不相等7、在常见的酸、碱、盐:NaOH、Ca(OH)2、HCl、H2SO4、Na2CO3中,两两之间能互相发生反应的共有()A.5组B.6组C.7组D.8组8、食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是()A.蒸发B.吸附C.过滤D.溶解9、海水中大约含水96.5%,海水中含量最高的元素是()A. OB. ClC. HD. Na10、A、B两种固体物质的溶解度曲线如图所示。
初中化学鲁教版九年级下学期第八单元第一节海洋化学资源一、单选题(共7题;共14分)1.在海水所含的元素中,质量分数最高的是()A. 氢B. 氧C. 钠D. 氯2.我们已经学习了有关利用海水的方法:①海水“晒盐”;②海水“制碱”;③海水淡化;④从海水中提取镁。
:以上过程都体现了人类改造物质的智慧,其中主要利用了物理变化的是( )A. 全部是B. 只有①③C. 只有②④D. ①②③④3.下列关于资源、能源、环保方面的叙述错误的是( )A. 海水中含有80多种元素,是巨大的资源宝库B. 世界上已有50%以上的铁和90%以上的金得到了回收利用C. 地壳中含量最多的元素是氧元素,它的质量分数接近于50%D. 世界每年因腐蚀而报废的金属设备和材料相当于年产量的50%-60%4.如图是采用膜分离技术的海水淡化装置,对海水加压后,只有水分子可以通过淡化膜,离子等其他粒子不能通过淡化膜.加压后,装置右侧海水中增加的是()A. 溶质质量分数B. 溶剂质量C. 溶液质量D. 溶质质量5.实验室用如图所示的装置蒸馏海水,下列说法正确的是()A. 该装置不需要石棉网B. 锥形瓶中能收集到高浓度的氯化钠溶液C. 实验时冷却水应从a进入,从b流出D. 蒸馏烧瓶中加入瓷片的作用是防止暴沸6.利用蒸发、冷凝的方法可以从海水中获取淡水,下列叙述正确的是()A. 蒸发时,水分子的运动速率加快B. 蒸发时,海水的质量变大C. 冷凝时,水分子之间的间隔不变D. 冷凝时,淡水的体积不变7.海洋是人类千万年来取之不尽,用之不竭的资源宝库,下列说法中错误的是( )A. 利用膜法可淡化海水,其原理与过滤的原理相似,都是选择合适的孔径将直径大小不同的粒子(或颗粒)分开B. 近年来海水因二氧化碳等非金属氧化物的增加而酸化。
因为这些氧化物溶于海水中会使海水pH值增大C. 海水制镁时,加入石灰乳的目的是将镁离子沉降聚集D. 海水酸化严重将影响珊瑚和其他分泌碳酸钙的海洋生物生存,因为海水氢离子的浓度增加,这些海洋生物的碳酸钙外壳会遭到破坏二、综合题(共5题;共23分)8.海水淡化可缓解淡水资源匾乏的问题,下图为太阳能海水淡化装置示意图。
课时训练(十二) 海洋化学资源(限时:30分钟)|夯实基础I1. [2017 •株洲]我国制碱工业的先驱一一侯德榜先生 ,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法) ,为纯碱和氮肥工业技术的发展作出了杰出贡献。
下列物质中能与纯碱发生反应的是()A. NaOHB.NaHCOC.H 2SC 4D.&SQ2. 根据复分解反应发生的条件判断下列各组物质能在同一溶液中共存的是 ( )A. HCl 、Ca ( OH 2B. Ba (NO ) 2、NazCO 、fSQC. ZnSO 、KNOD. CuSO 、NaOH NaHCO3. [2018 •泰安 ]从海水中制备纯碱和金属镁的流程如图 Z12-1所示:图 Z12-1下列说法错误的是 ( )A. 流程I 依次向粗盐水中加入过量Ca (OH 2溶液、N Q CO 溶液和适量稀盐酸去除杂质B. 流程n 吸氨是使溶液呈碱性,有利于吸收二氧化碳C. 上述流程涉及三种基本反应类型D. 流程W 、V 是通过化学方法富集氯化镁4. [2018 •海南]三沙市是我国位置最南、总面积最大的(含海域) 、陆地面积最小的地级市。
产扛—和盐水丄 盈(含頼化铸 和眾化钙】 ]母液石啊粕越水NaHCO盹(OHh 卑3叭勢你(1)永兴岛上的饮用水主要利用海水淡化膜对海水进行二级脱盐后获得。
分离原理如图验中常见的______________ 操作相似。
图Z12-2(2)三沙海域的海水盐度高,从海水中获得食盐的方法是(3)海水提取粗盐后的母液(苦卤)还可以用来提取金属镁______ ,其流程如图Z12-3所示。
流程中,溶液A为,其中没有发生的基本反应类型为。
氯化犠图Z12-35. 海水淡化可采用膜分离技术。
如图Z12-4中①所示,对淡化膜右侧的海水加压,在其左侧得到淡水,其原理是海水中的水分子可以透过淡化膜,而其他各种离子不能透过。
图Z12-4(1) _______________________________________________________ 采用膜分离技术淡化海水的原理,与化学实验中常见的 ______________________________________________________________ 操作相似。
(2) _____________________________________________________ 对淡化膜右侧的海水加压后,海水中溶质的质量分数会 _______________________________________________________________ (填“增大”“减小”或“不变”)。
(3)海水中含有大量的氯化钠,图②是氯化钠的溶解度曲线,据此可知盐场从海水中得到食盐晶体利用的方法是(填“降温”或“蒸发”)结晶。
6. [2017 •宜昌]我国制碱工业的先驱侯德榜发明了“侯氏制碱法”,其模拟流程如下Z12-2所示,该原理与化学实加人poo風80弟60」iF骨F可■尹亓_呻■申勺耳严甲I f « I I l> I I I I I k I* I W H I I B ■H » « 4 -*-K・•命■■呻■■粒・• -I •舗■i* I I i I 1)h il I* 4 k I I 1 I* 1 ii d I; t宜■扌/ 细|£4 # d W B-44 41-efc-k ■*9I i I I I ii I t i i I I i I I i b Ili t b li I li h I I i b 1 I 1 I* i »ri li liH r 1 -ii nrr- r r t T Tr jp jdL-r r i•・ P P I * F 1 I a P JMCkWl 片I 1卜• ■ T V- ■» Hi -i—i-r- # «¥ » P || R I P R ! 4 V 4 I 4 4 4: V 4 |i 4川I①40■ r II1(1) 反应A 、B C 中不涉及的基本反应类型是 ______________ 。
(2) “侯氏制碱法”的主要产品“碱”是指 ____________ (填化学式) (3) 反应B 的化学方程式是(4)在该模拟流程中,能被循环利用的物质是 ____________ 。
|能力提升|1. [2017 •泰安]某化工厂按如下步骤进行生产 :(1 )以煤为燃料煅烧石灰石;(2)用饱和的碳酸钠溶液充分吸收(1)中产生的二氧化碳(Na t CG+CO+HO2NaHCQ ; (3)使步骤(1)中产生的氧化钙与水反应 ;(4)熟石灰与碳酸钠溶液反应。
该厂生产过程中所涉及的物质有①石灰石 ;②碳酸钠;③碳酸氢钠;④烧碱;⑤二氧化碳;⑥熟石灰。
下列说法正确的是 ()A.起始原料是①③B.起始原料是②⑥C.最终产品是⑤⑥D.最终产品是③④2. [2017 •内江]南海、钓鱼岛及其附属海域蕴藏着丰富的海洋资源。
我国制碱工业先驱侯德榜发明了“侯氏制碱法”, 在充分利用海洋资源的基础上 ,结合“侯氏制碱法”的基本原理 ,可模拟实现工业生产纯碱的过程如下(某些反应产物已略去):图 Z12-6NHQia 体辱应③LwitbNallCOj |吐龍④HjO 反应②A孔嗣*倉盐水NHX1CO :图 Z12-5生石灰壳回答下列问题。
(1) ______________________ 操作a 的名称是 。
(2) 反应②的化学方程式为 _。
(3) ______________________________________________________________ 反应④的化学方程式为 ;请列举小苏打在生活中的一种常见用途: __________________ 。
(4)向精制饱和食盐水中通入两种气体的顺序 :先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。
这样操作的目的是 _________________________________ 。
(5) 仔细观察流程图,其中可循环利用的物质除二氧化碳之外 ,还有。
3. [2018 •枣庄]海洋是个巨大的宝藏。
人类利用海洋化学资源大体上经历了如图Z12-7所示几个阶段。
图 Z12-7(1) ______________________________________________________________ 海水经日晒蒸发水分,变为饱和溶液,再晒析出食盐,这一过程叫 ______________________________________________________ 。
这样得到的是“粗盐”,不仅含有泥沙, 还含有C 『、SC 4"、Mg +等,为去除三种杂质离子,可向粗盐水中依次加入过量的 ____________________ (填化学式),过滤去除沉淀后再加入适量盐酸,将溶液调至中性。
(2) 氯碱工业基本流程(如图 Z12-8所示)图 Z12-8由图示可知工艺中可循环利用的物质是 __________ (4) __________________________________ 下列方法中能淡化海水的是 (填字母)。
A.过滤法B.沉淀法C.多级闪急蒸馏法D.分解法4. [2018 •滨州]镁在国产大飞机“C -919”的制造中大显身手。
小亮在实验室模拟“海水制镁”的原理来富集镁,他将25 g氯化钠和氯化镁的固体混合物全部溶解于盛有70 g水的烧杯中,然后向其中加入63.6 g氢氧化钠溶液至恰好完全反应(图像如图Z12-9所示),过滤,称量滤液质量为147 g。
求:(1) _________________ 图像中m=(2)滤液中溶质的质量分数是多少图Z12-9参考答案夯实基础1. C2. C [解析]盐酸与氢氧化钙反应生成氯化钙和水,不能共存;硝酸钡能与碳酸钠、硫酸反应生成沉淀,碳酸钠与硫酸反应产生气体,都不能共存;硫酸铜与氢氧化钠反应生成沉淀,不能共存。
3. C [解析]粗盐转化为精盐时,加入过量的氢氧化钙以除净氯化镁,过量的碳酸钠溶液可除净氯化钙和过量的氢氧化钙,过滤后,再用适量稀盐酸可除净碳酸钠和氢氧化钠,A正确;二氧化碳能溶于水,在水中溶解度不大,故此先通入氨气创造碱性环境,更好地吸收二氧化碳,B正确;分析上述流程仅有复分解反应和分解反应两种基本反应类型,C错误;流程W和V是将海水中的氯化镁转化为氢氧化镁,再加盐酸将氢氧化镁沉淀转化为氯化镁,其目的是通过化学方法富集氯化镁,D正确。
4. (1)过滤 (2)蒸发结晶或蒸发溶剂(3)稀盐酸置换反应和化合反应[解析](1)海水中的水可以通过淡化膜,而海水中的其他成分不能通过淡化膜,故海水净化原理与过滤相似。
(2)氯化钠的溶解度受温度影响小,故从海水中得到氯化钠晶体采取蒸发结晶的方法。
(3)氢氧化镁是一种不溶性的碱,氢氧化镁转化为氯化镁只能和酸反应,故该酸是稀盐酸;石灰乳的成分是氢氧化钙,氯化镁和氢氧化钙发生复分解反应生成氢氧化镁沉淀和氯化钙,氢氧化镁和盐酸发生复分解反应生成氯化镁和水,熔融氯化镁通电分解生成镁和氯气,故不涉及置换反应和化合反应。
5. ( 1)过滤(2)增大(3)蒸发6. ( 1)置换反应(2)NazCO一定条杵,(3)NHHCG+NaCI NaHCO M +NHCI(4)二氧化碳[解析](1)反应A是二氧化碳、氨气和水化合生成碳酸氢铵,反应B是碳酸氢铵和氯化钠发生复分解反应生成碳酸氢钠和氯化铵,反应C是碳酸氢钠受热分解成碳酸钠、二氧化碳和水,因此,没有涉及的基本反应类型是置换反应。
(2) “侯氏制碱法”的主要产品“碱”是碳酸钠( N&CQ)。
( 3)反应B是碳酸氢铵和氯化钠发生复分解反应生成碳酸氢钠和氯化铵,反应的化学方程式为NHHCO+NaCI-------------- NaHCO M +NHCI。
(4)由流程图可知,碳酸氢钠分解生成的二氧化碳可以循环利用。
能力提升1. D2. (1)过滤(2) CaO+ —Ca (OH 2(3)2NaHCO NazCO+H b O+COf治疗胃酸过多(或食品加工等,合理答案均可)(4)使溶液显碱性,增大对二氧化碳的吸收(5)NHCI 固体[解析](1)操作a是将NaHCO固体和母液分开的操作,为过滤。
(2)反应②是生石灰与水反应生成熟石灰的过程,化学方程式为CaO+2O Ca(OH2°( 3)反应④中,NaHCO固体受热分解,生成碳酸钠、水和二氧化碳,化学方程式为2NaHCO —Na2CO+HO+C创;小苏打可用于治疗胃酸过多或用于食品加工等。