2015相图习题课
- 格式:pdf
- 大小:1.46 MB
- 文档页数:62



相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”。
1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)及H2 S(g)达平衡时有:( )。
(A)C=2,φ=2,f =2;(B) C=1,φ=2,f =1;(C) C=1,φ=3,f =2;(D) C=1,φ=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4⋅H2O(s),H2SO4⋅2H2O(s),H2SO4⋅4H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种;(B) 2种;(C) 1种;(D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡:NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H2O(g)+C(s) H2(g) + CO(g)CO2(g)+H2(g) H2O + CO(g)CO2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1;(D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80︒C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。


第5章 相平衡复习、讨论基本内容:➢ 相:体系内部物理性质和化学性质完全均匀的一部分。
气相、液相、固相 ➢ 相数:体系内相的数目Φ≥1➢ 相图:描述多相体系状态随浓度、温度、压力等变量的改变而发生变化的图形➢ 均相体系:只有一相的体系Φ=1 ➢ 多相体系:含多相的体系Φ>1➢ 凝聚体系:没有(或不考虑)气相的体系 ➢ 物系点:相图中表示体系总组成的点 ➢ 相点:表示某一个相的组成的点➢ 液相线:相图中表示液相组成与蒸气压关系的曲线 ➢ 气相线:相图中表示气相组成与蒸气压关系的曲线 ➢ 步冷曲线:冷却过程温度随时间的变化曲线T-t➢ 独立组分数:C = S - R - R',S 为物种数,R 为体系中各物种之间独立的化学平衡关系式个数,R’为浓度和电中性限制条件的数目。
对于浓度限制条件,必须是某个相中的几种物质的浓度之间存在某种关系时才能作为限制条件。
C=1单组分体系,C=2二组分体系。
若没有化学变化:C=S ;含单质的体系且R ’=0:C=N ;含单质的体系且S>N :R = S – N 。
➢ 自由度:确定平衡体系状态所需要的独立强度变量的数目f ≥0➢ 最低(高)恒沸点:对拉乌尔定律正(负)偏差很大的双液系的T —x 图上的最低(高)点。
恒沸点时气相组成与液相相同,具有纯物质的性质,一定压力下恒沸混合物的组成为定值(f*=C-Φ+1=1-2+1=0)。
➢ 最低(高)恒沸混合物:最低(高)恒沸点对应的混合物。
恒沸物是混合物而不是化合物➢ 会溶温度(临界溶解温度):部分互溶双液系相图上的最低点或最高点 ➢ 转熔温度:不稳定化合物分解对应的温度➢ 共轭层:部分互溶双液系相图上的帽形区内溶液为两层➢ 相律:平衡体系中相数、独立组分数与变量数之间的关系f = C - Φ + n ➢ 杠杆规则:液相的物质的量乘以物系点到液相点的距离,等于气相的物质的量乘以物系点到气相点的距离。
Bn BBn n l ×(X B -x B )=n g ×(y B -X B )单组分体系相图(p-T):水、CO 2、C二组分体系相图(T-x):液-液体系:简单的低共熔混合物形成化合物稳定的化合物不稳定的化合物形成固溶体完全互溶固溶体部分互溶固溶体有一低共熔点有一转熔温度完全互溶理想的非理想偏差不很大正偏差很大 负偏差很大部分互溶具有最高会溶温度具有最低会溶温度同时有最高和最低会溶温度没有会溶温度不互溶液-固体系:基本要求:1. 明确基本概念(相、相数、组分数、自由度;S 、R 、R ’、f 、C 、Φ)2. 能熟练运用相律f=C-Φ+n (n 通常为2,在限制T 或p 时<2,也可能>2,见后面例题“NaCl 水溶液与纯水达成渗透平衡”)3.会用杠杆规则(适用于任何两相区)求两相平衡体系中两相的组成和量4.熟悉二组分体系的相图(会确定图中点、线、面的相态、相数、自由度等)5.熟悉相图规律、基本相图➢两相区的两侧是两个不同的单相区,两相区包含的两种相态就是两个单相区的相态➢三相线的两端分别顶着两个单相区、中间与另一个单相区相连➢在临界点以下,任何两个相数相同的相区都不可能上下相邻(相区交错规则)6.能够由步冷曲线画相图,或由相图画步冷曲线(相图中的两相平衡线与步冷曲线的转折点对应;三相线与步冷曲线的平台对应)。


第12章相律与相图1.试计算下列平衡体系的自由度数:(1) 298.15 K、101 325Pa下固体NaCl与其水溶液平衡;(2) I2(s) ? I2(g);(3) NaCl(s)与含有HCl的NaCl饱和溶液。
(答案:①0,②1,③3)解:(1) K = 2, R = 0, b = 0, φ= 2∴C = K-R-b = 2, 又T, p已指定∴f = C -φ + n = 2- 2 + 0 = 0(2) K=1, R = 0, b = 0, φ=2∴C = K-R-b =1- 0- 0 =1则f = C -φ + n = 1- 2 + 2 = 1(3) K=3, R = 0, b = 0, φ=2则C = K-R-b =3–0–0 = 3∴f = C -φ + n =3- 2 + 2 = 32.固体NH4HS和任意量的H2S及NH3气体混合物组成的体系按下列反应达到平衡:NH4HS(s) ? NH3(g)+H2S(g)(1) 求该体系组元数和自由度数;(2) 若将NH4HS放在一抽空容器内分解,平衡时,其组元数和自由度数又为多少?(答案:①2,2,②1,1)解:(1) K=3, R = 1, b = 0, φ=2∴C = K-R-b =st1:chsdate Year="2000" Month="3" Day="1" IsLunarDate="False" IsROCDate="False">3 -1- 0 = 2 即体系组元数为2而体系的自由度数f = C -φ + n = 2 – 2 + 2 = 2(2) K=3, R = 1, b = 1, φ=2∴该体系平衡时的组元数C = K-R-b =3 – 1 – 1 = 1而体系的自由度数 f = C -φ + n = 1- 2 + 2 = 13.求下列体系的组元数和自由度数:(1) 由Fe(s)、FeO(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(2) 由Fe(s)、FeO(s)、Fe3O4(s)、C(s)、CO(g)、CO2(g)组成的平衡体系;(3) Na2SO4水溶液,其中有Na2SO4(s)、H2O、H + 和OH -;(4) 已知Na2SO4水溶液中有+、、(l)、(s)、H + 和OH -。


判断题:1.在一个给定的系统中,物种数可以因分析问题的角度的不同而不同,√但独立组分数是一个确定的数。
2.自由度就是可以独立变化的变量。
(3.相图中的点都是代表系统状态的点。
(4.恒定压力下,根据相律得出某一系统的f = l,则该系统的温度就有一个唯一确定的值。
( 5.根据二元液系的p~x图可以准确地判断该系统的液相是否是理想液体混合物。
√7.对于二元互溶液系,通过精馏方法总可以得到两个纯组分。
(9.恒沸物的组成不变。
(10.若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A的摩尔分数成正比。
(11.在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
√12.三组分系统最多同时存在5个相。
√二、单选题:1.H2O、K+、Na+、Cl- 、I- 体系的组分数是:C(A) K = 3 ;(B) K = 5 ;(C) K = 4 ;(D) K = 2 。
2.单组分固-液两相平衡的p~T曲线如图所示,则:(克拉贝龙方程式)C(A) Vm(l) = Vm(s) ;(B) Vm(l)>Vm(s) ;(C) Vm(l)<Vm(s) ;(D) 无法确定。
3.压力升高时,单组分体系的熔点将如何变化:D(A) 升高;(B) 降低;(C) 不变;(D) 不一定。
4.硫酸与水可组成三种化合物:H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s),在p•下,能与硫酸水溶液共存的化合物最多有几种:B(A) 1 种;(B) 2 种;(C) 3 种;(D) 0 种。
5.在101325Pa的压力下,I2在液态水与CCl4中的溶解已达到平衡(无固体I2存在),此体系的自由度为:B(A) 1 ;(B) 2 ;(C) 3 ;(D) 0 。
6.NaCl水溶液和纯水,经半透膜达到渗透平衡,该体系的自由度数是:C(A) f = 1 ;(B) f = 2 ;(C) f = 3 ;(D) f = 4 。
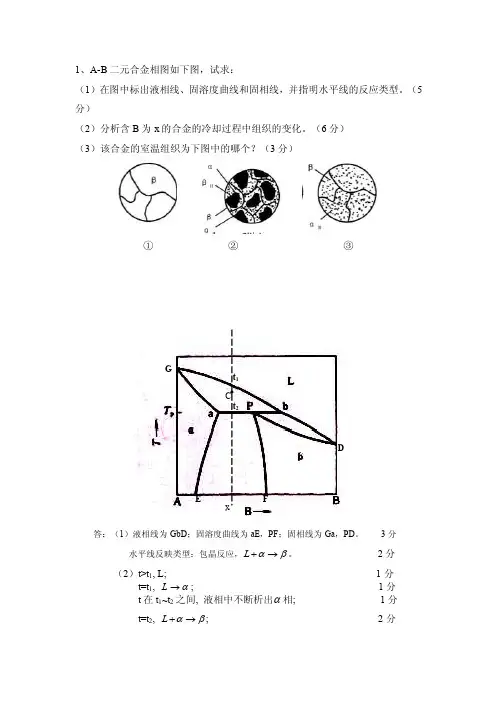
1、A-B 二元合金相图如下图,试求:(1)在图中标出液相线、固溶度曲线和固相线,并指明水平线的反应类型。
(5分)(2)分析含B 为x 的合金的冷却过程中组织的变化。
(6分) (3)该合金的室温组织为下图中的哪个?(3分)① ② ③答:(1)液相线为GbD ;固溶度曲线为aE ,PF ;固相线为Ga ,PD 。
3分 水平线反映类型:包晶反应,L αβ+→。
2分(2)t>t 1, L; 1分 t=t 1, α→L ; 1分 t 在t 1~t 2之间, 液相中不断析出α相; 1分 t=t 2, L αβ+→; 2分GDEF1 22 (3)② 3分 2、下图所示为Fe-Fe 3C 合金相图: (21分)(1) 在图中标出碳在奥氏体中的溶解度曲线,碳在铁素体中的溶解度曲线和奥氏体中开始析出铁素体的转变线。
(3分)(2) 指明水平线的反应类型,并写出对应的反应式。
(6分)(3) 指出图中合金I 的类型,并分析其冷却过程中的组织变化及最后得到的室温组织。
(6分)(4) 指出该合金的室温相组成,并计算各相的相对含量。
(6分)答:(1)ES 为碳在奥氏体中的溶解度曲线;PQ 为碳在铁素体中的溶解度曲线;GP 为奥氏体中开始析出铁素体的转变线。
3分 (2)包晶反应:γδ→+L 2分 共晶反应:C F L e +→γ 2分 共析反应:C F L e +→γ 2分 (3)合金I 的类型是过共析钢。
1分冷却过程中的组织变化:t>t 1, L; t=t 1, γ→L ; 1分 t 在t 1~t 2之间, 液相中不断析出γ相,到t 2; t=t 2, 液相全部转变为固相,之后相不变 1分1 23 4 O3 3 t=t 4:C F 3e +→αγ 1分 最后得到的室温组织:P+ C F 3e 1分 (4)指出该合金的室温相组成,并计算各相的相对含量。
(6分)合金的室温相组成是α相和C F 3e 。
2分 α相含量=069.6-69.6-P 2分C F 3e 相含量=069.60--P 2分1、A-B 二元合金相图如下图,试求:(1)在图中标出液相线、固溶度曲线和固相线。

相平衡及相图练习1.下列说法对吗?为什么?(1)在一给定的体系中,独立组分数是一个确定的数。
(2)单组分体系的物种数一定等于1。
(3)相律适用于任何相平衡体系。
(4)在相平衡体系中,如果每一相中的物种数不相等,则相律不成立。
提示2.请论证(1)在一定温度下,某浓度的 NaCl 水溶液只有一个确定的蒸气压;(2)在一定温度下,草酸钙分解为碳酸钙和一氧化碳时只能有一个确定的 CO 压力。
提示3.试求下述体系的自由度并指出变量是什么?(1)在压力下,液体水与水蒸气达平衡;(2)液体水与水蒸气达平衡;(3)25℃ 和压力下,固体 NaCl 与其水溶液成平衡;(4)固态 NH4HS 与任意比例的 H2S 及 NH3的气体混合物达化学平衡;(5)I2(s)与 I2(g)成平衡。
提示4.Na2CO3与水可形成三种水合物 Na2CO3·H2O(s),Na2CO3·7H2O(s)和 Na2CO3·10H2O(s)。
问这些水合物能否与 Na2CO3水溶液及冰同时平衡共存?提示5.根据碳的相图,回答下列问题:(1)点 O 及曲线 OA,OB 和 OC 具有什么含义?(2)试讨论在常温常压下石墨与金刚石的稳定性;(3)2000K 时,将石墨变为金刚石需要多大压力?(4)在任意给定的温度和压力下,金刚石与石墨哪个具有较高的密度?提示6.在 1949~2054K 之间,金属 Zr 的蒸气压方程为请得出 Zr 的摩尔升华焓与温度T的关系式。
并估算 Zr 在溶点 2128K 时的摩尔升华焓和蒸气压。
提示7.某物质的固体及液体的蒸气压可分别用下式表示:(固体) (1)(液体) (2)试求其:(1)摩尔升华焓(2)正常沸点(3)三相点的温度和压力(4)三相点的摩尔熔化熵提示8.在海拔 4500m 的西藏高原上,大气压力只有 57.329kPa,水的沸点为84℃,求水的气化热。
提示9.一冰溪的厚度为 400m,其比重为 0.9168,试计算此冰溪底部冰的熔点。
1、金属A、B熔融液冷却曲线的转折温度和平台温度如下表所列,请据此画出2、金属A、B形成化合物AB3、A2B3。
固体A、B、AB3、A2B3彼此不互溶,但在液态下能完全互溶。
A、B的正常熔点分别为600℃、1100℃。
化合物A2B3的熔点为900℃,与A形成的低共熔点为450℃。
化合物AB3在800℃下分解为A2B3和溶液,与B 形成的低共熔点为650℃。
根据上述数据(1)画出A-B系统的熔点-组成图,并标示出图中各区的相态及成分;(2)画出x A=0.90、x A=0.10熔化液的步冷曲线,注明步冷曲线转折点处系统相态及成分的变化和步冷曲线各段的相态及成分。
3、已知101.325kPa,固体A和B的熔点分别为500℃和1000℃,它们可生成固体化合物AB(s)。
AB(s)加热至400℃时分解为AB2(s)和x B=0.40的液态混合物。
AB2(s)在600℃分解为B(s)和x B=0.55的液态混合物。
该系统有一最低共熔点,温度为300℃,对应的组成x B=0.10。
(1)根据以上数据,画出该系统的熔点-组成图,并标出图中各相区的相态与成分;(2)将x A=0.20的液态A,B混合物120mol,冷却接近到600℃,问最多可获得纯B多少摩尔?4、金属A、B及其化合物A2B3的熔化温度分别为1200℃,1600℃和1700℃;在1400℃时,含B10%的熔融液与含B20%、30%的两固熔体三相平衡;在1250℃时,含B75%的熔融液与含B65%、90%的两固熔体三相平衡。
根据以上事实粗略画出A-B系统的相图,5、根据下述事实粗略画FeO-SiO2系统的相图。
FeO和SiO2的熔点分别为1541℃和1713℃;(FeO)2·SiO2的熔点为1065℃,FeO·SiO2的熔点为1500℃,;最低共熔点的坐标为:t =1040℃, x(SiO2) = 0.31;t =1010℃, x(SiO2)=0.37;t=1445℃, x(SiO2)=0.6。
第四章 相图 练习题1.在Al-Mg 合金中,x Mg ,计算该合金中Mg 的质量分数(w Mg )(已知Mg 的相对原子质量为,Al 为26.98)。
2.已知Al-Cu 相图中,K =,m =。
若铸件的凝固速率R =3×10-4 cm/s ,温度梯度G =30℃/cm ,扩散系数D =3×10-5cm 2/s ,求能保持平面状界面生长的合金中W Cu 的极值。
3.证明固溶体合金凝固时,因成分过冷而产生的最大过冷度为:⎥⎦⎤⎢⎣⎡-+--=∆GK R K mw R GD K K mw T Cu C Cu C )1(ln 1)1(00max最大过冷度离液—固界面的距离为:⎥⎦⎤⎢⎣⎡-=GDK R K mw R D x Cu C )1(ln 0式中m —— 液相线斜率; w C0Cu —— 合金成分; K —— 平衡分配系数; G —— 温度梯度; D —— 扩散系数; R —— 凝固速率。
说明:液体中熔质分布曲线可表示为:⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛--+=x D R K K w C Cu C L exp 110 4.Mg-Ni 系的一个共晶反应为:546.02)Mg (570235.0Ni Mg ==+⇔w w L NiNi 纯℃α设w 1Ni =C 1为亚共晶合金,w 2Ni =C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2合金中α总量的倍,试计算C 1和C 2的成分。
5.在图4—30所示相图中,请指出: (1) 水平线上反应的性质;(2)各区域的组织组成物;(3)分析合金I,II的冷却过程;(4)合金工,II室温时组织组成物的相对量表达式。
6.根据下列条件画出一个二元系相图,A和B的熔点分别是1000℃和700℃,含wB的合金正好在500℃完全凝固,它的平衡组织由73.3%的先共晶。
和26.7%的(α+β)共晶组成。
而wB=的合金在500℃时的组织由40%的先共晶α和60%的(α+β)共晶组成,并且此合金的α总量为50%7.图4-31为Pb-Sb相图。
第五章 多相平衡一、填空题1、一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于__________。
2、纯物质在一定温度下两相共存时的自由度数等于__________。
3、设下列化学反应同时共存时并达到平衡(900-1200K ):()()()g CO s CaO s CaCO 23+=()()()()g O H g CO g H g CO 222+=+()()()g H s CaCO s CaO g CO g O H 232)()(+=++则该系统的自由度数为______。
4、含KNO 3和NaCl 的水溶液与纯水达到渗透平衡时,其组分数为____,相数为___, 自由度数为____。
5、在氢和石墨的系统中,加一催化剂,H 2和石墨反应生成n 种碳氢化合物,此系统的独立 组分数为______。
6、含有CaCO 3(S )、CaO (S )、CO 2(g )的混合物与CO 2(g )和N 2(g )的混合物达渗透平衡时,该混合体系的物种数S=____, 独立组分数C 为____,相数φ为____,自由度f=____。
7、完全互溶的双液系中,在x B =0.6处,平衡蒸气压有最高值,那么组成为x B =0.4的溶液在 气液平衡时,x B (g )、x B (l )、x B (总)的大小顺序为______。
将x B =0.4的溶液进行 精馏时,塔顶将得到______。
8、对于渗透平衡系统,相律的形式应写成______。
9、NH 4Cl 固体分解达到平衡时,())()(s Cl NH 34g NH g HCl +=,系统的独立组分数为___,自由度为___。
10、将AlCl 3溶于水中,全部水解,生成Al(OH)3沉淀,此系统自由度数f=____。
11、已知100o C 时水的饱和蒸气压为101.325KPa,用公式_________可求出25oC 时 水的饱和蒸气压。
二、单选题1、右图为H 2OA.-(NH 4)2SO 4B.的沸点-组成图。
物理化学习题课(相平衡)参考答案物理化学习题(相平衡)一.选择1.在α、β两相中均有A和B两种物质,达到相平衡时,下列各式正确的是(1)。
(1)μαB=μβB(2)μαA=μβA(3)μαB=μαA(4)μαB=μβA2.组分B从α相扩散到β相中,则下列说法中正确的是(4)。
(1)总是从浓度高的相扩散到浓度低的相(2)平衡时两相的浓度相等(3)总是从浓度低的相扩散到浓度高的相(4)总是从高化学势移向低化学势3. 室温下氨基甲酸铵分解反应为NH2CO2NH4(s)====2NH3(g)+CO2 (g)若在300K时向系统中加入一定量的氨基甲酸铵固体,则此系统的物种数S和组分数C应为(3)。
(1)1,1(2)3,2(3)3,1(4)3,34.将克拉贝龙方程应用于水的液固两相,随压力的增长,水的凝固点将(2)。
(1)上升(2)下降(3)不变(4)无法判断5.在一定温度下,在水和CCl4组成的互不相溶的系统中,向水层中加入1:1的KI和I2,此系统的自由度是(2)。
(1)1(2)2(3)3(4)46.对于二组分系统,能平衡共存的最多相数为(4)。
(1)1(2)2(3)3(4)47.对于恒沸混合物,下列说法中错误的是(4)。
(1)不具有确定的组成(2)平衡时气相和液相组成相同(3)其沸点随外压的改变而改变(4)与化合物一样具有确定的组成二.填空1.在水的平衡相图中。
线是水的蒸发曲线,线是冰的升华曲线,线是冰的融化曲线,点是水的三相点。
.2.将过量NH4HCO3(s)放入密闭真空容器内,50℃时,按NH4HCO3(s)按下式进行分解:NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g)。
达平衡后则该体系的相数P= ,独立组分数C= ,自由度数F= 。
(2,1,0)3.(2)最合适的组成应配成w(联苯醚)=0.78,这一组成具有最低共熔点12℃,其凝固点最低,所以不至于因为凝固而堵塞管道。
4. 求下列系统③从X B=0.5开始蒸馏,馏出物或残留物分别是什么?(1)T M,T N,(2)所处的T,p及气液相组成y B、x B,达两相平衡气液相的相对量不同,(3)0。
名词解释1.匀晶转变:2.包晶转变:3.平衡凝固:4.伪共晶:5.非平衡共晶:6.共晶转变:7.偏晶转变:8.共析反应:9.包析转变:10.熔晶转变11.合晶转变:12.一次相或初生相;13.二次相或次生相14.扩散退火:15.离异共晶:16.钢17.铸铁18.奥氏体:19.莱氏体:20.珠光体:21.三次渗碳体22.调幅分解23.成分过冷24.枝晶偏析25.正偏析26.宏观偏析概念辨析题1、共晶转变与共析转变2、奥氏体与铁素体的异同点:3、二次渗碳体与共析渗碳体的异同点。
4、稳定化合物与不稳定化合物5、均匀形核与非均匀形核6、平衡凝固与非平衡凝固7、光滑界面与粗糙界面8、钢与铸铁9、热过冷与成分过冷10、一次相与二次相11、伪共晶与离异共晶12、正偏析与反偏析相图题一、相图题(20分)1.画出Fe-Fe 3C 相图,填出各区的组织组成物。
(6分)2.分析含碳O.65%的铁碳合金的平衡结晶过程,画出其冷却曲线和室温时的显微组织示意图。
(8分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(6分)C e F -e F 3相图为二、相图题(22分)1_画出 相图,填出各区域的组织组成物。
(6分) 2.分析含碳0.4%的铁碳合金的平衡结晶过程,画出其冷却曲线和室温时的显微组织示 意图。
(8分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(8分)C e F -e F 3三、相图题(25分)1.画出相图,标出重要点的温度与含碳量,填出各区域的组织组成物。
(7分) 2.分析含碳3.5%的铁碳合金的平衡凝固过程,画出其冷却曲线和室温时的显微组织示意图。
(10分)3.用杠杆定律计算该合金在室温时的组织组成物和相组成物的量。
(8分)四、相图题1、Fe—Fe3C相图,结晶过程分析及计算1)分析含碳0.53~0.77%的铁碳合金的结晶过程,并画出结晶示意图。
2)计算室温下亚共析钢(含碳量为x)的组织组成物的相对量。