洁净区环境霉菌控制
- 格式:ppt
- 大小:1.02 MB
- 文档页数:4

a级洁净区域标准1.尘埃数量在A级洁净区域内,尘埃数量不得超过5个每分钟。
这是为了确保空气的纯净度,减少尘埃颗粒对产品和环境的影响。
2.空气悬浮粒子洁净度等级A级洁净区域的空气悬浮粒子洁净度等级必须达到标准。
这意味着该区域内悬浮粒子的直径必须小于5微米。
这一要求是为了防止悬浮粒子对产品和环境造成污染。
3.风速在A级洁净区域内,通风系统的设计必须细致,以确保风速不会超过5米每秒。
这是为了保持空气流通,防止污染物积聚,同时确保温度和湿度维持在适宜的范围内。
4.温度和湿度A级洁净区域的温度必须控制在18到20摄氏度之间,湿度则必须保持在50到60%之间。
这一要求是为了保持产品的稳定性和可靠性,同时减少细菌和霉菌的生长。
5.噪音和振动A级洁净区域内的噪音不得超过30分贝,振动则必须控制在0.5毫米/秒以下。
这是为了减少噪音和振动对产品的影响,确保生产环境的安静和稳定。
6.照度A级洁净区域内的照度必须保持在300勒克司以上。
这是为了确保足够的照明,方便工作人员进行操作和维护,同时减少细菌和霉菌的生长。
7.环境整洁度A级洁净区域的环境整洁度非常重要。
必须采取有效的清洁措施,确保区域内的环境整洁,减少细菌和霉菌的滋生。
同时,需要定期进行环境监测和评估,确保洁净度达到标准。
8.微生物数量A级洁净区域内的微生物数量必须低于1个每立方米。
这是为了减少细菌和霉菌等微生物对产品和环境的影响,确保生产环境的无污染性。
9.总结A级洁净区域标准是为了确保生产环境的无尘、无污染、稳定可靠。
在洁净区域内,需要严格控制尘埃数量、空气悬浮粒子洁净度等级、风速、温度和湿度、噪音和振动、照度以及环境整洁度和微生物数量等方面。
只有达到这些标准,才能有效地减少污染物和微生物对产品的影响,提高生产效率和产品品质。

化验室洁净区微生物c级a级标准要求洁净区是医院化验室中非常重要的区域,主要用于进行微生物实验和培养。
在洁净区内,微生物C级和A级标准的要求非常严格,主要是为了确保实验结果的准确性和保护实验人员的健康。
本文将从洁净区的概念和作用、微生物C级和A级标准的具体要求、洁净区管理和保养等方面进行详细介绍。
一、洁净区的概念和作用洁净区是化验室中用于进行微生物实验和培养的区域,它的主要作用是保持实验环境的洁净度和无菌度,以确保实验结果的准确性。
在洁净区内,严格控制空气中的微生物数量,保持恒定的温度、湿度和气流速度,使其符合微生物实验的要求。
同时,洁净区还能够有效隔离外界环境对实验的干扰,确保实验人员的健康安全。
因此,洁净区的建设和管理对于医院化验室的正常运转和实验安全非常重要。
二、微生物C级和A级标准的要求1.微生物C级标准的要求具体要求如下:(1)空气中微生物总菌落数应≤100cfu/m3;(2)空气中霉菌孢子数应≤10cfu/m3;(3)空气中细菌数量不得超过规定限度;(4)空气中病原微生物应为阴性。
为了保证洁净区内空气的微生物C级标准达到要求,通常需要采取以下措施:(1)严格控制洁净区的进出通道,确保空气的流通和过滤;(2)定期清洗和消毒洁净区内的各种设备和器具;(3)加强洁净区内的空气净化和过滤设备的维护和保养;(4)加强实验人员的个人卫生管理,防止外界环境微生物的污染;(5)定期对洁净区内的空气进行微生物检测,确保达标要求。
2.微生物A级标准的要求其具体要求如下:(1)物体表面微生物总菌落数应≤10cfu/100cm2;(2)物体表面霉菌孢子数应≤1cfu/100cm2;(3)物体表面病原微生物应为阴性。
为了保证洁净区内物体表面的微生物A级标准达到要求,通常需要采取以下措施:(1)定期清洗和消毒洁净区内的工作台、仪器、器具等物体表面;(2)加强实验人员的个人卫生管理,减少微生物的传播;(3)做好洁净区内各种设备的清洁和消毒工作,防止微生物的繁殖和传播;(4)定期对洁净区内物体表面进行微生物检测,确保达标要求。

制药企业洁净区霉菌控制的相关法规、指南文件等摘要:I.制药企业洁净区霉菌控制的重要性A.霉菌对药品质量和人体健康的影响B.制药企业洁净区霉菌控制的法规要求II.相关法规和指南文件A.《药品生产质量管理规范》B.《药品生产洁净区卫生管理规程》C.《药品生产质量管理规范指南》D.《霉菌检测方法》III.制药企业洁净区霉菌控制的实践A.洁净区的设计与建设B.霉菌检测与监测C.霉菌防控策略和措施IV.总结与展望A.制药企业洁净区霉菌控制的效果评价B.未来洁净区霉菌控制的方向和挑战正文:制药企业洁净区霉菌控制的相关法规、指南文件等随着药品质量要求的不断提高,制药企业洁净区的卫生管理越来越受到重视。
其中,霉菌控制是洁净区卫生管理的一个重要环节。
霉菌不仅会导致药品质量下降,还可能对人体健康产生严重影响。
因此,制药企业需要严格遵守相关法规和指南文件,做好洁净区霉菌控制工作。
一、制药企业洁净区霉菌控制的重要性霉菌是一种广泛分布的微生物,可以在各种环境中生长繁殖。
在制药企业洁净区,霉菌的存在可能导致药品质量问题,如药品降解、污染等。
此外,霉菌产生的毒素也可能对人体健康产生影响。
因此,做好洁净区霉菌控制工作,对于保障药品质量和人体健康具有重要意义。
根据《药品生产质量管理规范》等相关法规,制药企业需要对洁净区的卫生进行严格管理,确保药品生产过程的安全、有效。
在霉菌控制方面,企业应遵循《药品生产洁净区卫生管理规程》等指南文件,制定合理的防控措施,降低霉菌对药品质量的影响。
二、相关法规和指南文件1.《药品生产质量管理规范》:该规范对药品生产过程中的质量管理提出了明确要求,包括洁净区的卫生管理、霉菌控制等方面。
2.《药品生产洁净区卫生管理规程》:该规程详细阐述了洁净区卫生管理的要求,对于霉菌控制策略、霉菌检测方法等方面进行了明确规定。
3.《药品生产质量管理规范指南》:该指南针对《药品生产质量管理规范》的要求,提供了详细的解释和示例,有助于制药企业更好地理解和执行霉菌控制等相关规定。

洁净区减少空气中微生物的方法要减少洁净区空气中的微生物,可以采取以下多种方法:
1. 空气过滤,安装高效空气过滤器可以有效地去除空气中的微
生物,如细菌、病毒和真菌孢子。
高效空气过滤器能够捕获微小的
颗粒物,并提高空气质量。
2. 空气消毒,使用紫外线空气消毒系统可以杀灭空气中的细菌
和病毒。
紫外线能够破坏微生物的DNA,从而使其失去活性。
3. 保持清洁,定期清洁洁净区的地面、墙壁和设备表面,可以
减少微生物的滋生和传播。
使用合适的消毒剂对表面进行消毒也是
很重要的一步。
4. 控制湿度,保持洁净区的适宜湿度,通常在40%至60%之间,可以防止霉菌和真菌的生长,从而减少空气中的微生物数量。
5. 定期通风,定期开启窗户或使用机械通风系统,有助于将室
内污浊空气排出,同时引入新鲜空气,从而减少微生物在空气中的
浓度。
6. 员工培训,加强员工的卫生意识和培训,教育他们正确的洗手、消毒和清洁操作,减少微生物的传播。
7. 监测和检测,定期对洁净区的空气进行监测和检测,确保微生物的水平符合相关标准,及时采取措施进行调整和改进。
综上所述,通过空气过滤、空气消毒、保持清洁、控制湿度、定期通风、员工培训以及监测和检测等多种方法的综合应用,可以有效地减少洁净区空气中的微生物,确保洁净区的空气质量符合相关标准,从而保障生产和操作的安全。

1目的规范洁净区环境监控管理,确保洁净区的环境符合GMP要求。
2范围适用于各生产车间的洁净区的监控。
3职责QA负责各车间洁净区的环境监控。
4内容4.1定义4.1.1静态4.1.1.1静态a:洁净室(区)在净化空气调节系统已安装完毕且功能完备的情况下,生产工艺设备已安装,洁净室(区)内没有生产人员的状态。
4.1.1.2静态b:洁净室(区)在生产操作全部结束,生产操作人员撤离现场并经过20min自净后。
4.1.2动态:洁净室(区)已处于正常生产状态,设备在指定的方式下进行,并且有指定的人员按照规范操作。
4.2测试项目、标准及频次4.2.1风速、风量及换气次数4.2.1.1风速测试:A级区进行风速测试,检测频次:每个月一次。
4.2.1.2风量及换气次数测试:A级区外的其它区域测量风量及换气次数。
检测频次:至少每年一次。
4.2.1.3标准a.A级区风速:层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s。
b.换气次数:B级洁净室换气次数n≥50次/h,C级洁净室换气次数n≥25次/h,D级洁净室换气次数n≥15次/h。
4.2.2流型4.2.2.1检测区域:A级区,检测频次:至少每年一次。
4.2.2.2标准:应为层流4.2.3压差4.2.3.1检测频次:正常投产时每天一次。
4.2.3.2标准a.洁净区与非洁净区之间、不同等级洁净区之间的压差应不低于10帕斯卡。
b.相同洁净度等级不同功能的操作间之间应保持适当的压差梯度,以防止污染和交叉污染。
4.2.4温度、相对湿度4.2.4.1检测频次:正常投产时每天一次。
4.2.4.2标准:温度18-26℃,相对湿度45-65%。
4.2.5高效过滤器检漏4.2.5.1检测频次:A级区每半年用尘埃粒子计数扫描巡检法进行一次过滤器完整性测试,每年用气溶胶法进行一次过滤器完整性测试;B级、C级区每年用气溶胶法进行一次过滤器完整性测试,D级区每年用尘埃粒子计数扫描巡检法进行一次过滤器完整性测试。
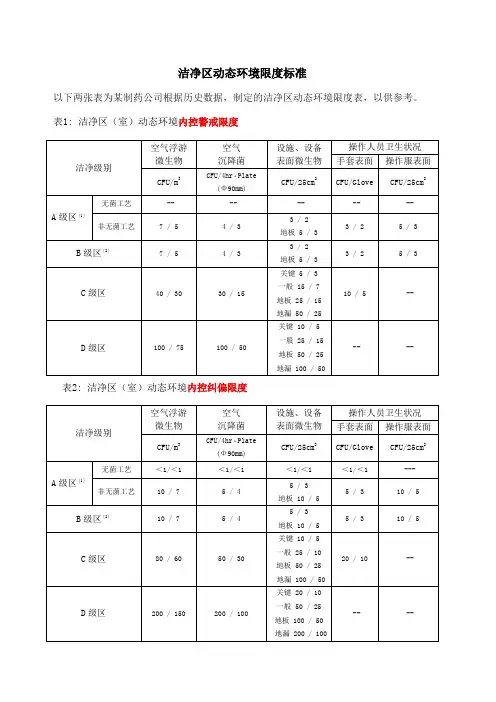
洁净区动态环境限度标准
以下两张表为某制药公司根据历史数据,制定的洁净区动态环境限度表,以供参考。
表1: 洁净区(室)动态环境内控警戒限度
表2: 洁净区(室)动态环境内控纠偏限度
说明:
[1]通常情况下,无菌灌封间的A级区内不得检出微生物
[2]B级区内一旦出现霉菌,即判定为超出警戒限度
[3]表示“单个值/ 平均值”,以下同上。
[4]数值前未加“<(小于)”,则代表“≤(小于或等于)”该数值
[5]-- 表示不予规定
[6]对于A级区的微生物监测标准,需要区分无菌生产工艺(B+A)和非无菌生产工艺(C+A)。
依据:《GMP》、企业药品生产实际目的:建立洁净区的环境卫生管理标准并遵照执行,以保证洁净区的环境卫生范围:洁净区环境卫生1.洁净区环境卫生除必须达到非洁净区环境卫生规程的要求外,还必须达到以下要求:1.1保持洁净区所有的建筑物内表面光滑平整、无裂缝、接口严密、无颗粒脱落,并能耐受清洗和消毒,墙壁与地面的交界处应采取措施,以减少灰尘积聚和便于清洁。
1.2 洁净区与非洁净区之间缓冲间应完好,缓冲间两侧门不能同时打开。
1.3 工作中必须关开门时,尽量减少开启次数及控制洁净区的人数为最少。
1.4 洁净区内各种操作活动要稳、准、轻,不做与工作无关的动作,各种活动(操作)应限制在最低限度,不得做剧烈运动。
2.不必要的物品不允许带入洁净区,各种进入洁净区的器具、容器、工具及其它必须按规定程序进行清洁、消毒后方可进入。
3.应尽量减少使用不易清洗的凹陷和凸出的壁架、橱柜和设备。
4.洁净区洁具室除符合非洁净区清洁要求外,还应保持通风、干燥;洁具架、拖把、抹布等要及时干燥,防止产生霉菌。
5.记录用纸、笔需经洁净、消毒程序后方可带入洁净区。
所用纸笔不发尘,不能用铅笔、橡皮、钢笔,而应用圆珠笔。
洁净区内不设记事板。
6.生产过程中的废弃物应及时装入洁净的容器中密闭,放入指定地点,并按规定在工作结束后及时清除出洁净区。
7.及时按规定对洁净区的设备表面、容器、管道、环境及其它进行清洁、消毒。
8.洁净区使用的清洁剂、消毒剂不得对设备、物料或成品产生污染;消毒剂方式以臭氧、紫外灯照射或一定浓度的消毒剂为宜;消毒剂应交替使用,防止产生耐药菌株。
9.洁净区空调在生产中不得中断运行,保持室内正压,并防止室内结露。
10.洁净室不得安排三班生产,每天必须有足够的时间用于清洁与消毒。
更换批次或品种时,要保证有足够的时间间歇清场、清洁与消毒。
11.洁净区环境控制标准11.1洁净级别:100级、10000级、30万级温度:18℃-26℃,相对湿度:45%-65%压差:洁净区空气洁净级别不同的相邻房间之间的静压差应大于5Pa;洁净室与室外大气的静压差应大于10Pa。

洁净服微生物限度标准
摘要:
1.洁净室设备表面微生物限度标准
2.人员手部微生物限度标准
3.相关规定及标准来源
正文:
洁净室设备表面微生物限度标准:
洁净室设备表面微生物限度标准是指在洁净室环境中,设备表面允许存在的微生物数量的最高限度。
这一标准旨在确保洁净室设备表面不会对洁净室环境产生污染,从而保证洁净室环境的洁净度。
在洁净室设备表面微生物限度标准中,通常会包括以下几类微生物:细菌、真菌、酵母菌和霉菌。
针对这些微生物,标准会规定它们在设备表面上的最大允许数量。
人员手部微生物限度标准:
人员手部微生物限度标准是指在洁净室环境中,人员手部允许存在的微生物数量的最高限度。
这一标准旨在确保洁净室人员手部不会对洁净室环境产生污染,从而保证洁净室环境的洁净度。
在人员手部微生物限度标准中,通常会包括以下几类微生物:细菌、真菌、酵母菌和霉菌。
针对这些微生物,标准会规定它们在手部皮肤上的最大允许数量。
相关规定及标准来源:
洁净室设备表面微生物限度标准和人员手部微生物限度标准通常由国家和行业的相关机构或组织制定。
在我国,这些标准主要由国家质量监督检验检疫总局(AQSIQ)和国家标准化管理委员会(SAC)制定。
具体而言,洁净室设备表面微生物限度标准主要参照《洁净室设备表面微生物限度》(GB/T 16292-2010)这一国家标准;人员手部微生物限度标准主要参照《洁净室人员手部微生物限度》(GB/T 16293-2010)这一国家标准。
综上所述,洁净室设备表面微生物限度标准和人员手部微生物限度标准是确保洁净室环境洁净度的重要措施。

1-5级洁净度环境要求标准一、尘埃数量1级:洁净室内每立方米空气中直径大于0.5µm的尘埃粒子数不超过3500000个。
2级:洁净室内每立方米空气中直径大于0.5µm的尘埃粒子数不超过3500000个。
3级:洁净室内每立方米空气中直径大于0.5µm的尘埃粒子数不超过1800000个。
4级:洁净室内每立方米空气中直径大于0.5µm的尘埃粒子数不超过1800000个。
5级:洁净室内每立方米空气中直径大于0.5µm的尘埃粒子数不超过900000个。
二、微生物含量1级:洁净室内微生物(包括细菌、霉菌和酵母菌)含量不得超过国家规定标准。
2级:洁净室内微生物(包括细菌、霉菌和酵母菌)含量不得超过国家规定标准。
3级:洁净室内微生物(包括细菌、霉菌和酵母菌)含量不得超过国家规定标准。
4级:洁净室内微生物(包括细菌、霉菌和酵母菌)含量不得超过国家规定标准。
5级:洁净室内微生物(包括细菌、霉菌和酵母菌)含量不得超过国家规定标准。
三、空气流速1级:洁净室内空气流速应保持稳定,无明显的涡流和死角,流速控制在0.2-0.5m/s之间。
2级:洁净室内空气流速应保持稳定,无明显的涡流和死角,流速控制在0.2-0.5m/s之间。
3级:洁净室内空气流速应保持稳定,无明显的涡流和死角,流速控制在0.3-0.6m/s之间。
4级:洁净室内空气流速应保持稳定,无明显的涡流和死角,流速控制在0.4-0.7m/s之间。
5级:洁净室内空气流速应保持稳定,无明显的涡流和死角,流速控制在0.5-1.0m/s之间。
四、压差1级:洁净室内应保持一定的压差,一般应在10-30Pa之间。
相邻不同级别洁净室之间,高级别洁净室的压力高于低级别洁净室的压力。
对于同一洁净度级别的不同功能区域,通常应保持相同的压力,或至少相差不应超过5Pa。
在有特殊要求的情况下,如制药行业,不同洁净室之间的压差可能会更大。
同时,要确保门的密封性能良好,以维持洁净室的压差稳定。

车间微生物控制要求标题:车间微生物控制要求引言概述:车间微生物控制是在工业生产过程中,通过采取一系列措施来控制和减少微生物的生长和繁殖,以确保产品的质量和安全。
本文将从四个方面详细阐述车间微生物控制的要求。
一、环境控制1.1 温度控制:车间内的温度应控制在适宜的范围内,不同微生物对温度的要求不同,普通来说,细菌和霉菌的生长温度较广,而病毒对温度较为敏感。
1.2 湿度控制:车间湿度应保持在适宜的水平,过高的湿度容易导致微生物滋生,而过低的湿度则会影响微生物的生长和繁殖。
1.3 通风控制:车间应保持良好的通风系统,以保证空气流通,减少微生物在空气中的传播和积聚。
二、人员卫生2.1 健康检查:车间工作人员应定期进行健康检查,特殊是对于患有传染病的人员,应暂时调离工作岗位,以防止微生物的传播。
2.2 个人卫生:车间工作人员应保持良好的个人卫生习惯,包括勤洗手、穿戴干净的工作服和鞋套,避免直接接触产品和原料。
2.3 培训教育:车间工作人员应接受相关的微生物控制培训,了解微生物的特性、传播途径以及控制方法,提高对微生物控制的认识和意识。
三、设备清洁与消毒3.1 设备清洁:车间设备应定期进行清洁和维护,特殊是与产品接触的设备,应采取适当的清洁剂和方法进行清洗,以防止微生物的残留。
3.2 设备消毒:车间设备应定期进行消毒处理,特殊是在生产过程中易受微生物污染的设备,如发酵罐、灌装机等,应采取适当的消毒剂和方法进行消毒。
3.3 废物处理:车间废物应及时清理和处理,特殊是生产过程中产生的有机废物,应采取适当的处理方式,以防止微生物的滋生和传播。
四、质量控制4.1 原料检验:车间应对进入车间的原料进行检验,特殊是易受微生物污染的原料,如生鲜食品、生物制剂等,应进行微生物指标的检测,确保原料的质量安全。
4.2 产品检验:车间应对生产出的产品进行微生物指标的检测,确保产品符合相关的微生物控制标准。
4.3 环境监测:车间应定期进行环境微生物的监测,包括空气、水和表面的微生物检测,以及对微生物的种类和数量进行分析,及时发现和解决问题。

洁净生产区卫生管理规程一、目的:规范洁净区卫生管理工作,使洁净区卫生管理工作标准化、规范化。
二、适用范围:公司所有洁净生产区和洁净检验区。
三、责任人:操作人员、工序负责人、车间主任、部门负责人、QA人员及进入该区的其他所有人员对本规程的实施负责。
四、内容:1. 环境卫生1.1洁净区的内表面(墙壁、顶棚、门窗、地面等)应当平整光滑、无裂缝、接口严密、无颗粒物脱落,无积尘,便于有效清洁和消毒。
1.2 洁净区的温湿度、尘埃粒子、沉降菌数、静压差等应符合相应级别洁净区的控制要求。
1.3 洁净区内各气闸及所有闭锁装置应完好无损。
洁净区的空调净化系统应于每天上班前2小时开启,其中运行1小时后,臭氧消毒半小时,置静半小时。
洁净区空调净化系统应连续运行,工作间歇时空调应做值班运行,保持室内正压,并防止结露。
1.4洁净生产区不得安排三班生产,每天必须有足够的时间用于清洁与消毒,更换品种要保证有足够的时间间歇用于清场、清洁与消毒。
1.5洁净区内进行各种操作活动时要稳、准、轻,不得做与工作无关的动作,各种活动(操作)应限制在最低而有效的幅度范围内。
1.6 生产过程中应关闭操作间门窗,尽量减少出入次数;产生的废弃物应及时入桶并密闭存放在洁净区内指定地点,工作结束后将其及时清除出洁净区。
1.7 洁净生产区内应尽量减少使用不易清洗的凹陷或凸出的壁架、橱柜和设备,生产所用纸笔不得发尘,不能用铅笔、橡皮、钢笔,一般用中性笔进行书写工作。
洁净区不设告示板、记事板。
1.8 洁净区清洁间和清洁工具除应符合一般生产区的清洁要求外,还应保持清洁间通风干燥;清洁工具如拖把、抹布等应采用不产脱落物材质,并在使用后及时清洁晾干,防止产生霉菌。
清洁剂、消毒剂应轮换使用,以免产生耐药性微生物。
1.9 不得将非生产用物品、个人杂物等不必要的物品带入洁净区。
所用各种器具、容器、设备、工具应使用耐清洗、耐腐蚀的材料制作。
1.10所有器具、容器、设备、工具等应按规定程序进行清洁、消毒后方可按《物料、物品进出生产区标准操作规程》带入洁净区。
万级洁净区尘埃粒子标准
万级洁净区尘埃粒子标准是指在洁净区域内,空气中悬浮粒子、微生物、换气次数、压差、温度、湿度、照度和噪声等参数需要满足一定的标准,以确保生产过程的安全和产品质量。
以下是对万级洁净区尘埃粒子标准的介绍:
1.悬浮粒子最大允许数(个/m³):在万级洁净区内,悬浮粒子的最大允许数是35000个/m³。
其中,≥5μm的粒子数要控制在不超过2000个/m³,≥1μm的粒子数要控制在不超过35万个/m³。
2.微生物最大允许数(个/m³):万级洁净区内,微生物的最大允许数是10个/m³。
其中,细菌数要控制在不超过5个/m³,霉菌数要控制在不超过5个/m³。
3.换气次数(次/h):万级洁净区的换气次数需要达到25次/h,以确保空气流通和净化。
4.压差(Pa):万级洁净区内的压差需要保持在5-10Pa的范围内,以保证空气的流通和防止污染物的进入。
5.温度(℃):万级洁净区的温度需要控制在22-25℃之间,以保证生产过程的稳定和产品质量。
6.湿度(%):万级洁净区的湿度需要控制在45-60%之间,以保证生产过程的稳定和产品质量。
7.照度(lx):万级洁净区的照度需要达到300lx,以保证生产过程的可视性和安全性。
8.噪声(dB):万级洁净区的噪声需要控制在70dB以下,以保证生产过程的舒适性和安全性。
以上是万级洁净区尘埃粒子的标准,这些标准的执行可以保证生产过程的安全和产品质量,同时也可以提高生产效率和员工的工作舒适度。
Cleaning room/area environment monitor and control procedure(洁净室/区环境监控SOP)Author 作者:Date日期:赵春丽,QA Vice PresidentAssistant/QA副总经理助理Approved by 批准人:Date日期:李红坤,Production Dept.Associate Director /生产部副主管Approved by 批准人:Date日期:于立慧,QA Site VicePresident/QA厂区副总经理Change 修改内容:1.The acceptance criteria of mold were added for the microbe test./增加了微生物测试合格标准中霉菌的要求。
2.It was added that during the daily monitoring of pressuredifference, the designated environment monitoring personnel should fully open the door according to the related procedure requirement to check and confir m the reading of the corresponding differential manometer return to zero, and then close the door to check the reading of pressure difference and to confirm whether it’s withinthe standard requirement. /增加了日常压差监测时,指定的环境监测人员需按照规程要求将门打开,检查并确认压差表示数归零,然后关上门并检查压差计读数并确认是否符合标准要求。
洁净室环境控制风险评估报告一、目的无菌医疗器械产品的生产需要在洁净区内进行。
为确保产品无菌性能和安全性,微粒和微生物是洁净区生产环境控制的主要对象。
必须对洁净区的环境控制进行风险评估。
二、评估内容1、尘埃粒子数的控制。
对洁净室尘埃粒子数的控制,空气净化系统起着非常关键的作用。
空气洁净度要求为100级时,采用垂直和水平单向流流型,气流风速分别大于0.25米/秒和0.35米/秒;当空气洁净度要求为10000级、10000 0级时,采用非单向流,换气次数分别大于25次/小时和15次/小时(300000级换气次数不小于12次/小时),以便及时带走生产过程中产生的尘埃和粉尘,保持洁净室环境的洁净度。
2、严格控制洁净室与相邻房间之间的压差同样是保证生产房间空气洁净度的重要环节。
不同洁净级别的洁净室及洁净区与非洁净区之间的压差应大于5帕斯卡,洁净区与室外压差应大于10帕斯卡,且送风、回风和排风系流的启闭应联锁并按顺序操作,这样可以避免空气倒流,减少低级别尘埃对洁净室环境的污染。
每次生产前及一定的生产周期后须对清洁后的洁净室在静态条件下进行尘埃粒子数的检测,生产过程中应对关键控制点进行动态监控。
以评价和掌握洁净室尘埃粒子的含量,确保控制在规定范围之内。
3、生物检测洁净室在使用前空气净化系统应提前4小时开启。
检测尘埃粒子用尘埃粒子计数器,在环境卫生清洁后缓冲0.5~1小时之后进行,为避免人为造成的污染,静态测试或动态时洁净室内仅限两人。
4、微生物含量的控制。
控制洁净室环境中的微生物含量仍然是靠良好的空气净化系统设施,其过滤效率可以达到99.9%~99.99%地滤除空气中的细菌和尘埃。
生产中洁净室内温度严格控制在18~26℃、相对湿度控制在45%~65%,以破坏有利于细菌的生长条件,加之消毒液的清洁消毒,确保环境控制效果符合规定。
5、日常消毒液消毒,每天生产结束后,用75%乙醇或2‰新洁尔灭溶液擦拭机台、桌面、门窗、墙壁等,用3%~5%的来苏儿对地面擦拭消毒。