实验一 循环伏安法判断电极过程
- 格式:doc
- 大小:58.50 KB
- 文档页数:3
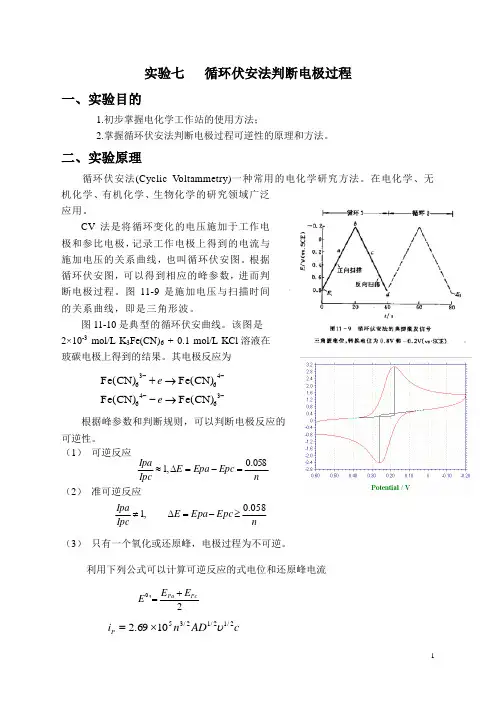
实验七 循环伏安法判断电极过程一、实验目的1.初步掌握电化学工作站的使用方法;2.掌握循环伏安法判断电极过程可逆性的原理和方法。
二、实验原理循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。
CV 法是将循环变化的电压施加于工作电极和参比电极,记录工作电极上得到的电流与施加电压的关系曲线,也叫循环伏安图。
根据循环伏安图,可以得到相应的峰参数,进而判断电极过程。
图11-9是施加电压与扫描时间的关系曲线,即是三角形波。
图11-10是典型的循环伏安曲线。
该图是 2×10-3 mol/L K 3Fe(CN)6 + 0.1 mol/L KCl 溶液在玻碳电极上得到的结果。
其电极反应为可逆性。
(1) 可逆反应(2) 准可逆反应(3) 只有一个氧化或还原峰,电极过程为不可逆。
利用下列公式可以计算可逆反应的式电位和还原峰电流----→-→+36464636Fe(CN)Fe(CN)Fe(CN)Fe(CN)e e n Epc Epa E Ipc Ipa 058.0,1=-=∆≈,1≠Ipc Ipa n Epc Epa E 058.0≥-=∆2'0Pc PaE E E +=cAD n i P 2/12/12/351069.2υ⨯=三、仪器与试剂1. CHI660A型电化学工作站(美国CHI公司);三电极体系:工作电极为玻碳电极(d =3㎜)参比电极为饱和甘汞电极(SCE)辅助电极为铂丝电极;2. 超声波清洗器(KQ218型,昆山市超声仪器有限公司)。
3. 2×10-3 mol/L K3Fe(CN)6 + 0.1 mol/L KCl四、实验步骤1. 工作电极预处理2. 装溶液3. 连接三电极4. 选择参数(E i=0.5V, E n=-0.20V,S=1e-5A/V ),作扫描速率为0.05、0.1、0.2、0.3、0.5V/s的循环伏安曲线。

循环伏安法判断电极过程实验报告循环伏安法判断电极过程实验报告引言:循环伏安法是一种常用的电化学测试方法,用于研究电极材料的电化学行为。
本实验旨在通过循环伏安法测定电极材料的氧化还原反应特性,并分析实验结果,探讨其在电化学领域的应用前景。
实验材料与方法:实验所用材料为铂电极和铜电极,实验仪器为循环伏安仪。
首先,将铂电极和铜电极分别清洗并抛光,以确保电极表面的纯净度和光滑度。
然后,将电极插入电解质溶液中,并设置循环伏安仪的扫描速度和电位范围。
接下来,进行循环伏安法测试,记录电流与电位之间的关系曲线。
实验结果与分析:通过循环伏安法测试,我们得到了铂电极和铜电极的电流-电位曲线。
根据曲线的形状和特点,我们可以得到以下结论和分析:1. 铂电极的电流-电位曲线呈现出典型的双电极峰形状,其中一个峰对应氧化反应,另一个峰对应还原反应。
这说明铂电极在测试条件下发生了氧化还原反应,具有良好的电化学活性。
这一特性使得铂电极在催化剂、电池等领域有着广泛的应用前景。
2. 铜电极的电流-电位曲线呈现出单峰形状,没有出现双电极峰。
这说明铜电极在测试条件下只发生了一种氧化还原反应,具有较低的电化学活性。
然而,铜电极在电化学合成、电镀等领域仍然有着重要的应用,其特殊的电化学行为可以被利用。
3. 通过对电流-电位曲线的分析,我们可以得到电极反应的动力学参数,如峰电位、峰电流等。
这些参数可以进一步用于计算电极的表面积、电荷转移速率等重要参数,为电极材料的性能评价提供参考。
结论:本实验通过循环伏安法测试了铂电极和铜电极的电流-电位曲线,并对实验结果进行了分析。
通过曲线的形状和特征,我们可以了解电极材料的氧化还原反应特性和电化学活性。
这对于电化学领域的研究和应用具有重要意义。
循环伏安法作为一种常用的电化学测试方法,具有广泛的应用前景,可以用于研究各种电极材料的性能,并为相关领域的发展提供支持。
总结:循环伏安法是一种重要的电化学测试方法,通过测定电流-电位曲线,可以研究电极材料的氧化还原反应特性和电化学活性。
![《仪器分析实验》(循环伏安法判断电极过程)[详细讲解]](https://uimg.taocdn.com/e2ce933b7275a417866fb84ae45c3b3566ecdd5f.webp)
一、实验目的1、了解电化学工作站的基本构造和使用方法。
2、理解并掌握循环伏安法判断电极过程的原理和方法。
二、实验原理
1、 峰电流方程式:
c
v K i p ⋅⋅=21 c
i p ∝ 21
v i p ∝
2、 可逆性判断?①1≈pc pa
i i ②mV n
pc pa p 56=-=∆ϕϕϕ
三、仪器设备
1、 电化学分析仪:
(LK2005A ,连接到计算
机)。
2、 三电极系统:以铂电极为对电极,Ag|AgCl 电极(或甘汞电极)为参比电极,玻碳电极为工作电极构成三电极系统。
四、实验步骤
1、 电极的预处理。
2、 不同扫描速率下K 3Fe(CN)6溶液的循环伏安图。
3、 不同浓度的K 3Fe(CN)6溶液的循环伏安图。
五、数据处理
循环伏安图
六、思考题
1、为什么要使用三电极系统?
2、循环伏安法如何判断电极过程是否可逆?
附:电化学工作站基本操作
1、打开计算机的电源开关,打开LK2005A电化学工作站主机的电源开关。
2、在WindowsXP操作平台下运行“LK2005A.exe”,进入主界面。
3、方法选择。
4、参数设定。
5、开始实验。
6、保存数据。
7、数据处理。
8、关机。
附:快捷命令
附:三电极系统
目的:减少iR 降
W: 工作电极
R: 参比电极
C: 辅助电极
i : 由W 和C 电路获得 电路获得和由R W w :。


研究生实验报告高乃群实验1 循环伏安法判断电极过程一、实验目的1.掌握用循环伏安法判断电极过程的原理。
2.掌握峰电流和峰电势的测量方法。
3.了解IM6/IM6e 电化学工作站的有关操作。
二、实验原理循环伏安法是在电极上施加线性扫描电压,扫描电势E=Ei-Vt 。
扫至某电势值后,再回扫至原来的起始电势Ei 。
电势和时间的关系如下图(a )所示,所得的循环伏安法的电流电势曲线为下图(b)所示:图1循环伏安法原理(a )电势-时间曲线(b )电势-电流曲线如果溶液中存在氧化态(Ox),电极上发生还原反应:d Ze Ox Re →+。
反相扫描时,电极上生成的还原态(Red)将发生氧化反应:Ze Ox d +→Re 。
其峰电流(i P )与被测物质的浓度(c ),扫描速率v 等因素有关:C v t m D KZ i p 2/13/23/22/12/3=。
从循环伏安图可确定氧化峰电流i pa 和还原峰电流i pc ,氧化峰电势E p a 和还原峰电势E pc 。
对于可逆氧化还原体系,氧化峰电流和还原峰电流之比:i pa /i p c =1。
由此可判断电极过程的可逆性。
氧化峰峰电势和还原峰峰电势之差:)(058.0V Z E E E c a P P ≈-=∆。
条件电势:2'0ca P P E E E +=。
三 、仪器和试剂1.仪器:IMe/IM6e 电化学工作站,铂片电极2支,饱和甘汞电极。
2.试剂:K 3Fe(CN)6(1.00X10-2mol•L -1),KNO 3(1.0mol•L -1)。
四 、实验内容1. IM6/IM6e 电化学工作站的操作⑴依次打开计算机、主机、打印机及显示器的电源开关,预热5min 。
⑵打开计算机桌面上的电化学工作站的操作软件,按“D (program start/initializing )”启动THALES 软件。
⑶鼠标操作:鼠标左键可选中某个选项,点鼠标中键退出当前的软件操作界面。

循环伏安法测定电极反应一、实验目的1、学习循环伏安法测定电极反应的基本原理和方法。
2、熟悉电化学工作站的使用并根据所测数据验证并判断电极反应是否是可逆反应。
二、实验原理伏安分析法是在一定电位下测量体系的电流,得到伏安特性曲线。
根据伏安特性曲线进行定性定量分析。
循环伏安法是将对称的三角波扫描电压(如图一)施加于电解池的电极上,记录工作电极上的电流随电压变化的曲线。
在三角波的前半部分,电极上若发生还原反应(阴极过程),得到一个峰形的阴极波;而在三角波的后半部分,则得到一个峰形的阳极波。
一次三角波电压扫描,电极上完成一个氧化还原循环。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)做图,就得到了循环伏安图(如图二所示)。
图一图二E pc、E pa分别为阴极峰值电位与阳极峰值电位。
i pc、i pa分别为阴极峰值电流与阳极峰值电流。
这里p代表峰值,a代表阳极,c代表阴极。
[Fe(CN)6]3--[Fe(CN)6]4-体系氧化还原电对的标准电极电位为:[Fe(CN)6]3- + e- = [Fe(CN)6]4-φθ= 0.36V电极电位与电极表面活度的Nernst方程式为:φ=φθ+ nRT/Fln(αOx/αRed)。
若已知γ为活度系数,则αOx=γ•C Ox,αRed=γ•C Red。
在实验中,通常采用添加离子调节液(如KNO3溶液、Na2SO4溶液等)的方法来固定离子强度,此时γ可视为定值,则φ=φθ+ nRT/Fln(C Ox/C Red)。
用循环伏安法正扫时(由正向负的扫描)为阴极扫描,产生还原电流:Fe(CN)63- + e- = Fe(CN)64-反扫时(由负向正的扫描)为阳极扫描,产生氧化电流:Fe(CN)64- - e- = Fe(CN)63-两峰之间的电位差值为:(1)对于一个体系,循环伏安图中的阴极峰电流是由电极上吸附反应物的还原和溶液中反应物扩散到电极表面还原两部分组成。


循环伏安法判断电极过程实验人:王壮 同组实验:余晓波 实验时间:2016.2.22一、实验目的(1)掌握用循环伏安法判断电极过程的可逆性 (2)学习使用电化学工作站 (3)测量峰电流和峰电位二、实验原理循环伏安法与单扫描极谱法类似。
在电极上施加线性扫描电压,当到达某设定的终止电压后,再反向回扫至某设定的起始电压。
若溶液中存在氧化态O ,电极上将发生还原反应:O ze R +ƒ反向回扫时,电极上生成的还原态R 将发生氧化反应:R O ze +ƒ峰电流可表示为2221133322p i Kz D m t v c =峰电流与被测物质浓度c 、扫描速率v 等因素有关。
从循环伏安图可确定氧化峰峰电流pa i 和还原峰峰电流pc i 、氧化峰峰电位pa ϕ和还原峰峰电位pc ϕ。
对于可逆体系,氧化峰峰电流与还原峰峰电流比为1pa pci i =氧化峰峰电位与还原峰峰电位差为0.058=pa pc zϕϕϕ∆-≈ 条件电位'ϕo 为'=2pa pcϕϕϕ-o由此可以判断电极过程的可逆性三、仪器与试剂仪器:电化学工作站;金圆盘电极:铂圆盘电极或玻璃碳电极,铂丝电极和饱和甘汞电极。
试剂:-21.0010/mol L ⨯ K 3Fe(CN)6;1.0/mol L KNO 3 四、实验步骤1、电极的预处理 将电极表面进行抛光处理2、K 3Fe(CN)6溶液的循环伏安图在电解池中放入31.0010/mol L -⨯ K 3Fe(CN)6+0.50/mol L KNO 3溶液,插入铂圆盘(或金属盘)指示电极、铂丝辅助电极和饱和甘汞电极,通N 2除去O 2. 扫描速率20/mV s ,从0.800.20V +-:扫描,记录循环伏安图以不同扫描速率:10/,40/,60/,80/,100/mV s mV s mV s mV s mV s 和200/mV s ,分别记录从0.800.20V +-:扫描的循环伏安图。

循环伏安法判断电极过程实验者: 学号:31指导老师: 同组同学:实验时间:11月21日13:40~17:10一实验目的(1)掌握用循环伏安法判断电极的可逆性。
(2)学会使用循环伏安仪。
(3)学习测量峰电流和峰电位。
(4)验证峰电流与扫描速度和浓度之间的关系。
二实验原理循环伏安法(cyclic vo1tammetry)与单扫描极语法类似。
也是以快速线性扫描的方式施加极化电压于工作电极。
不同之处在于单扫描权谱法所施加的是锯齿波电压,而循环伏安法则是一等腰三角波电压(如图1所示)。
从起始电压Ei 开始沿某一方向作线性扫描到达终止电压Em 后,再以同样的速度反方向扫描至起始电压,完成一次循环。
当电位从正向负扫描时,电活性物质在电极上发生还原反应,产生还原波,其峰电流为ipc ,峰电位为Epc(如图2所示),当逆向扫描时,电极表面上的还原态物质发生氧化反应,其峰电流为ipa ,峰电位为Epa.于是一次三角波扫报可完成一个还原氧化循环。
若需要,可以进行连续循环扫描。
图1:三角波电压 图2:循环伏安图 从波峰到基线的垂直距离叫峰电流,以ip 表示。
波峰所对 应的电位称为峰电位,以Ep 表示。
峰电流方程式可以表示为:三仪器与试剂仪器: 电化学工作站;金圆盘电极、铂圆盘电极或玻碳工作电极,铂丝对电极和饱和甘汞电极或Ag/AgCl 参比电极。
试剂:21.0010/mol L -⨯ 36()e K F CN 溶液,1.0/mol L 3KNO 溶液。
四实验内容与步骤1. 磨电极:目的去除表面氧化层,抛光金电极,得到一个平滑光洁、新鲜的电极表面。
处理方法,依次使用1.0、0.3、0.05的23Al O 粉末在平板上研磨5mins 、5mins 、10mins 。
注意研磨过程中,电极一定要垂直放置,每次研磨后要用去离子水清洗干净。
2. 电极溶液的配制:36()e K F CN 储备液0.1mol/L; 3KNO 储备液1.0mol/L 。

循环伏安法判断电极应用过程一、摘要:根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。
因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流—电压曲线称为循环伏安图。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。
循环伏安法中电压扫描速度可从变化,一边多测定几组数据,提高实验的准确性二、前言:循环伏安法(Cyclic Voltammetry)一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
它可以作为研究无机化合物电极过程的机理、有机化合物在滴汞电极上的还原过程和在铂、碳及碳糊电极上氧化过程的机制。
研究双电层、吸附现象和电极反应动力学,成为最有用的电化学方法之一,循环伏安法可以应用于可逆过程标准电极电位的测定、电极过程产物的鉴别(1),初步研究电机体系可能发生的化学反应(2)、判断电极过程的可逆性(2)、研究电活性物质的吸脱附过程(2)、矿物质的研究(3)、染料和杀虫剂的分析(3)、润滑油抗氧剂含量的循环伏安法测定(4)、超声波-微分脉冲伏安法测定超痕量铜(5)、循环伏安法制备普鲁士蓝膜(6)、研究微孔型多孔炭电极的电容特性(7)、质子交换膜甲醇渗透(8)、铁-邻菲咯啉配合物的循环伏安-光谱电化学研究(9)、循环伏安法测定氢在贮氢合金中的扩散系数(10)、吸附伏安法同时测定中草药中痕量的镍和钴(11)、纳米级复合氢氧化镍的循环伏安研究(12)、血红蛋白模拟过氧化物酶催化H2O2氧化邻氨基酚的固体电极伏安法研究(13)。
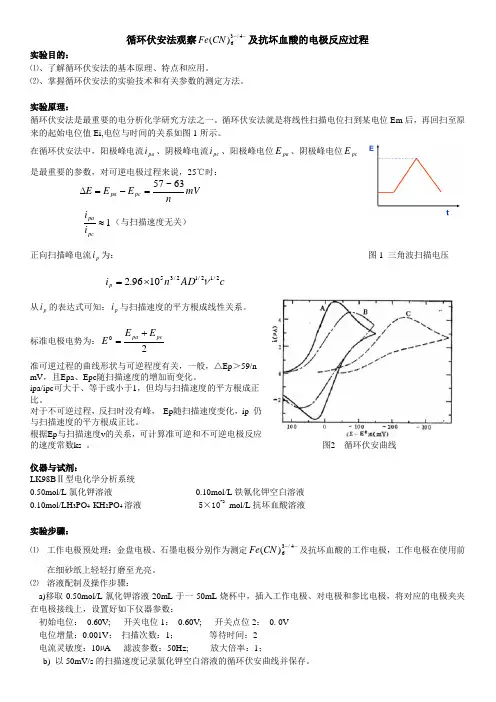
循环伏安法观察--4/36)(CN Fe 及抗坏血酸的电极反应过程 实验目的:⑴、了解循环伏安法的基本原理、特点和应用。
⑵、掌握循环伏安法的实验技术和有关参数的测定方法。
实验原理:循环伏安法是最重要的电分析化学研究方法之一。
循环伏安法就是将线性扫描电位扫到某电位Em 后,再回扫至原来的起始电位值Ei,电位与时间的关系如图1所示。
在循环伏安法中,阳极峰电流pa i 、阴极峰电流pc i 、阳极峰电位pa E 、阴极峰电位pc E 是最重要的参数,对可逆电极过程来说,25℃时: mV nE E E pc pa 63~57=-=∆1≈pcpa i i (与扫描速度无关)正向扫描峰电流p i 为: 图1 三角波扫描电压c AD n i p 2/12/12/351096.2ν⨯=从p i 的表达式可知:p i 与扫描速度的平方根成线性关系。
标准电极电势为:2pcpa E E E +=准可逆过程的曲线形状与可逆程度有关,一般,△Ep >59/n mV ,且Epa 、Epc 随扫描速度的增加而变化。
ipa/ipc 可大于、等于或小于1,但均与扫描速度的平方根成正比。
对于不可逆过程,反扫时没有峰, Ep 随扫描速度变化,ip 仍与扫描速度的平方根成正比。
根据Ep 与扫描速度v 的关系,可计算准可逆和不可逆电极反应的速度常数ks 。
图2 循环伏安曲线仪器与试剂:LK98B Ⅱ型电化学分析系统0.50mol/L 氯化钾溶液 0.10mol/L 铁氰化钾空白溶液0.10mol/LH 3PO 4-KH 2PO 4溶液 5×10-2mol/L 抗坏血酸溶液实验步骤:⑴ 工作电极预处理:金盘电极、石墨电极分别作为测定--4/36)(CN Fe 及抗坏血酸的工作电极,工作电极在使用前在细砂纸上轻轻打磨至光亮。
⑵ 溶液配制及操作步骤:a)移取0.50mol/L 氯化钾溶液20mL 于一50mL 烧杯中,插入工作电极、对电极和参比电极,将对应的电极夹夹在电极接线上,设置好如下仪器参数:初始电位: 0.60V; 开关电位1: 0.60V; 开关点位2: 0. 0V 电位增量:0.001V ; 扫描次数:1; 等待时间:2 电流灵敏度:10µA 滤波参数:50Hz; 放大倍率:1;b) 以50mV/s 的扫描速度记录氯化钾空白溶液的循环伏安曲线并保存。
循环伏安法测定电极反应参数
循环伏安法是一种电化学测试方法,用于测量电化学反应(例如电极反应)的参数。
具体步骤如下:
1. 准备电解质溶液和两个电极:一个工作电极、一个参比电极和一个辅助电极。
2. 把工作电极放入电解质溶液中并加入足够的电解质。
参比电极和辅助电极也必须放在溶液中,并且它们应该尽可能接近工作电极。
3. 将工作电极连接到电位计和电源,并将参考电极连接到电位计。
4. 通常会在一定范围内缓慢扫描电势范围。
开始时电位设置在较高值,随后电位逐渐减小至较低值,然后再逐渐升高至较高值。
扫描速率也是一个重要参数。
5. 当工作电极的电位被扫描时,会观察到电流变化。
这个输出信号可以记录下来。
可以用这个变化来确定电极反应参数,如反应速率、电荷转移系数、扩散系数和电化学反应的机理等。
6. 根据所得到的数据,可以进行一些计算,以确定电极反应的参数和性质。
循环伏安法是一种多用途的方法,适用于很多种电化学反应,包括金属离子的还原和氧化、化学反应的动力学参数等。
循环伏安法判断铁氰化钾的电极反应过程、目的要求1掌握用循环伏安法判断电极反应过程的可逆性2 •学会使用电化学工作站3•学会测量峰电流和峰电位,培养学生的动手操作能力及分析问题解决问题能力二、实验用品1.仪器:电化学工作站,三电极系统(两支铂电极,一支甘汞电极),电解杯数只2■试剂:铁氰化钾标准溶液(6.0 X O-3 mol/L, 1.00 沐0-5、1.00 为0-4、1.00 为0-3、1.00 X0-2含 KCl 溶液 1.0 mol/L),三、实验原理电化学工作站(Electrochemical workstation )是电化学测量系统的简称,是电化学研究和教学常用的测量设备。
将这种测量系统组成一台整机,内含快速数字信号发生器、高速数据采集系统、电位电流信号滤波器、多级信号增益、IR降补偿电路以及恒电位仪、恒电流仪。
可直接用于超微电极上的稳态电流测量。
如果与微电流放大器及屏蔽箱连接,可测量1pA或更低的电流。
如果与大电流放大器连接,电流范围可拓宽为=t2A。
动态范围极为宽广。
可进行循环伏安法、交流阻抗法、交流伏安法等测量。
循环伏安法是用途最广泛的研究电活性物质的电化学分析方法,在电化学、无机化学、有机化学、生物化学等领域得到了广泛的应用。
由于它能在很宽的电位范围内迅速观察研究对象的氧化还原行为,因此电化学研究中常常首先进行的是循环伏安行为研究循环伏安是在工作电极上施加一个线性变化的循环电压,记录工作电极上得到的电流与施加电压的关系曲线,对溶液中的电活性物质进行分析。
铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位:F e(CN)6 】+e_=〔Fe(CN)6 】护=0.36V( vs.NHE)选择施加在起始点的起始电位,沿负的电位正向扫描,当电位负到能够将O([Fe(CN)6]3-)还原时,在工作电极上发生还原反应: 0+ Ze = R,阴极电流迅速增加,电流达到最高峰,此后由于电极附近溶液中的O ([Fe(CN)6]3-)转变为R([Fe(CN)6]4-)而耗尽,电流迅速衰减;电压沿正的方向扫描,当电位正到能够将R([Fe(CN)6]4-) 氧化时,在工作电极表面聚集的 R将发生氧化反应:R= O+Ze,阳极电流迅速增加,电流达到最高峰,此后由于电极附近溶液中的R转变为0 ([Fe(CN)6]3-)而耗尽,电流迅速衰减;当电压达到的起始电位时便完成了一个循环。
实验⼀循环伏安法判断电极过程实验⼀循环伏安法判断电极过程⼀.实验⽬的1.学习和掌握循环伏安法的原理和实验技术。
2.了解可逆波的循环伏安图的特性以及测算玻碳电极的有效⾯积的⽅法。
3.学会使⽤电化学⼯作站⼆.实验原理循环伏安法是在固定⾯积的⼯作电极和参⽐电极之间加上对称的三⾓波扫描电压,记录⼯作电极上得到的电流与施加电位的关系曲线,即循环伏安图。
从伏安图的波形、氧化还原峰电流的数值及其⽐值、峰电位等可以判断电极反应机理。
与汞电极相⽐,物质在固体电极上伏安⾏为的重现性差,其原因与固体电极的表⾯状态直接有关,因⽽了解固体电极表⾯处理的⽅法和衡量电极表⾯被净化的程度,以及测算电极有效表⾯积的⽅法,是⼗分重要的。
⼀般对这类问题要根据固体电极材料不同⽽采取适当的⽅法。
对于碳电极,⼀般以Fe(CN)63-/4-的氧化还原⾏为作电化学探针。
⾸先,固体电极表⾯的第⼀步处理是进⾏机械研磨、抛光⾄镜⾯程度。
通常⽤于抛光电极的材料有⾦钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。
抛光时总是按抛光剂粒度降低的顺序依次进⾏研磨,如对新的电极表⾯先经⾦钢砂纸粗研和细磨后,再⽤⼀定粒度的α-Al2O3粉在抛光布上进⾏抛光。
抛光后先洗去表⾯污物,再移⼊超声⽔浴中清洗,每次2~3分钟,重复三次,直⾄清洗⼲净。
最后⽤⼄醇、稀酸和⽔彻底洗涤,得到⼀个平滑光洁的、新鲜的电极表⾯。
将处理好的碳电极放⼊含⼀定浓度的K3Fe(CN)6和⽀持电解质的⽔溶液中,观察其伏安曲线。
如得到如图所⽰的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc/i pa=1),峰峰电位差ΔE p约为70mV(理论值约60 mV),即说明电极表⾯已处理好,否则需要重新抛光,直到达到要求。
有关电极有效表⾯积的计算,可根据Randles-Sevcik公式:在25℃时,i p=(2.69×105)n3/2AD o1/2v1/2C o其中A为电极的有效⾯积(cm2),D o为反应物的扩散系数(cm2/s),n为电极反应的电⼦转移数,v为扫速(V/s),C o为反应物的浓度(mol/cm3), i p为峰电流(A)。
循环伏安法(Cyclic Voltammetry)是一种常用的电化学实验方法,用于研究电极上的反应动力学和电化学过程。
下面是循环伏安法测定电极反应参数的实验原理:
1. 实验装置:循环伏安法需要一个电化学工作站或循环伏安仪,以及电极(工作电极、参比电极和计数电极)和电解质溶液。
2. 实验步骤:首先,将待测溶液放置在电解质容器中,电解质溶液中可以加入适量的外加试剂或电化学活性物质。
然后,将工作电极插入溶液中,参比电极和计数电极也分别插入。
最后,通过设定电位扫描的起始电位和终止电位,以及扫描速率,进行电位扫描实验。
3. 电位扫描过程:在实验过程中,起始电位逐渐增加或减小,电位之间的差值称为扫描电位范围。
扫描速率决定了电位的变化速度。
电位的变化将引起电流的变化。
通过记录电位和电流之间的关系,可以得到电流-电位曲线,称为循环伏安曲线。
4. 分析和参数计算:通过分析循环伏安曲线,可以得到电极反应的参数,包括峰电位、峰电流、电荷转移系数、电荷转移速率常数等。
这些参数可以揭示电极反应的机理和动力学特性。
循环伏安法通过控制电位的变化,观察电流的响应,从
而研究电极反应的动力学和电化学过程。
它广泛应用于电化学分析、电化学催化、电化学能源存储等领域的研究和应用。
循环伏安法判断铁氰化钾的电极反应过程一、实验目的1. 掌握用循环伏安法判断电极反应过程的可逆性2. 学会使用伏安极谱仪3. 学会测量峰电流和峰电位二、实验原理循环伏安法是用途最广泛的研究电活性物质的电化学分析方法,在电化学、无机化学、有机化学、生物化学等领域得到了广泛的应用。
由于它能在很宽的电位范围内迅速观察研究对象的氧化还原行为,因此电化学研究中常常首先进行的是循环伏安行为研究。
循环伏安是在工作电极上施加一个线性变化的循环电压,记录工作电极上得到的电流与施加电压的关系曲线,对溶液中的电活性物质进行分析。
由于施加的电压为三角波,这种方法也称为三角波线性扫描极谱法。
典型的循环伏安图如图所示:U t+ - + + -+ + - +三角波 iE 还原峰 E pc i pc E pa 氧化峰 ab g h i j I 0.8V I –0.2V k i pa fcd e选择施加在a点的起始电位E i,然后沿负的电位即正向扫描,当电位负到能够将Ox还原时,在工作电极上发生还原反应:Ox + Ze = Red,阴极电流迅速增加(b-d),电流在d点达到最高峰,此后由于电极附近溶液中的Ox转变为Red 而耗尽,电流迅速衰减(d-e);在f点电压沿正的方向扫描,当电位正到能够将Red氧化时,在工作电极表面聚集的Red将发生氧化反应:Red = Ox + Ze,阳极电流迅速增加(i-j),电流在j点达到最高峰,此后由于电极附近溶液中的Red 转变为Ox而耗尽,电流迅速衰减(j-k);当电压达到a点的起始电位E i时便完成了一个循环。
循环伏安图的几个重要参数为:阳极峰电流(i pa)、阴极峰电流(i pc)、阳极峰电位(E pa)、阴极峰电位(E pc)。
对于可逆反应,阴阳极峰电位的差值,即△E=E pa-E pc ≈56 mV/Z,峰电位与扫描速度无关。
而峰电流i p=2.69×105n3/2AD1/2V1/2C,i p为峰电流(A),n为电子转移数,A 为电极面积(cm2),D为扩散系数(cm2/s),V为扫描速度(V/s),C为浓度(mol/L)。
实验一循环伏安法判断电极过程
一.实验目的
1.学习和掌握循环伏安法的原理和实验技术。
2.了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。
3.学会使用电化学工作站
二.实验原理
循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压,记录工作电极上得到的电流与施加电位的关系曲线,即循环伏安图。
从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。
一般对这类问题要根据固体电极材料不同而采取适当的方法。
对于碳电极,一般以Fe(CN)63-/4-的氧化还原行为作电化学探针。
首先,固体电极表面的第一步处理是进行机械研磨、抛光至镜面程度。
通常用于抛光电极的材料有金钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。
抛光时总是按抛光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨后,再用一定粒度的α-Al2O3粉在抛光布上进行抛光。
抛光后先洗去表面污物,再移入超声水浴中清洗,每次2~3分钟,重复三次,直至清洗干净。
最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。
将处理好的碳电极放入含一定浓度的K3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。
如得到如图所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc/i pa=1),峰峰电位差ΔE p约为70mV(理论值约60 mV),即说明电极表面已处理好,否则需要重新抛光,直到达到要求。
有关电极有效表面积的计算,可根据Randles-Sevcik公式:
在25℃时,i p=(2.69×105)n3/2AD o1/2v1/2C o
其中A为电极的有效面积(cm2),D o为反应物的扩散系数(cm2/s),n为电极反
应的电子转移数,v为扫速(V/s),C o为反应物的浓度(mol/cm3), i p为峰电流(A)。
三.仪器与试剂
1.LK2005型电化学工作站,玻碳电极(d=4mm)为工作电极,饱和甘汞电极
为参比电极,铂片电极为辅助电极;
2. 1.00×10-2mol/L铁氰化钾溶液;1.0mol/L氯化钾溶液;
四.实验内容
1.电极的预处理:将玻碳电极在鹿皮上用抛光粉抛光后,再用蒸馏水超声清洗
干净;
2.开启电化学工作站及计算机电源开关,启动电化学程序,在菜单中依次选择
线性扫描技术---循环伏安法,输入以下参数:
3.在电解池中放入1.00×10-3mol/L K3Fe(CN)6+1.0mol/LKCl溶液,插入玻碳电极
(绿色)、铂片电极(红色)、饱和甘汞电极(黄色),以扫描速率50mV/s,从-0.2~+0.6V扫描,记录循环伏安图,检验电极是否处理干净。
4.以不同扫描速率:10、50、100、150、200和250 mV/s,分别记录从-0.2~+0.6V
扫描的循环伏安图。
5.不同浓度的K3Fe(CN)6溶液的循环伏安图
以50 mV/s扫描速率,从-0.2~+0.6V扫描,分别记录1.00×10-2,7.50×10-3,
5.00×10-3,2.50×10-3和1.00×10-3 mol/L K3Fe(CN)6+1.0mol/L KCl溶液的循环
伏安图。
五.结果处理
1. 以氧化还原峰电流i pc、i pa分别与扫速的平方根v1/2作图,求算线性相关系数R。
2. 根据i pc与扫速的平方根v1/2作图得到的线性回归方程,计算所使用的玻碳电极的有效面积。
(所用参数:电子转移数n=1,K3Fe(CN)6的扩散系数D o=1×10-5 cm2/s)
3. 从实验结果说明K3Fe(CN)6在KCl溶液中电极过程的可逆性。
4. 以氧化还原峰电流i pc、i pa分别与K3Fe(CN)6溶液的浓度作图,求算线性相关系数R。
六.思考题
1.如何理解电极过程的可逆性?
2.如何判断碳电极表面处理的程度?
3.解释K3Fe(CN)6溶液的循环伏安图形状?
注意事项:
1.工作电极表面必须仔细清洗,否则严重影响循环伏安图图形。
2.每次扫描之间为使电极表面恢复初始条件,应将电极提起后再放人溶液中或
用搅拌子搅拌溶液,等溶液静止后再扫描。