临床试验项目启动审批表
- 格式:docx
- 大小:14.69 KB
- 文档页数:1


临床试验审批表(医疗器械类)
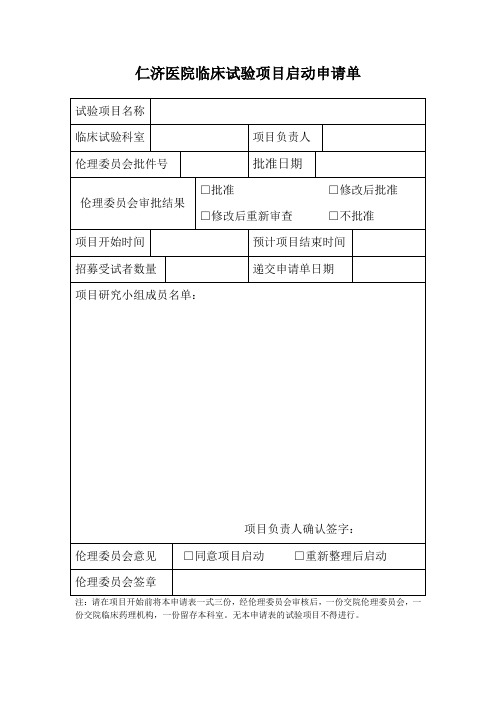
项目名称:
申请科室:
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、医疗器械分类:
1、□境内II类□境内III类□进口II类□进口III类
2、□有源□无源□体外诊断试剂
3、□植入□非植入
4、需进行临床试验审批的第三类医疗器械:□是□否
二、检验报告编号:
三、试验目的:
四、组长单位:负责人
五、适应症:
禁忌症:
六、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
七、试验样品
1、名称型号及规格批号
有效期
2、提供单位:
八、对照样品
1、名称型号及规格批号
有效期
2、提供单位:
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。


临床试验审批表(药物类)
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。
药物临床试验启动会确认表项目启动前准备工作:1.是否有临床试验批件且在有效期内:□是,口否2.临床试验合同和CrC协议是否已经签署完成:口是,□否3.项目首款是否己汇至医院指定账户:口是,口否4.是否己提交遗传办批件/公示:□是,口否,口不适用4.1EDC单位名称:,EDC单位资质是否提交机构:口是,口否是否为外资:口是,□否4.2行政审批类型:采集口保藏□国合审批口出境口国合备案口信息对外提供和开放使用备案口其他:______________________5.是否己将本中心在药物临床试验登记与信息公示平台登记:口是,登记号;口否,□不适用6.是否己提供启动会PPT:口是,口否7.是否己提供CRC/CRA委派函:□是,□否8.CRC是否己通过机构面试:口是,□否9.项目记录表(如评分表)是否已加盖机构受控章:口是,口否10.是否所有检验检查项目都能在本院开展:口是,□否,口不适用,其他:I1P1是否已确认团队分工,并提前告知对应人员:口是,口否12.其他: ______________________________________________________________________项目实施流程评估:1.试验药物管理:保存在GCP药房口科室GCP专用药柜□(请说明理由:)1.1试验用药物已按要求运送至中心,且保存了运输途中温湿度记录,运输温度计的校准证明,经清点无误后入库:□是,口否,口不适用,其他:1.2药物发放、回收记录表、温湿度记录表(如有)、处方模版、库存登记表、药检报告或相关说明是否齐全:口是,□否,口不适用,其他:1.3是否需要在静配中心统一配置再运送到科室:是口,否口1.4是否有符合要求的转运箱:口是,口否,口不适用1.5转运箱是否有可导出的温度记录:口是,□否,口不适用1.6是否要将药盒或者空瓶回收至中心药房:口是,□否1.7试验药物的处置记录表:口是,口否1.8剩余药物/药瓶是否授权本中心销毁:口是(请提供委托销毁的说明),□否2.试验物资提供2.1是否提供物资交接记录表:口是,口否2.2所提供的的物资有无相关校准证明或者合格证:□有,口无,口不适用3.生物样本管理:口是,□否3.1样本是否需运送至第三方实验室检测:口是,□否(1)科室是否满足生物样本处理及储存的要求:□是,口否(2)外送样本的类型:口血样,口组织,口其他(3)外送样本的检测内容:□PK,□ADA,口凝血功能,口其他(4)是否提供了第三方实验室资质:口是,口否(5)是否提供了样本管理手册:口是,□否(6)是否提供了样本采集、处理、保存、运送记录表:口是,□否(7)是否提供冰箱/柜温度记录表:口是,口否3.2样本是否需要由本院委托送至外院检测:口是,□否(1)是否已签署三方委托协议:□是,口否4.试验记录4.1科室能否独立记录病程并打印病历:口是,□否4.2知情同意过程、病程记录模板是否经机构确认:口是,口否4.3知情同意过程记录形式:口门诊电子病历口住院病程记录□纸质门诊病历□其他_4.4是否针对疗效指标的判定标准(如评分量表)等对研究者进行了重点培训授权:口是,口否4.5是否针对疗效指标的判定(如拍照、评分)提供操作规程,明确并收集评估者资质:□是,口否4.6是否提供生活质量等评分量表等并单独打印并受控:口是,口否5.试验开展流程其他相关问题及回复是否同意开展:是口,否口如否,建议:______________________________________________________________签字:日期:备注:1、试验药物请于启动会当天或启动会后及时运送药物至机构药房;2、质控频率:入组第1例,入组1/2,入组结束。
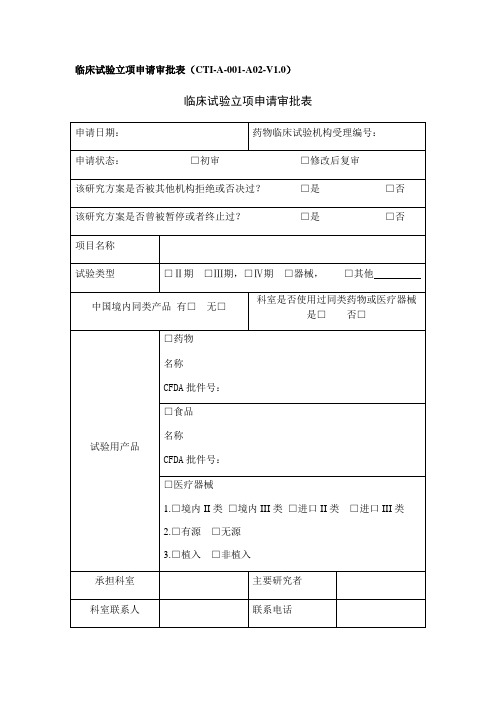
药物临床试验初始审查申请表一、研究信息药物临床试验分期口1期口11期口11I期□IV期口生物等效性试验口临床验证□其他: __________________方案设计类型口实验性研究口观察性研究:口回顾性分析口前瞻性研究□其他: __________________研究信息数据与安全监察委员会:口无,口有多中心临床试验:口否,□是τ口国际多中心组长单位,口国际多中心参加单位□国内多中心组长单位,□国内多中心参加单位本研究是否已在其他中心启动:口是,口否,口不适用研究使用人体生物标本情况:口研究中采集,口利用以往保存的,口不使用涉及人类遗传资源管理情况:口备案,口批准,口不涉及研究类型:口未上市,药品注册研究;口已上市,用于申请修改说明书研究;口已上市,非注册性、非修改说明书研究试验是否为两阶段适应性设计:□否口是T在本中心开展阶段:,若非首阶段研究,前期研究是否已完成并提交研究数据:口是,口否研究是否取得国家药监部门同意:口是,口否一口有与国家药监局的沟通交流会议记要:T请同时递交。
口与递交国家药监局资料一致,口与递交国家药监局资料不一致,说明:试验设计总例数:,本中心计划招募受试者人数:预期研究时间:年月至年月(伦理收费及批准研究时间以此为准)招募方式及人群招募者:口医生,口研究人员,口中介公司,口其他:招募方式:口发布招募广告,口临床诊疗过程,口数据库,□其他:研究是否涉及弱势人群或个体:□否口是T弱势的具体特征:________________________________________________________ 针对性的附加保护措施:__________________________________________________ 受试者补偿和支付计划口无补偿口有补偿:口货币补偿,补偿理由及数额:_____________________________________________ 口非货币补偿,说明:____________________________________________________ 支付计划(请详细描述发放周期及流程):受试者参与研究的费用谁支付研究干预和研究程序的费用:研究药物费用支付者:□申办者,口受试者,口其他:研究理化检查费用支付者:□申办者,口受试者,口其他:其他,说明:____________________________________________________________知情同意谁获取知情同意:口主要研究者,口研究者,口其他:获取知情同意地点:口私密房间/受试者接待室,口诊室,口病房,口其他:知情同意签字:口受试者签字,口监护人签字知情同意的例外口否,口是τ口申请变更知情同意,口申请豁免知情同意理由: _______________________________________________________________ 研究者其他研究工作本人在研的研究项目数:—项,其中与本项目目标疾病相同的项目数:一项。