器械不良事件报告表样表
- 格式:docx
- 大小:49.23 KB
- 文档页数:3


可疑医疗器械不良事件报告表报告日期:年月日编码:报告来源:生产企业经营企业使用单位单位名称:::联系:A.患者资料C.医疗器械情况1.XX:2.年龄:3.性别男女11.产品名称:12.商品名称:4.预期治疗疾病或作用:13.注册证号:B.不良事件情况14.生产企业名称:5.事件主要表现:生产企业地址:6.事件发生日期:年月日企业联系:7.发现或者知悉时间:年月日15.型号规格:8.医疗器械实际使用场所:产品编号:产品批号:医疗机构家庭其它〔请注明〕:9.事件后果16.操作人:专业人员非专业人员患者其它〔请注明〕:死亡〔时间〕;17.有效期至:年月日危及生命;18.生产日期:年月日机体功能构造永久性损伤;可能导致机体功能机构永久性损伤;19.停用日期:年月日需要内、外科治疗防止上述永久损伤;20.植入日期(假设植入):年月日其它〔在事件陈述中说明〕。
21.事件发生初步原因分析:10.事件陈述:〔至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影22.事件初步处理情况:响、采取的治疗措施、器械联合使用情况〕23.事件报告状态:已通知使用单位已通知生产企业已通知经营企业已通知药监部门D.关联性评价(1)使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序?是□否□(2)已发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?是□否□不清楚□(3)已发生/可能发生的伤害事件是否可用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释?是□否□不清楚□评价结论:很可能□可能有关□可能无关□无法确定□E.不良事件评价24.省级监测技术机构评价意见〔可另附附页〕:25.国家监测技术机构评价意见〔可另附附页〕:报告人:医师技师护士其他报告人签名:填写要求:?可疑医疗器械不良事件报告表?由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7局部组成。

可疑医疗器械不良事件汇报表汇报日期:年月日编码: 汇报起源: 生产企业 经营企业 使用单位单位名称:联络地址: 邮编:联络电话:汇报人:医师 技师 护士 其它汇报人署名:填写要求:《可疑医疗器械不良事件汇报表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A.汇报日期:是指填报人填报该次不良事件时确实切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方法:省(区、市)年份流水号□□□□□□□□□□□注:省(区、市)编码按中国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.汇报起源:是指填报可疑医疗器械不良事件单位类别,填写时请选择对应选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位全称,不可用简称。
E.联络地址、电话及邮编:是指填报可疑医疗器械不良事件单位联络地址、电话及邮编。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女。
B.年纪:是指患者发生可疑医疗器械不良事件时实际年纪,字体为阿拉伯数字。
若患者年纪小于1岁,应填写具体月份或天数,如6个月。
C.性别:是指患者性别,填写时请选择对应选项,并在“□”中划“√”。
D.预期诊疗疾病或作用:是指包含不良事件医疗器械用于诊疗疾病或估计使用该医疗器械所发挥作用,比如血管内支架用于诊疗急性心肌梗死。
3.不良事件情况A.事件关键表现:是指使用医疗器械后引发、可能和该医疗器械使用相关有害事件(且和质量、医疗事故无关)。
填写不良事件关键表现要明确、具体,如放臵节育器后,出现意外脱落者,可填写“节育器脱落”。
B.事件发生日期:是指不良事件发生确实切时间,如:×年×月×日,字体为阿拉伯数字。
C.发觉或知悉时间:是指汇报单位发觉或知道可疑医疗器械不良事件确实切时间,如:×年×月×日,字体为阿拉伯数字。


国家食品药品监督管理局制可疑医疗器械不良事件报告表报告日期:报告来源: 联系地址:A. 患者资料1.姓名:2 .年龄: 3•性别 男 女4 .预期治疗疾病或作用:B. 不良事件情况5. 事件主要表现: 6 .事件发生日期: 年 月曰 7 •发现或者知悉时间: 年 月曰8. 医疗器械实际使用场所:医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
10. 事件陈述:(至少包括器械使用时间、使用目的、使 用依据、使用情况、出现的不良事件情况、对受害者影 响、采取的治疗措施、器械联合使用情况)报告人: 医师 技师 护士 其他邮 编:联系电话:报告人签名:附件1:年 月曰生产企业经营企业例子:附件1:可疑医疗器械不良事件报告表报告日期:2010年10月25日 编 码:邮 编:联系电话:A. 患者资料1.姓名:2 .年龄:3•性别男女"4 •预期治疗疾病或作用:输液B. 不良事件情况5•事件主要表现:穿刺部位红肿 6.事件发生日期: 2010年10 月22日7 .发现或者知悉时间: 2010年10月22日8. 医疗器械实际使用场所:V 医疗机构 家庭 其它(请注明):9. 事件后果死亡 _________________________________ (时间); 危及生命;机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤;V 其它(在事件陈述中说明)。
国家食品药品监督管理局制报告来源: 生产企业 经营企业 "使用单位 单位名称:按实际填写联系地址:按实际填写10. 事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)患者于2010年10月20日在我院留医治疗使用一次性使用静脉留置针,穿刺部位于穿刺输液后2天出现皮肤红肿,无发热等现象,拔除一次性使用静脉留置针1天后症状消失。

医疗器械不良事件监测报告表报告日期:年月日报告来源:? 生产企业 ? 经营企业 ? 使用单位单位名称(单位盖章):联系地址: 邮编:联系电话:编? ? ? ? ? ? ? ?报告人:医师? 技师? 护士? 其他?报告人签名:可疑医疗器械不良事件报告表填写说明国家药品不良反应监测中心一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称;2、若有内容填写不下,可加附表说明;3、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式;相关事件在以下情况必须报告:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。

医疗器械不良反应报告表《可疑医疗器械不良事件报告表》及填写要求可疑医疗器械不良事件报告表报告日期:年月日报告来源:□生产企业口经营企业口编码:使用单位单位名称:由编:联系:A.患者资料1.姓名:2.年龄:3•性别口男□女4.预期治疗疾病或作用:B.不良事件情形5・爭件耍紧表现:6.爭件发生日期:年月曰7.发觉或者知悉时刻:年n日8.医疗器械实际使用场所:□医疗机构口家庭口其他(请注明):9 •爭件后果□死亡______________________________ (时刻):□危及生命:□机体功能结构永久性损害:□可能导致机体功能结构永久性损吿:□需要内、外科治疗幸免上述永久损害:□其他(在爭件陈述中说明)。
10•爭件陈述:(至少包括器械使用时刻.使用目的、使用依据、使用情形、显现的不良爭件情形.对受害者阻碍、采取的治疗措施、器械联合使用情形)报告人:医师口技师口护士口其他口报告人签名:国家食品药品监督治理局制填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情形、医疗器械情形、关联性评判、不良事件评判及题末7部分组成。
1题眉A・报告日期:是扌旨填报人填报该次不良事件时的确切时刻。
B・编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□ □□□□ □□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C・报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在"口"中划5"。
D•单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E・、及:是指填报可疑医疗器械不良事件单位的、及。
2 •患者资料A•患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写XX子或XX女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。


可疑医疗器械不良事件报告表可疑医疗器械不良事件报告表 A(患者资料 1(姓名: 2(年龄: 3.性别, 男 ,女 4(预期治疗疾病或作用:B(不良事件情况 5(事件主要表现:(患者的表现和器械的表现)6(事件发生日期(患者或其他人首次返现异常的日期): 年月日7(发现或者知悉时间(我们获知的时间): 年月日 8. 医疗器械实际使用场所: , ?医疗机构 , 家庭 , 其它(请注明):9.事件后果, 死亡 (时间);, 危及生命;, 机体功能结构永久性损伤;, 可能导致机体功能机构永久性损伤(指治疗可能无效或效果较差); , 需要内、外科治疗避免上述永久损伤(指治疗可使功能恢复); , 其它(在事件陈述中说明)。
10.事件陈述:使用时间:使用目的:使用依据:使用情况(使用过程是否正常按说明书操作,说明书是否清楚明白详细,产品有无异常):出现的不良事件情况(尽量详细描述产品使用过程中发生的变化和对患者的损害或对诊断治疗的影响):对受害者影响(对治疗、生理身体功能、生活等有无影响):采取的治疗措施:器械联合使用情况C(医疗器械情况11(产品名称:12(商品名称:13(注册证号:14(生产企业名称:生产企业地址:企业联系电话:15 型号规格:产品编号:产品批号:16. 操作人:,?专业人员 ,非专业人员 ,患者 ,其它(请注明): 17. 有效期至: 年月日18(生产日期: 年月日19. 停用日期(若停用): 年月日 20. 植入日期(若植入): 年月日21. 事件发生初步原因分析(简单判断):22. 事件初步处理情况(任何措施,如更换产品、对患者损害处理、安抚、报告、留样封存):23(事件报告状态:, 已通知使用单位 , 已通知生产企业, 已通知经营企业 , 已通知药监部门D. 不良事件评价24(省级监测技术机构评价意见(可另附附页): 25(国家监测技术机构评价意见(可另附附页): 报告人: 医师, 技师, 护士, 其他,国家食品药品监督管理局制。

医疗器械不良事件报告表
一、报告单位信息。
1. 报告单位名称:
2. 单位地址:
3. 联系人:
4. 联系电话:
5. 邮政编码:
二、器械基本信息。
1. 器械名称:
2. 型号:
3. 规格:
4. 生产厂家:
5. 出厂日期:
6. 有效期至:
三、不良事件描述。
1. 事件发生时间:
2. 事件发现时间:
3. 不良事件描述:
4. 不良事件对患者造成的影响:
5. 不良事件对医疗过程的影响:
6. 不良事件对医疗器械的影响:
四、不良事件原因分析。
1. 不良事件的直接原因:
2. 不良事件的间接原因:
3. 不良事件的根本原因:
4. 防范措施及改进建议:
五、处理结果。
1. 患者处理情况:
2. 医疗器械处理情况:
3. 相关人员处理情况:
4. 预防措施及改进措施:
六、报告人信息。
1. 姓名:
2. 职务:
3. 联系电话:
4. 电子邮箱:
5. 签名:
七、报告时间。
1. 年月日。
以上是医疗器械不良事件报告表的内容,医疗器械不良事件的及时报告对于医疗安全至关重要,希望各报告单位能够认真填写以上信息,确保医疗器械使用过程中的安全和有效性。
同时,对于不良事件的原因分析和处理结果也需要进行深入的思考和总结,以期减少类似事件的再次发生,保障患者和医护人员的安全。
常见医疗器械不良事件临床表现汇总表
针对绝大局部医护人员不了解什么是医疗器械不良事件和如何判定医疗器械不良事件的现状, 通过度析历年来医疗器械可疑不良事件报告, 并查阅文献, 结合临床各个科室利用器械的情形进展分类, 整理出本?临床常见医疗器械不良事件表现汇总表?, 希望能够帮忙我院广漠医护人员对医疗器械不良事件监测工作的熟悉和了解常见的医疗器械不良事件表现, 提高我院医疗器械不良事件监测水平与报告率, 更好的保障医疗器械利用平安。
本表要紧求示范作用, 上报内容没必要局限于本表。
由于编写时刻有限而且数据处置量较大, 疏漏的地方在所不免, 希望大伙儿能够提出宝贵意见。
目录:
一、临床科室通用医疗器械
二、放射科经常使用医疗器械
三、B超、心电图室经常使用医疗器械
四、查验科、病理科经常使用医疗器械
五、内镜室经常使用医疗器
六、外科通用医疗器械
七、放疗科经常使用医疗器械
八、中医科经常使用医疗器械
一、临床科室通用医疗器械
二、放射科经常使用医疗设备
三、B超心电图室经常使用医疗器械
四、查验科、病理科经常使用医疗器械
五、内镜室经常使用医疗器
六、外科通用医疗器械
七、放疗科经常使用医疗器械
八、中医科。
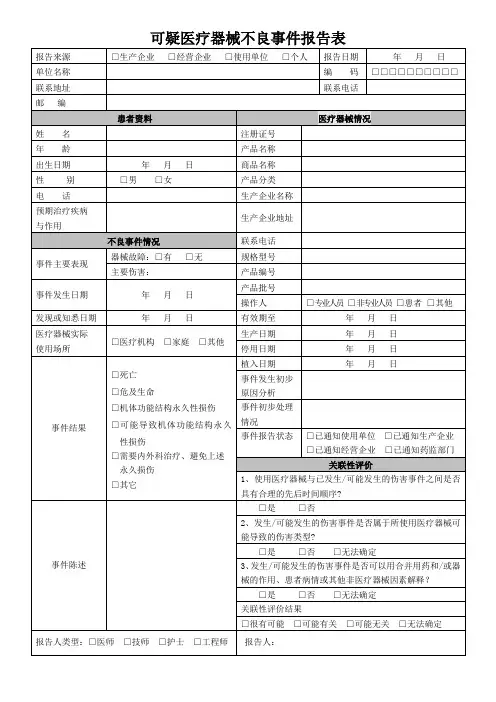
可疑医疗器械不良事件报告表
可疑医疗器械不良事件报告表
报告来源生产企业经营企业使用单位个人报告日期
单位名称编码
联系地址联系电话邮编A.患者资料 C.医疗器械情况
患者姓名医疗器械分类名称
年龄产品名称
性别男女商品名称
联系电话注册证号
预期治疗疾病生产企业名称
预期作用生产企业地址
B.不良事件情况企业联系电话
事件主要表现型号规格
事件发生日期产品编号
发现患者知悉时间产品批号
操作人
专业人员非专业人员
患者其它
医疗器械实际使用场所医院诊所家庭其它
有效期至
事件后果(如选择其它,请在事件陈述中说明)死亡
威胁生命
机体功能结构永久损伤
需要内、外科治疗避免上述永久损伤
其它(在事件陈述中说明)
生产日期
停用日期
植入日期(若植入)
事件发生初步
原因分析
事件陈述事件初步处理情况
事件报告状态
已通知使用单位已通知企业
已通知药监部门
D.不良事件评价
评价结论
评价时间
监测机构意见陈述
评价人
评价单位
报告人类别医师技师
护士患者其他
报告人签名。
可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称: 联系地址: 邮 编: 联系电话:报告人签名: 国家食品药品监督管理局制填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□□□□□□□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。
若患者年龄小于1岁,应填写具体的月份或天数,如6个月。
C.性别:是指患者的性别,填写时请选择相应的选项,并在“□”中划“√”。
D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。
3.不良事件情况A.事件主要表现:是指使用医疗器械后引发的、可能与该医疗器械使用有关的有害事件(且与质量、医疗事故无关)。
填写不良事件主要表现要明确、具体,如放臵节育器后,出现意外脱落者,可填写“节育器脱落”。
B.事件发生日期:是指不良事件发生的确切时间,如:×年×月×日,字体为阿拉伯数字。
生产企业经营企业使用单位单位名称(单位盖章):联系地址: 邮编:联系电话:3.性别男女15. 非专业人员患者7. 医疗器械实际使用场所:医院诊所家庭其它(在陈述中说明)8.事件后果(时间);威胁生命;21已通知医院已通知企业已通知药监分局报告人:可疑医疗器械不良事件报告表填写说明国家药品不良反应监测中心一、医疗器械不良事件定义:获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、报告范围:需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。
其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。
“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
三、报告原则:1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
注意事项:1、请务必填写清楚您的联系方式、产品名称和生产企业名称;2、若有内容填写不下,可加附表说明;3、进口产品在生产企业联系方式一栏请填写境内代理企业联系方式;相关事件在以下情况必须报告:⑴引起或造成死亡或严重伤害的几率较大;⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害;⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要;⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;⑹类似事件在过去实际已经引起或造成死亡或严重伤害。