植物反转录转座子及其分子标记
- 格式:doc
- 大小:97.50 KB
- 文档页数:8

分子标记技术的类型及其原理08农生1班陈耀光 200830010403所谓分子标记就是基于基因组DNA 存在极其丰富的多态性而发展的一类可以直接反映生物个体间DNA 水平上差异的新型的遗传标记方法。
在遗传学发展过程中,先后出现了形态学标记、细胞学标记、生化标记和分子标记,其中以分子标记最为理想、可靠,因为DNA分子中碱基的缺失、插入、易位、倒位或是长短与排列不一的重复序列等产生的差异,都可以通过分子标记进行检测。
DNA 分子标记较以往的形态标记其优越性表现在:(1)以核酸为研究对象,不受季节、环境限制,不存在基因表达与否的问题,也没有组织或器官特异性;(2)数量的丰富性,遍及整个基因组,标记的数量几乎是无限的;(3)多态性高,自然存在丰富的等位变异;(4)许多标记表现为共显性,能很好地鉴别纯合基因型与杂合基因型;(5)检测手段简便、快速,并且重复性好;(6)既不对目标形状的表达造成影响,也不会与不良性状之间产生必然的关联。
1 分子标记的类型及其原理分子标记技术自诞生以来,短短的几十年时间中得到突飞猛进的发展,至今被发展和利用的分子标记技术已有二十余种,为不同研究领域提供了有效的技术手段,同时也发挥着至关重要的作用。
目前,根据对DNA 多态性检测手段和所应用序列范围的不同,对部分分子标记技术分类如下。
1.1 基于全基因序列的分子标记RFLP (restriction fragment length polymorphism,限制性片段长度多态性):RFLP 作为最早发展的分子标记技术由Grozdicker 等于1974 年创建,并由Bostein 等再次提出。
RFLP 技术的出现开创了直接在DNA 水平上进行遗传研究的新时代。
其基本原理是:基因组DNA中限制性内切酶所识别的序列由于出现碱基变化而致使酶切位点的数量也变化,从而使酶切片段长短发生差异产生长度多态性。
利用特定的限制性内切酶切割不同个体的基因组DNA,由于不同个体中酶切位点的差别就得到了长短相异的片段DNA,电泳分离后,借助Southern 杂交将DNA 片段转移至硝酸纤维素膜上,将具有放射性标记的探针与膜上的片段杂交,通过放射自显影技术就可以获得显示物种特异性的多态性图谱。
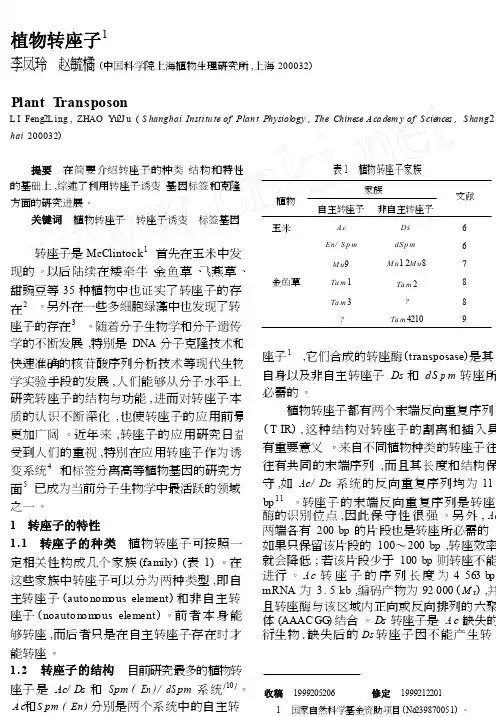
植物转座子1李凤玲 赵毓橘 (中国科学院上海植物生理研究所 ,上海 200032)Plant T ransposonL I Feng 2Ling , ZHAO Yu 2J u ( S hanghai I n st i t u te of Pl a n t Physiology , T h e Chi n ese A c a dem y of S c iences , S hang 2 hai 200032)提要 在简要介绍转座子的种类 、结构和特性 的基础上 ,综述了利用转座子诱变 、基因标签和克隆 方面的研究进展 。
关键词 植物转座子 转座子诱变 标签基因表 1 植物转座子家族家族文献植物 自主转座子非自主转座子玉米66 A c Ds En/ S p m dS p m 转座子是 McClintock 1 首先在玉米中发现的 。
以后陆续在矮牵牛 、金鱼草 、飞燕草 、 甜豌豆等 35 种植物中也证实了转座子的存 M u 9M u 1 2M u 8T a m 2 7 金鱼草 T a m 1 8 T a m 3T a m 42108 在2 。
另外在一些多细胞绿藻中也发现了转9座子的存在3 。
随着分子生物学和分子遗传 学的不断发展 ,特别是 DNA 分子克隆技术和 快速准确的核苷酸序列分析技术等现代生物 学实验手段的发展 ,人们能够从分子水平上 研究转座子的结构与功能 ,进而对转座子本 质的认识不断深化 ,也使转座子的应用前景 更加广阔 。
近年来 ,转座子的应用研究日益 受到人们的重视 ,特别在应用转座子作为诱 变系统4 和标签分离高等植物基因的研究方 1座子 ,它们合成的转座酶 ( t r anspo s ase ) 是其自身以及非自主转座子 Ds 和 dS p m 转座所 必需的 。
植物转座子都有两个末端反向重复序列( T IR ) , 这种结构对转座子的割离和插入具有重要意义 。
来自不同植物种类的转座子往 往有共同的末端序列 ,而且其长度和结构保 守 ,如 A c / Ds 系统的反向重复 序 列 均 为 11面5已成为当前分子生物学中最活跃的领域 11 bp 。



中国水产科学 2016年3月, 23(2): 284-296 Journal of Fishery Sciences of China研究论文收稿日期: 2015-04-10; 修订日期: 2015-07-21.基金项目: 国家自然科学基金项目(31200918); 江苏省自然科学基金项目(BK2011184); 中央级公益性科研院所基本科研业务费专项资金(2015JBFM06).作者简介: 丁炜东(1977–), 男, 副研究员, 研究方向为鱼类遗传育种. E-mail: dingwd@ 通信作者: 曹丽萍, 助理研究员, Tel: 0510-********, E-mail: caolp@;邴旭文, 研究员, Tel: 0510-********, E-mail: bingxw@DOI: 10.3724/SP.J.1118.2016.15147建鲤基因组中一个ty3-gypsy 反转录转座子的发现与分析丁炜东, 曹丽萍, 曹哲明, 邴旭文农业部淡水渔业和种质资源利用重点实验室, 中国水产科学研究院 淡水渔业研究中心, 江苏 无锡 214081 摘要: 转座子是动植物基因组的重要组成部分, 在前期研究中发现建鲤(Cyprinus carpio var. jian )基因组中存在一个ty3-gypsy 反转录转座子类型的转座子, 并将其命名为JRE 转座子(Jian carp Retrotransposon, JRE )。
为了研究JRE 反转录转座子在建鲤基因组中的功能, 采用PCR 扩增、荧光定量PCR 和原位杂交等方法对JRE 转座子的特性进行了研究。
JRE 反转录转座子全长5126 bp, 具有5'端470 bp 和3'端453 bp 长末端重复片段(long terminal repeat end, LTR), 中间的开放阅读框(ORF)包括核心蛋白基因(gag )和酶基因区域(pol ), 其长度为4203 bp 。


植物LTR类反转录转座子的研究概述徐玲;陈自宏;汪建云;艾薇【摘要】LTR retrotransposons compose a significant part in plant genome and have vital impact on the size, structure, function and evolution of genomes. The research progress of LTR retrotransposon was summarized from aspects of structure character, transposing mechanism, classification, isolation and identification, and their impact on genomes, which will lay a foundation for further study on the functions of LTR retrotransposons in plant genomes.%LTR类反转录转座子是植物基因组中的重要成分,对基因组的大小、结构、功能和进化都有重要影响.文中从结构特征、转座机制、分类、分离鉴定及对基因组的影响等多个方面概述了植物LTR类反转录转座子的研究进展,为进一步揭示LTR类反转录转座子在植物基因组中的功能奠定基础.【期刊名称】《安徽农业科学》【年(卷),期】2012(000)031【总页数】3页(P15129-15130,15149)【关键词】LTR类反转录转座子;植物基因组;结构;转座;活性【作者】徐玲;陈自宏;汪建云;艾薇【作者单位】保山学院,云南保山678000;保山学院,云南保山678000;保山学院,云南保山678000;保山学院,云南保山678000【正文语种】中文【中图分类】S432.1转座子包括反转录转座子和转座子两大类[1]。


转座蛋白调控植物基因表达和生长发育的分子机制研究转座蛋白是一种能够调控基因表达及植物生长发育的蛋白质。
作为一类产生于基因组内的“跳跃因子”,转座蛋白不断地变异、演化并在植物细胞中进行转位。
它们通过向新基因位点插入得到表达来实现自我延续,也是植物基因组演化的主要原因之一。
本文将主要介绍转座蛋白的分类、转位机制及其在调控植物基因表达和生长发育中的作用。
一、转座蛋白的分类及特点1. 类1转座蛋白类1转座蛋白属于DNA转座子家族,可以将其DNA插入到基因组的不同位点造成基因变异。
这类蛋白质分为双链病毒类和反转录类两种类型,最为典型的反转录转座子是Ty元件家族。
2. 类2转座蛋白类2转座蛋白则不同于类1转座蛋白,它不会嵌入宿主基因组而是依赖于RNA作为媒介完成转座过程。
这类转座蛋白属于非编码RNA类,通常只有短的ORF能转译成蛋白质,被最近认为是一种微型RNA。
在经过进化之后,类2转座蛋白分别演化成了长延伸形的L1转座子,short interspersed elements(SINEs)和long interspersed elements(LINEs)等。
二、转座蛋白的转位机制转座蛋白的转位机制可以分为两类:切割粘贴和复制粘贴。
前者主要是利用转座因子自身产生的内切酶切割宿主DNA,产生裂合酶嵌合环路,最后将自身插入到宿主DNA中。
而后者通过由转座因子产生的转座RNA与宿主基因组产生相同的DNA序列反向互补,产生自身DNA-酶复合物,通过这种对称复制进行转位。
三、转座蛋白在调控基因表达和生长发育中的作用转座蛋白的编码基因广泛地分布在植物基因组中,可以插入新的位点,打断基因的正常功能或替换调拷贝,扩增易位基因等,从而引发复杂的基因结构变异和多样性。
同时,转座蛋白的表达量的提高或降低,也会影响到植物生长发育过程中基因的表达。
例如在开花时间、化感应或是胁迫环境下,转座蛋白的作用有可能会发挥在基因表达的调控上。

植物基因组中的转座子研究及其应用转座子是一个有趣而又神秘的基因组元素。
虽然它们被视为“DNA垃圾”,但它们却在進化中扮演了很重要的角色。
转座子是自适应进化的“引擎”,可以改变基因组结构、创造多种基因功能以及促进基因组重塑。
同时,他们对基因的功能输出和基因的调控也有一定的影响。
在植物学中,植物基因组中的转座子一直是一个热门的研究课题。
在这篇文章中,我们将探讨植物基因组中的转座子研究及其应用。
一、什么是转座子?转座子是指一类可以在基因组中“跳跃” 的DNA序列。
与传统的基因不同,转座子不具有明确功能,不能编码或调控蛋白质的合成,也不能直接影响细胞的代谢过程。
然而,它们能够通过裂解、复制和负责他的转移,实现在基因组内的位置乱跳,并插入到新的基因组位点上。
这种行为对于染色体的稳定性和连续性产生很大的影响,也能够在基因组重塑时起到很重要的作用。
转座子由于其具有特殊的靶向和剪切机制,所以是几亿年来基因组重构的主要参与者之一。
与此同时,它们也是基因组进化的核心因素之一,促进了基因的适应性变化、灵活性增强和多样性生成。
因此,转座子一直都是基因组学和机理生物学领域的一个重要研究对象。
二、植物基因组中的转座子在植物的基因组中,转座子构成了大约50%的重复序列。
这些转座子的类型也非常繁多,可以分为四大类,分别是选择性反转录转座子(SINEs)、长转座子(LINEs)、短转座子(SINEs)和简单的转座子(Simple Transposons,STs)。
其中,SINEs和LINEs是两种较为常见的转座子,分别占据了基因组中35%和20%的比例。
SINEs由一个短的一级结构单元(core region)和一个可变长度的非一级结构单元(variable region)组成。
它们的由逆转录酶(reverse transcriptase)驱动插入到基因组内。
与SINEs不同,LINEs是一种长序列,长度一般从1kb到6kb不等。

植物LTR反转录转座子的研究进展蒋爽;滕元文;宗宇;蔡丹英【摘要】反转录转座子是真核生物基因组中普遍存在的一类可移动的遗传因子,它们以RNA为媒介,在基因组中不断自我复制.在高等植物中,反转录转座子是基因组的重要成分之一.反转录转座子可以分为5大类型,其中以长末端重复(LTR)类型报道较多.LTR类型由于其首尾具有长末端重复序列,内部含有PBS、PPT、GAG和POL 开放阅读框、TSD等结构,可以采用生物信息学软件进行预测.LTR反转录转座子的活性受到自身甲基化和环境因素的影响,DNA甲基化抑制反转录转座子转座,而外界环境的刺激能够激活转座子,从而影响插入位点周边基因的表达.同时由于LTR反转录转座子在植物中普遍存在,丰富的拷贝数以及多态性为新型分子标记(RBIP、SSAP、IRAP、REMAP)的开发提供了良好的素材.该文对近年来国内外有关植物反转录转座子的类型、结构特征、LTR反转录转座子的活性及其影响因素、LTR反转录转座子的预测以及标记开发等方面的研究进展进行综述.【期刊名称】《西北植物学报》【年(卷),期】2013(033)011【总页数】7页(P2354-2360)【关键词】反转录转座子;长末端重复(LTR);预测;功能;分子标记【作者】蒋爽;滕元文;宗宇;蔡丹英【作者单位】浙江大学园艺系,农业部园艺植物生长发育与品质调控重点开放实验室,杭州310058;浙江大学园艺系,农业部园艺植物生长发育与品质调控重点开放实验室,杭州310058;浙江大学园艺系,农业部园艺植物生长发育与品质调控重点开放实验室,杭州310058;浙江大学园艺系,农业部园艺植物生长发育与品质调控重点开放实验室,杭州310058【正文语种】中文【中图分类】Q78植物基因组中含有大量可移动的遗传因子,统称为转座子[1],其中第一大类型是反转录转座子(retrotransposons),是一类广泛存在于植物基因组中的特殊DNA序列[2-4],植物中最初是在研究玉米突变体时发现的[5]。
分子标记技术的类型及其原理08农生1班陈耀光 200830010403所谓分子标记就是基于基因组DNA 存在极其丰富的多态性而发展的一类可以直接反映生物个体间DNA 水平上差异的新型的遗传标记方法。
在遗传学发展过程中,先后出现了形态学标记、细胞学标记、生化标记和分子标记,其中以分子标记最为理想、可靠,因为DNA分子中碱基的缺失、插入、易位、倒位或是长短与排列不一的重复序列等产生的差异,都可以通过分子标记进行检测。
DNA 分子标记较以往的形态标记其优越性表现在:(1)以核酸为研究对象,不受季节、环境限制,不存在基因表达与否的问题,也没有组织或器官特异性;(2)数量的丰富性,遍及整个基因组,标记的数量几乎是无限的;(3)多态性高,自然存在丰富的等位变异;(4)许多标记表现为共显性,能很好地鉴别纯合基因型与杂合基因型;(5)检测手段简便、快速,并且重复性好;(6)既不对目标形状的表达造成影响,也不会与不良性状之间产生必然的关联。
1 分子标记的类型及其原理分子标记技术自诞生以来,短短的几十年时间中得到突飞猛进的发展,至今被发展和利用的分子标记技术已有二十余种,为不同研究领域提供了有效的技术手段,同时也发挥着至关重要的作用。
目前,根据对DNA 多态性检测手段和所应用序列范围的不同,对部分分子标记技术分类如下。
1.1 基于全基因序列的分子标记RFLP (restriction fragment length polymorphism,限制性片段长度多态性):RFLP 作为最早发展的分子标记技术由Grozdicker 等于1974 年创建,并由Bostein 等再次提出。
RFLP 技术的出现开创了直接在DNA 水平上进行遗传研究的新时代。
其基本原理是:基因组DNA中限制性内切酶所识别的序列由于出现碱基变化而致使酶切位点的数量也变化,从而使酶切片段长短发生差异产生长度多态性。
利用特定的限制性内切酶切割不同个体的基因组DNA,由于不同个体中酶切位点的差别就得到了长短相异的片段DNA,电泳分离后,借助Southern 杂交将DNA 片段转移至硝酸纤维素膜上,将具有放射性标记的探针与膜上的片段杂交,通过放射自显影技术就可以获得显示物种特异性的多态性图谱。
马铃薯全基因组LTR反转录转座子分析Abstract:LTR retrotransposons in potato(Solanum tuberosum)genome were analyzed by LTR-FINDER software. Results showed that there were 4 725 full-length LTR retrotransposons with average length of 7 393 bp,accounting for about 4.95% of potato genome bases. The length of LTR in LTR retrotransposons was 786 bp. Phylogenetic tree showed that LTR retrotransposons of potato had high genetic diversity and high heterogeneity.Key words:LTR retrotransposons;potato(Solanum tuberosum);genome;phylogenetic tree马铃薯(Solanum tuberosum)为茄科茄属一年生草本植物,是世界第四大粮食作物,它营养全面、适应性广、用途多、产业链长,是全球重要的粮食作物,也是农业生产中加工产品最丰富的原料作物[1]。
遗传多样性是生物多样性研究的核心问题之一,在一定程度上决定了物种的分布以及数量多样性[2]。
对马铃薯的遗传多样性进行研究有助于认识马铃薯的进化过程或适应机理,以及马铃薯种群的地理分布格局、数量增长、优良品种选育、资源鉴别和利用以及病害检测和防治等方面的问题。
目前分子标记技术作为研究植物遗传多样性、作物品种纯度鉴定、种质资源分类、遗传图谱构建等方面的重要方法已经得到广泛应用[3-5]。
植物反转录转座子及其分子标记王子成1,2李忠爱2邓秀新1(1华中农业大学作物遗传改良国家重点实验室,湖北武汉,4300702 河南大学生命科学学院,河南开封,475001)摘要:反转录转座子(retrotransposon)是真核生物中一类可移动因子,可分为LTR反转录转座子和非LTR反转录转座子。
反转录转座子以高拷贝在植物界广泛分布,可以通过纵向和横向分别在世代之间和不同种之间进行传递,同一家族的反转录转座子具有高度的异质性. 在一些生物的和非生物的逆境条件下,反转录转座子的转录可以被激活。
由于反转录转座子的特点,使其作为一种分子标记得以应用。
S-SAP,IRAP,REMAP和RBIP等分子标记相继发展起来,在基因作图、生物遗传多样性与系统进化、品种鉴定等方面具有广泛的应用前景。
关键词反转录转座子,分子标记Plant retrotransposons and their molecular markersWang Zicheng1,2Li Zhongai2Deng Xuixin11 National Key Laboratory of Crop Genetic Improvement, Huazhong Agriculture university HubeiWuhan, 4300702 College of life science ,Henan University, Henan Kaifeng, 475001Abstract: Retrotransposons are a class of eukaryotic transposable elements, consisting of the long terminal repeat (LTR) and non-LTRretrotransposons. Retrotransposons are ubiquitous in the plant kingdom by high copy number and can be transmitted between generations by vertical transmission and between species by horizontal transmission. The same family retrotransposons presented highly heterogeneous populations in all higher plant genomes. Many of the plant retrotransposons are transcriptionally activated by various biotic and abiotic stress factors. Retrotransposons are used as molecular markers for their traits. S-SAP, IRAP, REMAP and RBIP are developed and will be applied widely in gene mapping, genetic biodiversity and phylogeny studies, and cultivar certification.Key words: retrotransposons molecular markers反转录转座子是广泛分布于真核生物中的一类可移动因子,因其转座需经过由RNA介导的反转录过程而得名。
自从1984年第一例植物反转录转座子报道(Shepherd,1984) 以来,大多数的植物中都已发现有反转录转座子的分布(Price et al,2002; Linares et al, 2001; Hernandez et al,2001; V erries et al,2000; Asins et al,1999)。
反转录转座子在植物基因组中占有相当大的比例,但国内关于这方面的研究相对较少,本文就近年来植物反转录转座子的研究进展进行综述,并对基于反转录转座子的分子标记及其应用进行初步的介绍,以引起大家对这一领域的关注。
1 植物中的反转录转座子类型与结构在真核生物中,根据是否包含有LTR而将反转录转座子分为两大类,即LTR反转录转座子和非LTR反转录转座子。
LTR是研究较多的反转录转座子,根据它们序列的相似程度王子成,男,1974年12月生,华中农业大学00级博士生,主要从事植物生物技术方面的研究。
E-mail:wangzichengainuo@.导师简介:邓秀新,男,1961年11月生,华中农业大学长江学者特聘教授,主要从事植物生物技术研究。
E-mail:DXXWWLJ@国家自然科学基金资助项目:编号(30170472)以及编码基因的排列顺序,又进一步分为Ty1-copia 和Ty3-gypsy 两大类;而非LTR 反转录转座子的两侧没有LTR 存在,而以Poly(A)或A-rich 序列结尾(Gabriel and boeke ,1993),根据其结构,又可分为LINEs (longinterspersed repetitive elements 长散布元件)和SINEs(short interspersed repetitive elements 短散布元件)两类。
LTR 反转录转座子两侧翼具有长末端重复序列(long terminal repeats, LTRs ),其长度从100 bp 到5 kb 不等。
LTRs 不编码蛋白质,但包含有对转座起重要作用的起动子和终止子。
LTRs 以短的反向重复为末端,通常为5`-TG-3`和5`-CA-3`。
反转录转座子编码很多的蛋白质,其中主要的有三个基因, 即gag (种属特异抗原)、pol (聚合酶)和int (整合酶)。
gag 基因编码的蛋白质参与反转录转座子RNA 的成熟与包装,使反转录转座子的RNA 适合于整合入基因组。
Pol 基因编码反转录酶和RNase H ,这是反转录转座子的复制和转座所必需的。
Int 所编码的整合酶DNA 状态的反转录转座子整合入染色体上新的位点。
Ty1-copia 和Ty3-gypsy 两类反转录转座子的明显不同之处在于Int 和Pol 基因的排列顺序(Kumar and Bennetzen,1998)。
LTR 反转录转座子Ty1-copia 家族Ty3-gypsy 家族非LTR 反转录转座子LINESINE图1 四种类型的反转录转座子结构Figure 1 The structures of 4 types of retrotransposons注:CP(capsid-like proteins), EN(edonuclease), INT(integrase), PR(protease), RT(reverse transcriptase), PBS(primer binding sites), PPT(polypurine tracts), NA(nucleic acid binding moiety),IR(inverted terminal repeats),DR(flanking target direct repeat),5`UTR(5`untranslated region),3`UTR(3`untranslated region),Pol3A and Pol3B (RNA polymerase Ⅲ recognition sites)(参考Kumar and Bennetzen,1999)5 3` DRNACP RT PPT PR U3 PBS RNASE H INT GagPol IRU5 R LTRGag Pol DR IR NA CP RNASE H RTPR INT LTRLTR 3` NA RNASE H RT ENNA 5`GagPol 3`非LTR反转录转座子是比LTR反转录转座子简单的转座因子。
其中的LINES也包含有和LTR反转录转座子相同的蛋白质。
LINES有gag和pol基因,但是缺乏确定的整合酶基因。
通过序列分析发现,LINEs可能是真核生物中最古老的一类反转录转座子,第一个LTR 反转录转座子可能是由LINE获取LTR而产生(Xiang and Eickbush,1990)。
SINEs是一类很小的反转录转移因子,和其它类型的反转录转座子明显不同, 它们不编码任何反式作用的具有转座功能的基因(Yasui et a l,2001)。
所有已知的SINEs都来源于tRNAs(Lenoir et al,2001),具有高效复制能力,并且可以被LINES和LTR反转录转座子所编码的蛋白质整合入基因组。
关于该类反转录转座子的复制和整合,目前研究的还不是很清楚。
2 植物中的反转录转座子的特点2.1分布特点反转录转座子广泛分布于植物基因组中。
在整个植物界,从单细胞的藻类植物到裸子植物和被子植物,都有Ty1-copia类反转录转座子的存在。
Ty3-gypsy类反转录转座子同样广泛存在于包括裸子植物和被子植物在内的植物界中。
并且,这两类反转录转座子在大基因组植物中都是以高拷贝存在(Meyers et al, 2001)。
LINEs同样以高拷贝存在于已研究的植物中, 并且和LTR反转录转座子一样广泛分布于植物界(Nishimura et al, 2000;Noma et al, 1999)。
SINES目前在几种被子植物中发现,在其他植物中的分布还需要进一步的研究(Lenoir et al,2001)。
迄今,在植物核基因组和线粒体基因组中都发现有反转录转座子的分布(Imsande et al,2001; Unseld et al,1997; Knoop et al,1996),而在叶绿体基因组中还未发现有反转录转座子存在。
通过原位杂交发现,反转录转座子在染色体上的分布因其种类和宿主不同而不同。
有的分布比较均匀,而有的很不均匀。
有的只在某些特定的区域较多,而在另外的区域则缺乏(Presting et al,1998)。
在植物染色体的核仁组织区,还没有发现反转录转座子的存在。
在雌雄异株大麻中发现,LINE-like 反转录转座子只在Y染色体长臂末端有100~200个copy 存在(Sakamoto et al,2000)。
在很多反转录转座子在常染色区分布较多,而这些区域是基因较为集中的地带,最近在小麦上的研究表明,反转录转座子的插入多集中在基因的临近区域或富基因区域的侧翼(Sandhu and Gill,2002)。