第11章S区元素自测题
- 格式:doc
- 大小:53.50 KB
- 文档页数:4

元素直觉测试题及答案解析一、选择题1. 元素周期表中,元素按照什么顺序排列?A. 原子量B. 原子序数C. 电子数D. 中子数答案:B2. 以下哪个元素的化学符号是“Fe”?A. 铁B. 铜C. 银D. 金答案:A3. 氢元素的原子序数是多少?A. 1B. 2C. 3D. 4答案:A二、填空题4. 元素周期表的前20号元素中,原子序数为11的元素是______。
答案:钠(Na)5. 元素周期表中,属于第18族的元素是______。
答案:稀有气体(He, Ne, Ar等)三、简答题6. 请简述元素周期表的构造原理。
答案:元素周期表是根据元素的原子序数排列的,将具有相似化学性质的元素归为同一族。
周期表分为s、p、d、f区,分别对应元素的电子排布。
7. 什么是元素的原子量?答案:原子量是元素的相对原子质量,它表示一个元素的原子质量与1/12个碳-12原子质量的比值。
四、计算题8. 假设某元素的原子序数为29,计算其原子核中的质子数。
答案:原子核中的质子数等于元素的原子序数,因此质子数为29。
9. 如果一个元素的原子量为40.08,原子序数为20,求其原子核中的中子数。
答案:原子核中的中子数 = 原子量 - 原子序数 = 40.08 - 20 = 20.08。
五、分析题10. 根据元素周期表,分析为什么氢元素的化学性质与其他元素不同。
答案:氢元素的原子序数为1,其电子排布为1s¹,与其他元素相比,氢元素的电子层数最少,因此其化学性质与其他元素有显著差异,例如,氢可以形成共价键,也可以作为还原剂等。
六、实验题11. 如果要通过实验确定一个未知元素的原子序数,可以采用哪些方法?答案:可以通过光谱分析法、质谱法或X射线荧光光谱法等实验方法来确定未知元素的原子序数。
这些方法可以测量元素的特征光谱线或质量,从而确定其原子序数。
七、论述题12. 论述元素周期表在化学研究中的重要性。
答案:元素周期表是化学研究的基础工具之一,它不仅帮助化学家们系统地了解元素的性质和行为,还为元素的发现、分类和研究提供了框架。

《元素化学》第1章 《S 区元素》自测题班级:应用化学1201B 姓名: 学号: 得分:一、选择题(75分)1 在下列性质中,碱金属比碱土金属高(或大)的是 ( D )A. 熔点B. 沸点C. 硬度D. 半径 2 下列性质中,碱金属和碱土金属都不具有的是 ( D )A. 与水剧烈反应B. 与酸反应C. 与碱反应D. 与强还原剂反应3ⅠA,ⅡA 族元素的电离势,电负性和M 2分子中共价键的强度随着原子序数的增加而 (B )A. 逐渐增大B. 逐渐减小C. 无法推测D. 变化不大 4 下列原子中哪一种原子第一电离势最大 (C )A. NaB. LiC. BeD. Mg5 碱土金属与碱金属相比较,碱土金属比相邻的碱金属多一个电子,即增加了一个单位的核电荷,所以 (B )A. 碱土金属原子半径比相邻的碱金属大些B. 电离势大C. 较易失去第一个电子D. 比碱金属更活泼 6 下列元素中形成化合物时,共价倾向最小的是 (D)A. BeB. LiC. BaD. Cs7 最轻的金属是以下金属中的 (B )A. BeB. LiC. NaD. Mg8 下列金属单质不能保存在煤油里的是 (A )A. LiB. NaC. KD. Rb9 金属钠应保存在 (C )A. 酒精中B. 液氨中C. 煤油中D. 空气中10 下列金属单质表现两性的是 (D )A. LiB. MgC. BaD. Be11 因为E Ø(Na +/Na)<E Ø(Li +/Li),所以钠的化学性质比锂更活泼,此说法 (C ) A. 因对果对 B. 因对果错 C. 因错果对 D. 因错果错12 下列反应式所表示的反应与实验事实不符的是 ( C )A. 6Li+N 2=2Li 3NB. 2Mg+SiO 2====高温 2MgO+SiC. Be+O 2===燃烧 BeO 2D. 4Na+TiCl 4===高温 Ti+4NaCl13 可用于吸收酒精中水分的氧化物是 ( D)A. Na 2OB. K 2OC. BeOD. CaO14 因为Na 2O 2有强碱性,所以熔融Na =2O 2时不宜采用的器皿是 ( C)A.铁器皿B. 镍制器皿C. 瓷制或石英器皿D. 以上都不行15 下列碱土金属氧化物中,硬度最大的是(D )A. CaOB. BaOC. MgOD. BeO16 下列过氧化物中至今尚未发现的是(B)A. Na2O2B. BeO2C. Rb2O2D. CaO217 下列氧化物不属于超氧化物的是(B)A. NaO2B. BaO2C. RbO2D. KO218 实验室中用H2SO4与如下物质作用制备H2O2,这种物质是(B )A. Na2OB. BaO2C. NaO2D. KO219 加热分解下列物质,可得相应氧化物的是(A,D )A. LiNO3B. NaNO3C. KNO3D. CaCO320 下列关于O2-结构和性质的叙述,错误的是(A,D )A. O2-中有一个σ键和一个π 键B. O2-中有一个未成对的电子,具有顺磁性C. O2-的键级比O2小,稳定性比O2强D. 超氧化物能吸收CO2放出O2E. 超氧化物都是强氧化剂21 下列物质中与Cl2作用能生成漂白粉的是(D )A. CaCO3B. CaSO4C. Mg(OH)2D. Ca(OH)222 下列四种氢氧化物中溶解度最小的是(C )A. LiOHB. Mg(OH)2C. Be(OH)2D. Ba(OH)223 在NaOH溶液中通入CO2制备Na2CO3,以下各种情况中,效果最好的是(A )A. 热的浓NaOH溶液B.热的稀NaOH溶液C.冷的浓NaOH溶液D.冷的稀NaOH溶液24 下列金属离子中,难溶盐数目最多的是(A )A. LiB. KC. NaD. Cs25 NaNO3和LiNO3都在1000K左右分解,其分解产物( D )A. 都是亚硝酸盐和O2B. 都是氧化物和O2C. 都产生N2O4和O2D. 除都产生氧气外,其余产物均不同26 下列物质的硫酸盐在水中溶解度最小的是( D )A. MgSO4B. CaSO4C. SrSO4D. BaSO427 下列金属的碳酸盐不易溶于水的是(A )A. Li2CO3B. Na2CO3 D. K2CO3 D. NaHCO328 下列物质热分解温度最高的是( D )A. MgCO3B. CaCO3C. SrCO3D. BaCO329 下列物质中,热稳定性最高的是( C )A. NH4HCO3B. Ag2CO3C. Na2CO3D. CaCO330 下列物质中,哪一种物质最难溶解(B )A. CaSO4B. CaC2O4C. Ca(OH)2D.CaCl231 0.5mol·l-1的NaCl溶液,冷却到0℃以下,开始有固体出现,此时溶液中的NaCl浓度将(C )A. =0.5mol·l-1B. <0.5mol·l-1C. >0.5mol·l-1D. =032 钙及其挥发性化合物的火焰颜色为(A )A. 橙红色B. 黄色C. 紫色D. 绿色33 在火焰试验中,下列金属哪一种不呈红色(D )A. 锂B. 锶C. 铷D. 钡34 下列ⅠA,ⅡA的卤化物中难溶于水的卤化物是( C,E )A. KFB. MI2C. MgF2D. MBrE. LiF35 锂和镁的哪种盐溶于水(D)A. 氟化物B. 碳酸盐C. 磷酸盐D. 氯化物36 锂和镁的性质相似是由于(A )A. 离子极化力相似B. 阳离子电荷相同,半径增大,φ值减小,极化力减小C. 相同电荷的阳离子半径增大,晶格能减小D. 阳离子半径减小,电荷高,φ值大37 下列哪组离子均可以水解的是( D )A. Be2+,K+B. Be2+,Ca2+C. Li+,Ca2+D. Li+,Mg2+38 碱金属,碱土金属氢氧化物中显示两性的是(B )A. Mg(OH)2B. Be(OH)2C. Sr(OH)2D. LiOH39 以下四种氢氧化物中碱性最强的是(B )A. Ba(OH)2B. CsOHC. NaOHD. KOH40ⅠA,ⅡA族金属的硫酸盐,硝酸盐的热稳定性随着原子半径的增大而(A )A. 逐渐增大B. 逐渐减小C. 无法推断D. 变化不大41 下列碳酸盐中,热稳定性最小的是(B )A. Na2CO3B. MgCO3C. K2CO3D. CaCO342 制造红色信号弹或焰火,需选用的盐类是(B )A. KClO3和KNO3B. Sr(ClO3)2C. SrCl2与SrSO4D. Ba(NO3)2和Ba(ClO3)243 以下物质中常用来制作红色焰火的氧化剂是(B )A. KNO3B. KClO3C. Ba(ClO3)2D. Mg(NO3)244 "因为周期表中处于对角线位臵的元素都符合对角线规则,所以锂和镁的所有性质都相同"此说法(D )A. 因对果对B. 因对果错C. 因错果对D. 因错果45 以下关于ⅠA,ⅡA族元素通性的叙述错误的是( B,D )A. 与同周期其它元素相比,碱金属原子体积大,原子间引力小,所以它们的熔沸点低,硬度小B. ⅡA族元素r比ⅠA族小,所以ⅠA族元素的第1,2电离势比ⅡA族相应元素的大C. ⅠA,ⅡA族元素的原子外电子结构分别为nS1,nS2,所以ⅠA族元素只有+Ⅰ氧化态,ⅡA族元素只有+Ⅱ氧化态D. 碱金属元素在化合时,均形成离子键E. ⅠA,ⅡA族元素M2分子中共价键的强度依原子半径的增大而渐小46 下列各组金属中,与氧气反应仅生成普通氧化物的是(B,C )A. Na,MgB. Be,LiC. Li,MgD. Cs,Ba D. Rb,Be47 在炼钢时常用于除去生铁中Si、P等杂质的氧化物是( A )A. CaOB. MgOC.K2OD. BeO46 有关锂和镁性质上的相似性,下列说法不正确的是( C,D )A. 锂和镁在过量氧气中燃烧形成普通氧化物B. 它们的氢氧化物加热分解,可生成相应的普通氧化物C. 锂和镁的氧化物离子性较强D. Li+和Mg2+水合能力差E. 它们氧化物易溶于乙醇49 下列关于锂和镁性质上的相似性说法错误的是(D )A. 锂和镁的氢氧化物受热时,可分解为相应的氧化物B. 锂和镁的氟化物,碳酸盐和鳞酸盐都难溶于水C. 锂和镁的氯化物能溶于有机溶剂D. 锂和镁的固体密度都小于1g/cm3,熔点都很低50 在活泼金属Na、K、Rb、Cs中,Cs是最活泼的,因为( D )A.它的半径最大B.它对价电子的吸引力最C.它的价电子数量最D.它的价电子离核最远二、填空题(25分)1 碱金属中Li +离子的极化力最强, Cs +变形性最大. (1分,每空0.5分)2 碱金属和碱土金属单质一般用_电解熔融盐_方法制取,这是由于单质性质特别活泼之故3 镁条在空气中燃烧主要产物是MgO 其次还有Mg 3N 2和C4 用金属钠还原Na 2O 2可以制得Na 2O,Na 2O 2+2Na=2Na 2O 用金属钾还原KNO 3可以制得K 2O,其反应为2KNO 3+10K=6K 2O+N 2 5在配制氢氧化钠溶液时,发现粒状的氢氧化钠相互粘结,表面被白色粉末覆盖.导致这种变化的两种物质是H 2O 和CO 2 (1分,每空0.5分)6 写出下列物质的分子式(或化学式)(2分,每空0.5分)1). CaSO 4·1/2H 2O 2). 大苏打Na 2S 2O 3·5H 2O 3). 芒硝Na 2SO 4·10H 2O 4). 元明粉Na 2SO 47 BeCl 2的熔点比MgCl 2的低, ,因为_ Be 2+的半径小,极化力强和Cl -结合的键共价性强,BeCl 2具有共价化合物性质. BaO 的熔点比LiF 的高,因为BaO 和LiF 都是离子晶体,主要是离子电荷,BaO 高于LiF, 故BaO 晶格能高,熔点高.8 泡沫灭火器里装的物质主要是NaHCO 3、Al 2(SO 4)3、H 2O_使用时发生的化学反应方程式是3NaHCO 3+Al 2(SO 4)3+3H 2O=3NaHSO 4+ 2Al(OH)3↓+3CO 2↑9 金属钠和镁在空气中燃烧的生成物均溶于水后,产物溶液中除都有氢氧化物外,钠产物溶液中还有H 2O 2 ;镁产物溶液中还有 NH 3。

第11章习题解答第11章(03525)重水是由H和18O组成的水。
.()解:错第11章(03526)氢在自然界中主要以单质形式存在。
()解:错第11章(03527)由于H2是双原子分子,所以H2比He的扩散速率小。
.()解:错第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
.()解:错第11章(03529)因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
.()解:对第11章(03530)常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。
()解:对第11章(03531)实验室所用氢气钢瓶应放在室外,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:C第11章(03532)水煤气的主要成分是.()。
(A)CO和N2;(B)CO和O2;(C)CO和H2;(D)CO2和H2O。
解:C第11章(03533)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)活泼金属与酸反应。
解:D第11章(03534)下列反应方程式中,不适用于工业制氢的是()。
(A)H2O(电解)→H2+O2;(B)Zn+H2SO4→ZnSO4+H2;(C)C+H2O(g)∆−CO+H2;−→(D)CH4+H2O(g)∆,Ni,Co−−−−CO+H2。
−→解:B第11章(03539)在某些工厂用氢气做冷却剂,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:D第11章(03535)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。
解:D第11章(03536)下列分子或离子不能存在的是.()。
(A)H2;(B)H2+;(C)H22+;(D)H-。
解:C第11章(03537)下列原子、离子和分子中属于反磁性的是.()。
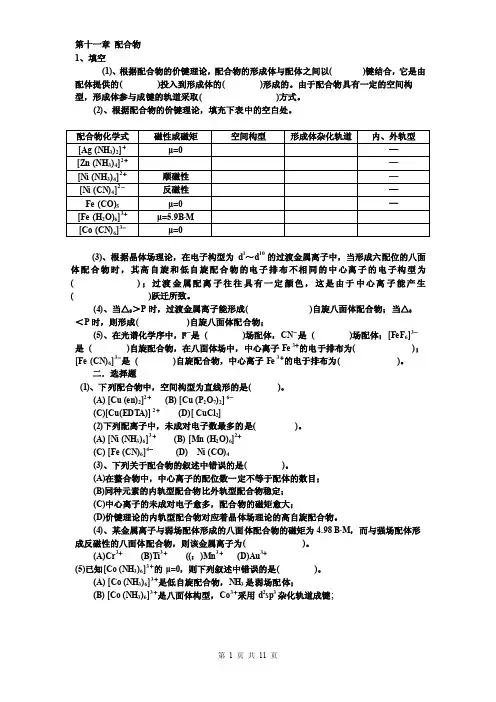
第十一章配合物1、填空(1)、根据配合物的价键理论,配合物的形成体与配体之间以( )键结合,它是由配体提供的( )投入到形成体的( )形成的。
由于配合物具有一定的空间构型,形成体参与成键的轨道采取( )方式。
(2)、根据配合物的价键理论,填充下表中的空白处。
(3)、根据晶体场理论,在电子构型为d1~d10的过渡金属离子中,当形成六配位的八面体配合物时,其高自旋和低自旋配合物的电子排布不相同的中心离子的电子构型为( );过渡金属配离子往往具有一定颜色,这是由于中心离子能产生( )跃迁所致。
(4)、当△0>P时,过渡金属离子能形成( )自旋八面体配合物;当△0<P时,则形成( )自旋八面体配合物;(5)、在光谱化学序中,F-是( )场配体,CN-是( )场配体;[FeF6]3-是( )自旋配合物,在八面体场中,中心离子Fe 3+的电于排布为( );[Fe (CN)6]3-是( )自旋配合物,中心离子Fe 3+的电于排布为( )。
二.选择题(1)、下列配合物中,空间构型为直线形的是( )。
(A) [Cu (en)2]2+(B) [Cu (P2O7)2] 6-(C)[Cu(EDT A)] 2+(D)[ CuCl2](2)下列配离子中,未成对电子数最多的是( )。
(A) [Ni (NH3)6]3+(B) [Mn (H2O)6]2+(C) [Fe (CN)6]4-(D) Ni (CO)4(3)、下列关于配合物的叙述中错误的是( )。
(A)在螯合物中,中心离子的配位数一定不等于配体的数目;(B)同种元素的内轨型配合物比外轨型配合物稳定;(C)中心离子的未成对电子愈多,配合物的磁矩愈大;(D)价键理论的内轨型配合物对应着晶体场理论的高自旋配合物。
(4)、某金属离子与弱场配体形成的八面体配合物的磁矩为4.98 B·M,而与强场配体形成反磁性的八面体配合物,则该金属离子为( )。
(A)Cr3+(B)Ti3+((:)Mn3+(D)Au3+(5)已知[Co (NH3)6]3+的μ=0,则下列叙述中错误的是( )。

无机化学s区元素测试题及答案一、选择题(每题2分,共10分)1. 以下哪种元素属于s区元素?A. 锂(Li)B. 钠(Na)C. 氧(O)D. 氯(Cl)答案:B2. s区元素的价电子排布是什么?A. ns^2B. ns^2np^xC. nd^xns^2D. (n-1)d^xns^2答案:A3. s区元素中,哪个元素的原子半径最大?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:D4. s区元素中,哪个元素的电负性最高?A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:A5. 下列化合物中,哪一个是s区元素形成的?A. NaClB. MgOC. SO2D. CO2答案:A二、填空题(每题2分,共10分)1. s区元素包括碱金属元素和______元素。
答案:碱土金属2. 碱金属元素的原子序数从______到______。
答案:3 到 113. 碱土金属元素的原子序数从______到______。
答案:12 到 184. s区元素的电子亲和能通常______。
答案:较低5. s区元素的电负性通常______。
答案:较低三、简答题(每题5分,共20分)1. 描述s区元素的一般化学性质。
答案:s区元素通常具有较低的电负性,容易失去最外层的电子形成阳离子,表现出强碱性,与水反应生成氢气和相应的碱。
2. 解释为什么碱金属元素的原子半径随着原子序数的增加而增大。
答案:碱金属元素的原子半径随着原子序数的增加而增大,是因为随着核电荷的增加,电子云的屏蔽效应增强,使得外层电子受到的吸引力减弱,从而导致原子半径增加。
3. 碱土金属元素与碱金属元素相比,其化学性质有何不同?答案:碱土金属元素的电负性比碱金属元素高,因此它们更容易形成化合物,并且它们的金属性比碱金属元素弱。
4. 举例说明s区元素在日常生活和工业中的应用。
答案:s区元素在日常生活和工业中有广泛的应用,例如钠(Na)用于制造食盐,钾(K)用于农业肥料,钙(Ca)用于建筑材料和骨骼强化,铯(Cs)用于原子钟等。

第八章原子结构填空题1、氢原子光谱是线状光谱这一实验事实说明了原子中电子能量的不连续性(量子化),在氢原子中电子的能级由质子数n 决定,其E3s= E3p,E3d< E4s; 在钾原子中,电子能级由量子数n,l 决定,其E4s< E3d;对钛原子,其E4s> E3d。
2、氢原子的基态1s电子在距核52.9pm附近的球壳中出现的概率最大, 这是因为距核更近时,虽然概率密度较大,但球壳体积却较小,因而概率较小; 距核更远处,虽然球壳体积较大,但概率密度却很小,因而概率也较小。
3、在Ψ2s2-r图中,r=2a0处,Ψ2s2=0,这类波函数为零的面称为节面, 它的存在是电子运动具有波动性的表现;这种性质由电子衍射实验所证实。
4、描述一个原子轨道要用3个量子数,其符号分别是n,l,m ;表征电子自旋的量子数是m s,其取值可为+1/2, -1/2 。
5、Pauling能级图中第六能级组中含有的原子轨道是6s,4f,5d,6p ; 能级交错可用钻穿效应来解释。
如果没有能级交错,第三周期应有18 种元素,实际上该周期只有8 种元素。
6、当n=4时,该电子层电子的最大容量为32 个;某元素原子在n=4的电子层上只有2个电子,在次外层l=2的轨道中有10个电子,该元素符号是Zn ,位于周期表中第( 四)周期,第ⅡB 族,其核外电子排布式为1s22s22p63s23p63d104s2。
7、在元素周期表中,价层电子构型为ns2np3的元素有N,P,As,Sb,Bi ,称为氮族(VA族)元素;价层电子构型为(n-1)d10ns2np6的元素有Kr,Xe,Rn ,这类元索属于稀有气体(或0族)。
8、镧系元素的价层电子构型为4f0-145d0-16s2。
锆和铪、铌和钽性质相似是由于镧系收缩造成的。
9、第118号元素原子的最外层电子构型应为7s27p6 ;镧系元素处于第五周期。
选择题1、下列叙述中正确的是…………………………………………………………(C)(A) 氢原子核外只有一个电子,也只能有一个原子轨道(B) 主量子数n=2时,只有2s和2p这两个原子轨道(C) n=2,l=1,m=0的原于轨道为2p z轨道(D) 2p轨道是哑铃形的,2p电子沿“∞”字轨道运动2、下列各组量子数中错误的是…………………………………………………( B )(A) n=3,l=2, m=0, ms=+1/2 (B) n=2, l=2, m=-1, ms=-1/2(C) n=4, l=1, m=0, ms=-1/2 (D) n=3, l=1, m=-1, ms=-1/23、多电子原子中,以下列量子数表征的电子,其能量最高的是……………( D )(A) 2,1,-1,+1/2 (B) 2,0,0,-1/2 (C) 3,1,1,+1/2 (D) 3,2,-1,+1/24、表征3dz2轨道的量子数是……………………………………………………( B )(A) n=2,l=1, m=0 (B) n=3,l=2, m=0 (C) n=3,l=1, m=0 (D) n=4,l=2, m=15、具有下列电子构型的原子中,属于激发态的是………………………………( A )(A) 1s22s12p1 (B) ls22s22p6 (C) ls22s22p63s2 (D) ls22s22p63s23p64s16、下列原子半径大小顺序中正确的是…………………………………………( B )(A) Be<Na<Mg (B) Be<Mg<Na (C) B<C<N (D) I<Br<K7、下列元素中,第一电子亲和能最小(放热最多)的是( A ) (A)Cl (B)F (C)Na (D)K8、下列元素中,第一电离能最大的是…( C ) (A)Be (B)P (C)N (D)B9、下列各组元素电负性大小顺序中错误的是…………………………………( D )(A)F>O>N (B)Cl>S>As(C)Li>Na>K (D)S>N>C回答问题若某元素原子的最外层只有1个电子,其量子数为n=4,l=0,m=0,m s=+1/2(或-1/2)。

第十一章 d 区、ds 区和f 区元素习题答案第二节1.(1)Cr 3+ + 3OH - = Cr(OH)3 (灰蓝色) (2)Cr(OH)3 + OH - = CrO 2-(深绿色)+ H 2O (3)CrO 2- + H 2O 2 + OH - = CrO 4-(黄色)+ H 2O (4)2CrO 4- + 2H +Cr 2O 72-(橙红色)+ H 2O (5)Cr 2O 72-+ H 2O 2 + 2H + == CrO(O 2)2(C 2H 5)2O (蓝色) (6)CrO(O 2)2 + H + == Cr 3+(绿色)+ O 2 +H 2O 2. 5.6.(1)KMnO 4溶液在光的催化作用下会发生分解反应:B aC rO 4 + H C l(浓)C rC l 3 + C l 2 + B aC l 2 + H 2O (1)C r 2O 72- + H 2O2C2- + 2H +PbC rO 4Pb 2+黄色)(2)C r(O H )3 + N H 3 + N H 4C l [C r(N H3)6]C l 3 + H 2O(3)(4) M n(O H )2 + O 2M nO (O H )2(褐色)(5) K 2MnO 4 + H 2SO 4K M nO 4(紫红色) + M nSO 4(棕色) + K 2SO 4 + H 2O(1) K 2C r 2O 7+3H 2S + 4H 2SO 4 = C r2(SO 4)32O + K 2SO 4(2) 2C rC l 3 + 16N aO H + 3B r 2 = 2N aC rO 4 + 6N aB r + 6N aC l + 8H 2O (3) K 2C r 2O 7 + H 2SO 4 = 2C rO 32SO 4 + H 2O (4) M nO 2 + 4H C l(浓) = M nC l 2 + C l 2 + 2H 2O(5) 2K M nO 4 + 6K I + 4H 2O = 2M nO 22 + 8K O H(6) 2K M nO 4 + N a 2SO 3 + 2N aO H = 2N a 2M nO 4 + K 2SO 4 + H 2O4K M nO 4 +2H 2O = 4M nO 2H -所以KMnO 4溶液应贮存在棕色瓶中,避光保存。

元素分析考试试题及答案一、选择题1. 元素周期表的排列是按照元素的什么性质来进行的?A. 原子核的质量B. 原子核的电荷C. 原子核的能量D. 原子核的大小答案:B2. 下列元素中,哪个元素是一种卤素?A. 氧B. 碘C. 钠D. 铜答案:B3. 元素周期表中,下列元素属于稀土元素的是:A. 铁B. 钾C. 镧D. 锌答案:C4. 以下哪种金属元素能够在空气中迅速生成一层氧化膜保护自身?A. 铁B. 锌C. 铝D. 钾答案:C5. 铁、镁和钙都属于什么类型的元素?A. 金属元素B. 非金属元素C. 稀土元素D. 卤素元素答案:A二、填空题1. 元素周期表中,具有最高电极负性值的元素是_________。
答案:氟2. 元素周期表中,具有最大原子半径的金属元素是_________。
答案:铯3. 具有最高核电荷数的元素是_________。
答案:氦4. 具有最高电离能的元素是_________。
答案:氦5. 具有最大电子亲和能的元素是_________。
答案:氯三、解答题1. 请解释简述元素周期表中的“周期”和“族”有什么含义,并举例说明。
答:元素周期表中的“周期”指的是元素按照原子核的电荷数从左至右排列的行。
每个周期代表了电子层的变化,从而反映了元素性质的周期性变化。
例如,第一周期的元素只有一个电子层,而第二周期的元素则具有两个电子层。
“族”指的是元素按照原子核周围的外层电子数从上至下排列的列。
每个族代表了外层电子数的变化,从而反映了元素性质的相似性。
例如,第一族的元素都只有一个外层电子,而第二族的元素都具有两个外层电子。
2. 钾是第一周期的元素,氯是第七周期的元素,请分别说明钾和氯的一些主要性质。
钾(K)是一种金属元素,具有低密度、低熔点和低沸点等特点。
钾在常温下是固态,具有银白色的光泽。
钾具有较低的电离能和电子亲和能,属于较活泼的金属。
它在与水反应时会剧烈放出氢气,并产生碱性氢氧化钾溶液。
氯(Cl)是一种非金属元素,具有黄绿色的气体状态。

元素分析测试题及答案一、选择题1. 元素周期表中,属于第IA族的元素是:A. 氢(H)B. 氦(He)C. 锂(Li)D. 钠(Na)答案:A2. 以下哪种元素的原子序数为26?A. 铁(Fe)B. 钴(Co)C. 镍(Ni)D. 铜(Cu)答案:C二、填空题1. 元素周期表中的元素按照______排列,每一周期称为一个______。
答案:原子序数;周期2. 元素周期表中的元素按照______排列,每一列称为一个______。
答案:电子层数;族三、判断题1. 所有金属元素都位于元素周期表的左侧。
()答案:错误2. 稀有气体元素的原子外层电子数都是8个。
()答案:错误(氦除外,其外层电子数为2)四、简答题1. 请简述元素周期表的基本结构。
答案:元素周期表是一个按照元素原子序数递增排列的表格,分为7个周期和18个族。
周期表的左侧主要是金属元素,右侧主要是非金属元素。
元素周期表的排列遵循元素的原子序数递增的规律,同一周期内的元素具有相同的电子层数,而同一族内的元素具有相似的化学性质。
2. 什么是元素的原子序数,它与元素的化学性质有何关系?答案:原子序数是指元素原子核中质子的数量,它决定了元素在周期表中的位置。
原子序数相同的元素具有相同的化学性质,因为它们具有相同数量的外层电子,这些外层电子决定了元素的化学行为。
五、计算题1. 如果某元素的原子量为56,原子序数为26,计算该元素的中子数。
答案:中子数 = 原子量 - 原子序数 = 56 - 26 = 30六、实验题1. 如何使用光谱分析法来确定一个元素的化学性质?答案:光谱分析法是一种通过分析元素发出或吸收的光谱来确定其化学性质的方法。
首先,将元素加热至高温,使其原子激发并发出光谱。
然后,通过光谱仪将光谱分解成不同波长的光。
每种元素都有其特定的光谱线,通过识别这些光谱线,可以确定元素的种类和化学性质。

2017年王元兰主编《无机及分析化学》(第二版)习题参考答案第1章 分散系统1.有两种溶液在同一温度时结冰,已知其中一种溶液为1.5 g 尿素溶于200 g 水中,另一种溶液为42.8 g 某未知物溶于l000.0 g 水中,求该未知物的相对分子质量(尿素的相对分子质量为60)。
解:根据稀溶液的依数性 Δt f =K f b 两溶液在同一温度结冰,表明它们的浓度相同, 即:(1.50/60)/(200/1000)=(42.5/M)/(1000/1000) 所以:M=340 (g •mol -1)2.浓度均为0.01mol·kg -1的蔗糖、葡萄糖、HAc 、NaCl 、BaCl 2其水溶液的凝固点哪一个最高,哪一个最低?解:NaCl 、BaCl 2是强电解质,HAc 是弱电解质,蔗糖、葡萄糖是非电解质。
同浓度的化合物,其质点数大小依次为: BaCl 2﹥NaCl ﹥HAc ﹥蔗糖 = 葡萄糖 故凝固点最高是蔗糖和葡萄糖,最低是BaCl 2 水溶液。
3.溶解3.24g 硫于40g 苯中,苯的沸点升高0.18K ,已知苯的K b =2.53,问硫在此溶液中的分子是由几个硫原子组成的?解:设〝硫分子〞的摩尔质量为M (g·mol -1)据Δt b =K b ·b b=b bt K ∆=53.281.0=0.32(mol·kg -1)又∵b=M24.3×401000 ∴M=256(g·mol -1)∵硫原子量是32, ∴硫分子是由8个硫原子组成。
4.为了防止水在仪器内结冰,可以加入甘油以降低其凝固点,如需冰点降至271K ,则在100g 水中应加入甘油多少克?(甘油分子式为C 3H 8O 3)解:甘油的摩尔质量为92(g·mol -1)据Δt f =K f ·b b=86.1271273-=1.075(mol·kg -1)∴应加入甘油为1.075×92×100/1000=9.9克5.相同质量的葡萄糖和甘油分别溶于100g 水中,比较所得溶液的凝固点、沸点和渗透压。

无机化学试题及答案s区元素一、选择题(每题2分,共20分)1. 以下哪种元素属于s区元素?A. 锂(Li)B. 钠(Na)C. 铝(Al)D. 氯(Cl)答案:B2. s区元素通常具有哪些价电子?A. 1个B. 2个C. 3个D. 4个答案:B3. 钠的电子排布式是什么?A. 1s²2s²2p⁶3s¹B. 1s²2s²2p⁶3s²C. 1s²2s²2p⁶3s²3p⁶D. 1s²2s²2p⁶3s²3p⁴答案:B4. s区元素的原子半径随着原子序数的增加而如何变化?A. 减小B. 增加C. 保持不变D. 先增加后减小5. 以下哪种化合物是由s区元素组成的?A. NaClB. MgOC. SO₃D. CO₂答案:A6. s区元素的金属性如何随原子序数增加而变化?A. 增强B. 减弱C. 先增强后减弱D. 先减弱后增强答案:A7. 锂的原子序数是多少?A. 2B. 3C. 4D. 5答案:B8. 钾的电子排布式是什么?A. 1s²2s²2p⁶3s²3p⁶4s¹B. 1s²2s²2p⁶3s²3p⁶4s²C. 1s²2s²2p⁶3s²3p⁶4s¹4p⁶D. 1s²2s²2p⁶3s²3p⁶4s²4p⁶答案:B9. s区元素的离子通常具有什么电荷?B. +2C. -1D. -2答案:A10. 钠的熔点是多少摄氏度?A. 98B. 300C. 600D. 900答案:A二、填空题(每题2分,共20分)1. s区元素包括碱金属元素和____元素。
答案:碱土2. 锂的原子序数为3,其电子排布式为______。
答案:1s²2s¹3. 碱金属元素的价电子数为______。
第11章习题解答③一、是非题⑴碱土金属氮氧化物碱性强弱的次序为:Be(OH)2<Mg(OH)2<Ca(OH)2<Sr(OH)2<Ba(OH)2o .()解:对(2)碱土金属氢氧化物溶解度大小的次序为:Be(OH)2<Mg(OH)2<Ca(OH)2<Sr(OH)2<Ba(OH)2o ()解:对(3)含有(2产、Mg"的水叫做硬水。
()解:错(4)碱土金属氯化物的熔点高低次序为:BeCl2<MgCl2<CaCl2<SrCl2<BaCl2o ()解:对(5)在所有气体中氨气的密度是最小的。
()解:错(6)最难液化的气体是氨气。
()解:对(7)稀有气体原子的最外层电子构型均为ns2np60 ()解:错(8)目前合成的稀有气体化合物主要是含氟、氧的化合物。
()解:对(9)範的氟化物的水解反应都不是氧化还原反应。
()解:错二、选择题(1)在下列溶液屮,碳酸钙溶解度最人的是()。
(A)0.lmol ・ f'CaCh;(B)O.lmol ・ L'Na2CO3;(C)纯水;(D)O.lmol ・ L_,NaHCO3o解:C(2)卜-列氢氧化物中,具有两性的是()o(A)Mg(OH)2; (B)Be(OH)2; (C)Ca(OH)2; (D)Ba(OH)2o解:B(3)下列氧化物中,为耐火材料主耍成分的是()。
(A)BaO; (B)MgO: (C)BeO: (D)SrOo解:B(4)下列难溶饮盐屮不溶于盐酸的是()。
(A)BaCO3; (B)BaSO4; (C)BaCrO4: (D)BaSO3o解:B(5)将BaCl2(aq)加入某溶液中,可生成溶于HCl(aq)的白色沉淀,由此可判断该溶液中可能含有()o(A)SO42_; (B)NOf; (C)S2';(D)S032 O解:D(6)下列物质无毒的是()。
(A)BeCl2; (B)NO X; (C)CaCl2; (D)S02o解:C(7)下列氢氧化物碱性最强的是()。
电子科技大学《普通化学》第十一章习题一、解释下列现象:(1)CsF虽有最高的离子性,但CsF熔点却较低。
解:Cs+的半径较大(约170pm),Cs+与F-之间的静电引力较小,使得CsF晶格能较小,虽然Cs与F 的电负性较大,CsF有最高的离子性,但CsF的熔点较低。
(2)碱土金属比相应的碱金属的熔点高,硬度大。
解:碱土金属有2个价电子,碱金属只有1个价电子,碱土金属的金属键比相应的碱金属的金属碱强,所以碱金属的熔点、硬度均比相应的碱金属高。
(3)BeCl2为共价化合物,而MgCl2,CaCl2等为离子化合物。
解:Be的电负性较大(1.57),Be2+的半径较小(约31pm),其极化能力强,所以BeCl2中Be-Cl键以共价性为主,BeCl2为共价化合物;而其他碱土金属的电负性较小,而离子半径比Be2+大很多,(Mg2+为65pm,Ca2+为95pm),MgCl2和CaCl2中的键为离子性为主,化合物为离子化合物。
(4)Mg(OH)2溶于NH4Cl溶液,而不溶于NaOH溶液。
解:Mg(OH)2碱性氢氧化物,不溶于NaOH溶液和水,同时,Mg(OH)2的K spθ不是很小,因而可溶于若酸性的NH4Cl溶液。
二、解释为什么CuSO4水溶液呈蓝色,而ZnSO4水溶液呈无色。
解:铜的水合离子组成为[Cu(H2O)4]2+,它就是一种络离子。
胆矾CuSO4·5H2O就是一种络合物,其组成[Cu(H2O)4]SO4·H2O,它是由四水合铜(Ⅱ)离子跟一水硫酸根离子结合而成。
d轨道未充满,显色,这是因为在晶体场的影响下,过渡金属离子的d轨道发生分裂,由于这些金属离子的d轨道没有充满,在吸收了一部分光能后,就可产生从低能量的d轨道向高能量d轨道的电子跃迁,这种跃迁称d-d跃迁。
配离子的颜色是从人射光中去掉被吸收的光,剩下来的那一部分可见光所呈现的颜色。
吸收光的彼长越短,表示电子跃迁(被激发)所需要的能量越大,亦即∆大,反之亦然。
第十一章后习题解答1. 区别下列名词:(1) 内层与外层(2) 单齿配体与多齿配体(3) d2sp3杂化和sp3d2杂化(4) 内轨配合物和外轨配合物(5) 强场配体和弱场配体(6) 低自旋配合物和高自旋配合物解(1)配合物的内层是由中心原子提供杂化轨道,配体中配位原子提供孤对电子,通过配位键形成的配离子。
与配离子带相反电荷的离子称为配合物的外层。
(2)只含有一个配位原子的配体称为单齿配体,如NH3,H2O,OH-,F -等。
含有两个或两个以上配位原子的配体称为多齿配体,如:乙二胺,EDTA等。
(3)以2个(n-1)d轨道、1个n s轨道和3个n p轨道杂化形成6个杂化轨道,称为d2sp3杂化。
以1个n s轨道、3个n p轨道和2个n d轨道杂化形成6个杂化轨道,称为sp3d2杂化。
(4)中心原子全部用最外层轨道杂化所形成的配合物称为外轨配合物;用次外层(n-1)d轨道和最外层n s,n p轨道杂化所形成的配合物称为内轨配合物。
(5)依据配体使中心原子d轨道能级的分裂程度不同,配体有强场、弱场之分。
使d轨道能级分裂能力强的配体称为强场配体,如CN-,CO;使d轨道能级分裂能力弱的配体称为弱场配体,如H2O、F -、Cl-、Br-、I-。
(6)中心原子电子组态为d4~d7的配合物中,单电子数多的称为高自旋配合物,单电子数少的称为低自旋配合物。
强场配体形成低自旋配合物,弱场配体形成高自旋配合物。
2. 命名下列配离子和配合物,指出中心原子、配体、配位原子和配位数,写出K s的表达式(1) Na3[Ag(S2O3)2] (2) [Co(en)3]2(SO4)3(3) H[Al(OH)4] (4) Na2[SiF6](5) [PtCl5(NH3)]-(6) [Pt(NH3)4(NO2)Cl](7) [CoCl2(NH3)3H2O]Cl (8) NH4[Cr(NCS)4(NH3)2]解名称中心原子配体配位原子配位数K s表达式(1) 二(硫代硫酸根)合银(I)酸钠Ag+S2O32-S2O32-中的S2 32322223[Ag(S O)][Ag][S O]-+-(2) 硫酸三(乙二胺)合钴(Ⅲ)Co3+en en中的N6 333+3[Co(en)][Co][en]+(3) 四羟基合铝(Ⅲ)酸Al3+OH-OH-中的O4434[Al(OH)][Al][OH]-+-(4) 六氟合硅(Ⅳ)酸钠Si(Ⅳ) F-F-中的F 62646[SiF][Si][F]-+-(5) 五氯•氨合铂(Ⅳ)酸根Pt4+Cl-,NH3Cl,N 653453[Pt(Cl)(NH)][Pt][Cl][NH]-+-(6) 氯•硝基•四氨合铂(Ⅱ)Pt2+NO2-,Cl-,NH3N,Cl、N 6 2342423[PtCl(NO)(NH)][Pt][Cl][NO][NH]+--(7) 氯化二氯•三氨•水合钴(Ⅲ)Co3+Cl-,NH3,H2OCl,N,O 623323233[Co(Cl)(NH)(H O)][Co][Cl][NH]++-(8) 四(异硫氰酸根)•二氨合铬(Ⅲ)酸铵Cr3+NCS-,NH3N,N 64323423[Cr(NCS)(NH)][Cr][NCS][NH]-+-3. 什么是螯合物?螯合物有何特点?它的稳定性与什么因素有关?形成五员环和六员环的螯合物,要求配体应具备什么条件?解由中心原子与多齿配体形成有环状结构的配合物称为螯合物。
第十一章ds区元素答案第十一章 ds 区元素1.ⅠA ⅠB 价电子构型 ns 1 (n-1)d 10ns 1 原子半径大小电离能小大化学活泼性强弱同族元素化学活泼性变化趋势增强减弱氧化态 +1 +1, +2, +3 与水作用强弱氢氧化无的碱性及稳定性强,稳定弱, 不稳定形成配合物的能力弱强2. ⅡA (碱金属)和ⅡB (铜族)族元素原子最外层只有一个电子,但铜族元素原子次外层为18电子,ⅠA 原子次外层为8个电子。
由于18电子结构的屏蔽效应小于8电子结构,使铜族元素原子有效核电荷数大,因而对最外层的一个s 电子吸引比碱金属强;原子半径、离子半径小而电离能大,金属活动性弱。
(2) 4Ag + 2H 2S + O 2 === 2Ag 2S(黑色) + 2H 2O3. (1) 2Cu + O 2 + CO 2 + H 2O === Cu 2(OH)2CO 3(绿色)(3) Au + 4HCl + HNO 3 === H[A uCl 4] + NO ↑ + 2H 2OCuSO 4 + 4NH 3 === [Cu(NH 3)4]SO 4CuSO 4 +2 NaOH === Cu(OH)2↓ + H 2OCu(OH)2 + 2NaOH === Na 2[Cu(OH)4]2CuSO 4 + 4KI === 2CuI ↓ + I 2 + K 2SO 44CuO === 2Cu 2O + O 2Cu(OH)2 === CuO + H 2O△△4.Hg(NO 3)2+ 4KI === K 2[HgI 4]Hg(NO 3)2 + Hg === Hg 2(NO 3)25. Hg(NO 3)2 + 2NaOH - === HgO ↓(黄色) + 2NaNO 3 + H 2O HgO + 2HCl === HgCl 2 + H 2O HgCl 2 + Hg === Hg 2Cl 26. (1) 加入NaOH 溶液,出现白色沉淀,随后又溶解的是锌盐,不溶解的是镁盐。
S 区元素(2008)第1题(12分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2COO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2 溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2 = Ca 2+ + Pb (EDTA)2 (1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2 溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S→O ,氮硫键画成N→S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3、+H 3N-SO 3得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3 Na 2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na 2[Fe(CN)5(NO)]是鉴定S 2 的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
Fe(II) 答II 或+2也可 (2分)[Fe(CN)5(NO)]2 +S 2 = [Fe(CN)5(NOS)]4 配合物电荷错误不得分 (1分)1-4 CaSO 4 • 2H 2O 微溶于水,但在HNO 3 ( 1 mol L 1)、HClO 4 ( 1 mol L 1)中可溶。
《元素化学》第1章 《S 区元素》自测题班级:应用化学1201B 姓名: 学号: 得分:一、选择题(75分)1 在下列性质中,碱金属比碱土金属高(或大)的是 ( )A. 熔点B. 沸点C. 硬度D. 半径2 下列性质中,碱金属和碱土金属都不具有的是 ( )A. 与水剧烈反应B. 与酸反应C. 与碱反应D. 与强还原剂反应3ⅠA,ⅡA 族元素的电离势,电负性和M 2分子中共价键的强度随着原子序数的增加而 () A. 逐渐增大 B. 逐渐减小 C. 无法推测 D. 变化不大4 下列原子中哪一种原子第一电离势最大 ( )A. NaB. LiC. BeD. Mg5 碱土金属与碱金属相比较,碱土金属比相邻的碱金属多一个电子,即增加了一个单位的核电荷,所以 () A. 碱土金属原子半径比相邻的碱金属大些 B. 电离势大C. 较易失去第一个电子D. 比碱金属更活泼6 下列元素中形成化合物时,共价倾向最小的是 ( )A. BeB. LiC. BaD. Cs7 最轻的金属是以下金属中的 ( )A. BeB. LiC. NaD. Mg8 下列金属单质不能保存在煤油里的是 ( )A. LiB. NaC. KD. Rb9 金属钠应保存在 ( )A. 酒精中B. 液氨中C. 煤油中D. 空气中10 下列金属单质表现两性的是 ( )A. LiB. MgC. BaD. Be11 因为E Ø(Na +/Na)<E Ø(Li +/Li),所以钠的化学性质比锂更活泼,此说法 ( )A. 因对果对B. 因对果错C. 因错果对D. 因错果错12 下列反应式所表示的反应与实验事实不符的是 ( )A. 6Li+N 2=2Li 3NB. 2Mg+SiO 2====高温2MgO+SiC. Be+O 2===燃烧 BeO 2D. 4Na+TiCl 4===高温Ti+4NaCl13 可用于吸收酒精中水分的氧化物是 ( )A. Na 2OB. K 2OC. BeOD. CaO14 因为Na 2O 2有强碱性,所以熔融Na =2O 2时不宜采用的器皿是 ( )A.铁器皿B. 镍制器皿C. 瓷制或石英器皿D. 以上都不行15 下列碱土金属氧化物中,硬度最大的是( )A. CaOB. BaOC. MgOD. BeO16 下列过氧化物中至今尚未发现的是( )A. Na2O2B. BeO2C. Rb2O2D. CaO217 下列氧化物不属于超氧化物的是( )A. NaO2B. BaO2C. RbO2D. KO218 实验室中用H2SO4与如下物质作用制备H2O2,这种物质是( )A. Na2OB. BaO2C. NaO2D. KO219 加热分解下列物质,可得相应氧化物的是( )A. LiNO3B. NaNO3C. KNO3D. CaCO3E. RbNO320 下列关于O2-结构和性质的叙述,错误的是( )A. O2-中有一个σ键和一个π 键B. O2-中有一个未成对的电子,具有顺磁性C. O2-的键级比O2小,稳定性比O2强D. 超氧化物能吸收CO2放出O2E. 超氧化物都是强氧化剂21 下列物质中与Cl2作用能生成漂白粉的是( )A. CaCO3B. CaSO4C. Mg(OH)2D. Ca(OH)222 下列四种氢氧化物中溶解度最小的是( )A. LiOHB. Mg(OH)2C. Be(OH)2D. Ba(OH)223 在NaOH溶液中通入CO2制备Na2CO3,以下各种情况中,效果最好的是( )A. 热的浓NaOH溶液B. 热的稀NaOH溶液C. 冷的浓NaOH溶液D. 冷的稀NaOH溶液24 下列金属离子中,难溶盐数目最多的是( )A. LiB. KC. NaD. Cs25 NaNO3和LiNO3都在1000K左右分解,其分解产物( )A. 都是亚硝酸盐和O2B. 都是氧化物和O2C. 都产生N2O4和O2D. 除都产生氧气外,其余产物均不同26 下列物质的硫酸盐在水中溶解度最小的是( )A. MgSO4B. CaSO4C. SrSO4D. BaSO427 下列金属的碳酸盐不易溶于水的是( )A. Li2CO3B. Na2CO3 D. K2CO3 D. NaHCO328 下列物质热分解温度最高的是( )A. MgCO3B. CaCO3C. SrCO3D. BaCO329 下列物质中,热稳定性最高的是( )A. NH4HCO3B. Ag2CO3C. Na2CO3D. CaCO330 下列物质中,哪一种物质最难溶解( )A. CaSO4B. CaC2O4C. Ca(OH)2D.CaCl231 0.5mol·l-1的NaCl溶液,冷却到0℃以下,开始有固体出现,此时溶液中的NaCl浓度将( )A. =0.5mol·l-1B. <0.5mol·l-1C. >0.5mol·l-1D. =032 钙及其挥发性化合物的火焰颜色为( )A. 橙红色B. 黄色C. 紫色D. 绿色33 在火焰试验中,下列金属哪一种不呈红色( )A. 锂B. 锶C. 铷D. 钡34 下列ⅠA,ⅡA的卤化物中难溶于水的卤化物是( )A. KFB. MI2C. MgF2D. MBrE. LiF35 锂和镁的哪种盐溶于水( )A. 氟化物B. 碳酸盐C. 磷酸盐D. 氯化物36 锂和镁的性质相似是由于( )A. 离子极化力相似B. 阳离子电荷相同,半径增大,φ值减小,极化力减小C. 相同电荷的阳离子半径增大,晶格能减小D. 阳离子半径减小,电荷高,φ值大37 下列哪组离子均可以水解的是( )A. Be2+,K+B. Be2+,Ca2+C. Li+,Ca2+D. Li+,Mg2+38 碱金属,碱土金属氢氧化物中显示两性的是( )A. Mg(OH)2B. Be(OH)2C. Sr(OH)2D. LiOH39 以下四种氢氧化物中碱性最强的是( )A. Ba(OH)2B. CsOHC. NaOHD. KOH40ⅠA,ⅡA族金属的硫酸盐,硝酸盐的热稳定性随着原子半径的增大而( )A. 逐渐增大B. 逐渐减小C. 无法推断D. 变化不大41 下列碳酸盐中,热稳定性最小的是( )A. Na2CO3B. MgCO3C. K2CO3D. CaCO342 制造红色信号弹或焰火,需选用的盐类是( )A. KClO3和KNO3B. Sr(ClO3)2C. SrCl2与SrSO4D. Ba(NO3)2和Ba(ClO3)243 以下物质中常用来制作红色焰火的氧化剂是( )A. KNO3B. KClO3C. Ba(ClO3)2D. Mg(NO3)244 "因为周期表中处于对角线位臵的元素都符合对角线规则,所以锂和镁的所有性质都相同"此说法( )A. 因对果对B. 因对果错C. 因错果对D. 因错果45 以下关于ⅠA,ⅡA族元素通性的叙述错误的是( )A. 与同周期其它元素相比,碱金属原子体积大,原子间引力小,所以它们的熔沸点低,硬度小B. ⅡA族元素r比ⅠA族小,所以ⅠA族元素的第1,2电离势比ⅡA族相应元素的大C. ⅠA,ⅡA族元素的原子外电子结构分别为nS1,nS2,所以ⅠA族元素只有+Ⅰ氧化态,ⅡA族元素只有+Ⅱ氧化态D. 碱金属元素在化合时,均形成离子键E. ⅠA,ⅡA族元素M2分子中共价键的强度依原子半径的增大而渐小46 下列各组金属中,与氧气反应仅生成普通氧化物的是( )A. Na,MgB. Be,LiC. Li,MgD. Cs,Ba D. Rb,Be47 在炼钢时常用于除去生铁中Si、P等杂质的氧化物是( )A. CaOB. MgOC.K2OD. BeO46 有关锂和镁性质上的相似性,下列说法不正确的是( )A. 锂和镁在过量氧气中燃烧形成普通氧化物B. 它们的氢氧化物加热分解,可生成相应的普通氧化物C. 锂和镁的氧化物离子性较强D. Li+和Mg2+水合能力差E. 它们氧化物易溶于乙醇49 下列关于锂和镁性质上的相似性说法错误的是( )A. 锂和镁的氢氧化物受热时,可分解为相应的氧化物B. 锂和镁的氟化物,碳酸盐和鳞酸盐都难溶于水C. 锂和镁的氯化物能溶于有机溶剂D. 锂和镁的固体密度都小于1g/cm3,熔点都很低50 在活泼金属Na、K、Rb、Cs中,Cs是最活泼的,因为( )A.它的半径最大B.它对价电子的吸引力最大C.它的价电子数量最多D.它的价电子离核最远二、填空题(25分)1 碱金属中_____离子的极化力最强,______变形性最大.2 碱金属和碱土金属单质一般用_____________方法制取,这是由于___________之故3 镁条在空气中燃烧主要产物是_______其次还有__________________4 用金属钠还原Na2O2可以制得_______,其反应为_______________;用金属钾还原_______可以制得K2O,其反应为_______________5在配制氢氧化钠溶液时,发现粒状的氢氧化钠相互粘结,表面被白色粉末覆盖.导致这种变化的两种物质是______和__________6 写出下列物质的分子式(或化学式) 1). 熟石膏________ 2). 大苏打____________ 3). 芒硝____________ 4). 元明粉____________7 BeCl2的熔点比MgCl2的______,因为________________________ BaO的熔点比LiF的_____________,因为____________________.8 泡沫灭火器里装的物质主要是___________使用时发生的化学反应是_________________9 金属钠和镁在空气中燃烧的生成物均溶于水后,产物溶液中除都有氢氧化物外,钠产物溶液中还有_______;镁产物溶液中还有______。
10 硝酸锶热分解的主要产物是_______,其分解反应方程式为__________________。