无机化学s区和p区元素
- 格式:ppt
- 大小:2.74 MB
- 文档页数:31





无机化学 p区元素p区元素是周期表中第13至18列元素,也被称为主族元素或气族元素。
它们的化学性质在同一周期内呈现出明显的变化,但在同一族内则有着相似的性质。
本文将从p区元素的发现、物理性质、化学性质和应用方面进行介绍。
一、发现历史p区元素包括第13至18列的元素,是一组很有特殊性质的元素。
人们在测定原子量和密度时陆续发现了这些元素。
在18世纪前,人们对许多p区元素的存在还没有足够的证据。
因此,这些元素也成为了化学家们探索的一个难题。
1830年代, Jons Berzelius 以三个十二面体化合物来系统地描述元素。
这些化合物即由氧、碳、氮、硫和磷的元素统一构成的,在此基础上,他将元素分成了四个区,包括酸基金属、上碲族、下碲族和稀有元素。
但当时的化学学家认为,有更多的元素应该属于上述因素中的某一组,于是 stas 和sebaste 花了 20 年时间,最终找到了人类认识的所有元素。
这一时期p区元素的最后发现是在1898年,由法国科学家Pierre Curie 发现的钋和镭。
二、物理性质1、电子配置p区元素的电子构型为 ns2np1-6(除氦He外,另有例外,即不是ns2np5,如氧O)。
其中,ns和np是主量子数。
p区元素的外层电子结构十分稳定,p区元素代表元素外层电子的数目是非常有限的,它们在化学之间的交互作用直接影响每个元素的化学适用性。
p区元素的数量相对比较少,但却具有十分丰富的化学反应性。
2、原子尺寸和电负性p区元素原子尺寸相比于同周期的s区或d区元素会比较小,但相比于前一个周期,p区元素的原子尺寸又会更加大一些。
这些原子尺寸的变化和电负性的变化有关。
氧、氮、碳等元素的电子云很大程度上影响着元素化学性质的表现。
一般来说,p区元素的电负性很高,因为它们具有较高的电子亲和能力和较高的电负性。
氨等化合物是p区元素高电负性的体现。
三、化学性质p区元素对于化学反应性的调节十分显著,同一页上的元素之间往往会显示出相似的化学性质。

13.1 复习笔记一、p区元素概述1.p区元素包括了除氢以外的所有非金属元素和部分金属元素。
与s区元素相似,p区元素的原子半径在同一族中自上而下逐渐增大,它们获得电子的能力逐渐减弱,元素的非金属性也逐渐减弱,金属性逐渐增强。
除第ⅦA族和稀有气体外,p区各族元素都由明显的非金属元素过渡到明显的金属元素。
2.p区元素特征(1)各族元素性质由上到下呈现二次周期性①第二周期元素具有反常性(只有2s,2p轨道);第二周期元素单键键能小于第三周期元素单键键能。
②第四周期元素表现出异样性(d区插入),例如:溴酸、高溴酸氧化性分别比其他卤酸(HClO3,HIO3)、高卤酸(HClO4,H5IO6)强。
③最后三个元素性质缓慢地递变(d区、f区插入)。
(2)多种氧化值①p区元素的价电子构型为n s2n p1-6,具有多种氧化态。
例如:氯的氧化值有+1,+3,+5,+7,-1,0等。
②惰性电子对效应:同族元素从上到下,低氧化值化合物比高氧化值化合物变得更稳定。
(3)电负性大,形成共价化合物。
二、硼族元素1.硼族元素概述硼族元素包括B,Al,Ga,In,Tl五种元素,其价电子构型为n s2n p1,因此他们一般形成氧化值为+3的化合物。
随着原子序数的增加,形成低氧化值+1化合物的趋势逐渐增强。
硼的原子半径较小,电负性较大,所以硼的化合物都是共价型的,在水溶液中也不存在B3+。
在硼族元素化合物中形成共价键的趋势自上而下依次减弱。
(1)缺电子元素硼族元素原子的价电子轨道数为4,而其价电子只有3个,这种价电子数小于价键轨道数的原子称为缺电子元素。
它们所形成的化合物有些为缺电子化合物。
缺电子化合物的特点:易形成配位化合物HBF4;易形成双聚物Al2Cl6。
(2)硼族元素的一般性质①B是非金属单质,Al、Ga、In、Tl是金属单质;②B,Al,Ga的氧化态是+3,In的氧化态是是+1和+3,Tl的氧化态是+1;③B的最大配位数是4,Al、Ga、In、Tl 的最大配位数是6。



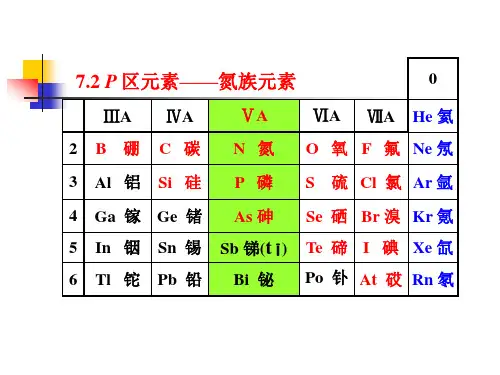

第七章元素与元素性质的周期性1.周期表与元素周期表的分区:按原子最后一个电子占据的轨道,周期表中元素可分为5个区。
s区的价电子构型为ns1~2,p区的价电子构型为ns2np1~6,d区的价电子构型为(n-1)d1~9ns1~2,ds区的价电子构型为(n—1)d10ns1~2,f区的价电子构型为(n —2)f0~14(n—1)d0~2ns2。
构造原理:基态多电子原子的电子填充原子轨道的一般次序为1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p 构造原理的前提条件是连续轨道间具有较大的能级差,而电子间的排斥作用相对较小。
对于d区元素与f区元素,由于价轨道间能级差较小,当电子间排斥作用超过轨道间能级差时,原子的价电子构型就会出现提前到达全满、半满的不符合构造原理的特殊构型。
通常,亚层轨道为全满或半满时比较稳定。
2.原子性质的周期性(1)原子半径一般规律:同一族元素,从上到下原子半径依次增大;同一周期主族元素,从左到右原子半径依次减小.镧系收缩:从镧到镥,原子半径和三价离子半径逐渐减小。
镧系收缩造成镧系后第三系列过渡元素的原子半径比一般的增大幅度小,与第二系列过渡同一族元素的原子半径接近.d电子也具有较差的屏蔽效应,造成d区元素半径收缩.原子半径存在不同的类型,主要有金属半径、离子半径、共价半径、van der Waals半径,使用时需要注意。
(2)电离能元素第一电离能的一般规律:同一族元素,从上到下逐渐减小;同一周期元素,从左到右大体上依次增大。
元素第一电离能最小的元素为周期表左下角的Cs,元素第一电离能最大的元素为周期表右上角的He.该规律一般可用的变化规律来解释。
原子有效核电荷Zeff(3)电子亲和能电子亲和能的周期性变化比较复杂,变化趋势不很清晰。
粗略的规律为:同一周期元素,从左到右原子电子亲和能依次增大,这可用原子有效核电荷Z的变化规律来解释。
化学专业英语一、无机化学1. periodic table 元素周期表element 元素metal 金属nonmetal 非金属transition metal 过渡金属group / family 族alkali metal 碱金属alkaline earth metal 碱土金属chalcogen 氮族元素halogen 卤素noble gas 稀有气体period 周期lanthanide 镧系元素actinide 锕系元素block 区s-block s区(H、He、碱金属、碱土金属)p-block p区(IIIA~VIIA族、稀有气体(He除外))d-block d区(过渡金属)f-block f区(镧系元素、锕系元素)2. electron configuration 电子排布,电子构型electron shell 电子层shell (电子)层subshell (电子)亚层atomic orbital 原子轨道structure 结构molecule 分子molecular 分子的atom 原子atomic nucleus 原子核electron 电子electron cloud 电子云ion 离子anion /ˈæn.aɪ.ən/ 阴离子cation /ˈkæt.aɪ.ən/ 阳离子3. quantum number 量子数principal quantum number 主量子数(n)1≤nazimuthal quantum number 角量子数(ℓ)0≤ℓ≤n-1magnetic quantum number 磁量子数(m)- ℓ≤m ≤ℓspin quantum number 自旋量子数(s或m s)±1/2Pauli exclusion principle(泡利不相容原理):Two electrons cannot occupy the same quantum state within a quantum system simultaneously.Hund’s principle / Hund’s rule(洪特规则):If two orbitals of equal energy are available, electrons will occupy them singly before filling them in pairs.4. chemical bond 化学键ionic bond 离子键ionization energy 电离能electron affinity 电子亲和能ionic polarization 离子极化dipole 偶极covalent bond 共价键metallic bond 金属键(=metallic bonding)intermolecular force 分子间作用力van der Waals force 范德华力5. Lewis structure 路易斯结构lone pairs 孤电子对,孤对电子valence electron 价电子single bond 单键multiple bond 多重键(double bond 双键,triple bond 三键)6. chemical reaction 化学反应四种基本反应类型(four basic types):combination reaction 化合反应 C + O2= C O2decomposition reaction 分解反应Cu(OH)2 = CuO + H2Odisplacement reaction (single displacement reaction) 置换反应Fe + CuSO4 = FeSO4 + Cumetathesis reaction (double displacement reaction) 复分解反应AgNO3 + NH4I = NH4NO3+ AgI↓precipitation 沉淀(作用)precipitate 沉淀物其它反应:reduction-oxidation reaction (=redox reaction) 氧化还原反应oxidation 氧化reduction 还原combustion 燃烧(=burning)stoichiometry /ˌstɔɪkiˈɒmɪtri/ 化学计量stoichiometric ration 化学计量比reactivity series of metals / activity series of metals 金属活动性顺序standard electrode potential 标准电极电势(符号Eθ)chemical stability 化学稳定性acid-base reaction 酸碱(中和)反应conjugated acid 共轭酸conjugated base 共轭碱Lewis acid 路易斯酸Lewis base 路易斯碱Brønsted acid Brønsted酸Brønsted base Brønsted碱7. solution 溶液solute 溶质solvent 溶剂concentration 浓度concentrated 浓的dilute 稀的molality 质量摩尔浓度(mol溶质/kg溶剂) mole fraction 摩尔分数mass fraction 质量分数mass concentration 质量浓度(kg/m3)osmotic pressure 渗透压molar concentration 摩尔浓度(mol/L)solubility 溶解度solubility product 溶度积(K sp)soluble 可溶的slightly soluble 微溶的insoluble 难溶的,不溶的solvation 溶剂化作用solvate 溶剂合物(如CaCl2·C2H5OH)hydration 水合作用hydrate 水合物(如CuSO4·5H2O)hemihydrate 半水合物monohydrate 一水合物dihydrate 二水合物(tri- 3, tetra- 4, penta- 5, hexa- 6, hepta- 7, octa- 8, nona- 9, deca- 10, undeca- 11, dodeca- 12)8. compound (=chemical compound) 化合物inorganic compound 无机化合物organic compound 有机化合物nomenclature /nəˈmenklətʃə(r)/ 命名法chemical formula 化学式empirical formula 实验式,简式structural formula 结构式molecular formula 分子式macromolecule 高分子polymer 聚合物coordination complex 配合物,络合物元素名以ium(或um)结尾的,去掉后缀,某化物加ide,如硫化钠sodium sulfide。
第 三 部 分 元 素 化 学•熟悉元素性质与电子层结构的关系 •掌握单质和重要化合物的性质•了解它们在医药中的应用结束无机化学 2014/12/1 §12-15 : 2从上到下 半径增大 电离能减小 电负性减小第一节 s 区元素概述第十一章 s 区元素ⅠA ns 1 Li Na K Rb Cs ⅡA ns 2 Be Mg Ca Sr Ba碱金属 碱土金属从左到右,半径减小电离能增大 电负性增大除Li 和Be 外,多数金属形成离子化合物。
p273结束 无机化学 2014/12/1 §12-15 : 7NaHCO 3:小苏打,用于治疗胃酸过多和酸中毒; CaCO 3: 珍珠、钟乳石、贝壳的主要成分;Na 2SO 4·10H 2O : 中药称芒硝或朴硝,作缓泻剂; Na 2SO 4 :中药称玄明粉或元明粉,作缓泻剂; BaSO 4: 重晶石,难溶于水、酸、碱,能强烈吸收X 射线,因无毒用作胃肠造影剂之“钡餐”; BaCl 2:剧毒(致死量0.8g )。
CaSO 4·2H 2O 生石膏,内服清热泻火; CaSO 4· H 2O 熟石膏(煅石膏, 烧石膏)粉末遇水膨胀硬化,石膏绷带,外敷治疗烫伤疥疮等。
MgSO 4·7H 2O :又称泻盐,作缓泻剂。
四、重要的盐类 p28112结束无机化学 2014/12/1 §12-15 : 8 五、对角线规则 p282在周期表s 区和p 区,某元素与左上方或右下方的元素及其化合物的性质相似。
例如:Be 和Al 的还原性相近; Be(OH)2和Al(OH)3 均为两性;例如:LiCl,、MgCl 2 都是共价化合物; LiOH 、Mg(OH)2都是中强碱,微溶于水Li Be B C Na Mg Al Si结束 无机化学 2014/12/1 §12-15 : 9VIIA 族 n s 2n p 59F 17Cl 35Br 53I 85At一、卤族元素的通性 (p284)(1) 是非极性分子,难溶于水,易溶于有机溶剂及碘化钾溶液中:KI + I 2 = KI 3 碘酒(碘酊)(p306习题3) F 2→I 2 的熔点、沸点、密度增大。