主族元素选论(s区-p区)PPT
- 格式:ppt
- 大小:7.28 MB
- 文档页数:166








第 三 部 分 元 素 化 学•熟悉元素性质与电子层结构的关系 •掌握单质和重要化合物的性质•了解它们在医药中的应用结束无机化学 2014/12/1 §12-15 : 2从上到下 半径增大 电离能减小 电负性减小第一节 s 区元素概述第十一章 s 区元素ⅠA ns 1 Li Na K Rb Cs ⅡA ns 2 Be Mg Ca Sr Ba碱金属 碱土金属从左到右,半径减小电离能增大 电负性增大除Li 和Be 外,多数金属形成离子化合物。
p273结束 无机化学 2014/12/1 §12-15 : 7NaHCO 3:小苏打,用于治疗胃酸过多和酸中毒; CaCO 3: 珍珠、钟乳石、贝壳的主要成分;Na 2SO 4·10H 2O : 中药称芒硝或朴硝,作缓泻剂; Na 2SO 4 :中药称玄明粉或元明粉,作缓泻剂; BaSO 4: 重晶石,难溶于水、酸、碱,能强烈吸收X 射线,因无毒用作胃肠造影剂之“钡餐”; BaCl 2:剧毒(致死量0.8g )。
CaSO 4·2H 2O 生石膏,内服清热泻火; CaSO 4· H 2O 熟石膏(煅石膏, 烧石膏)粉末遇水膨胀硬化,石膏绷带,外敷治疗烫伤疥疮等。
MgSO 4·7H 2O :又称泻盐,作缓泻剂。
四、重要的盐类 p28112结束无机化学 2014/12/1 §12-15 : 8 五、对角线规则 p282在周期表s 区和p 区,某元素与左上方或右下方的元素及其化合物的性质相似。
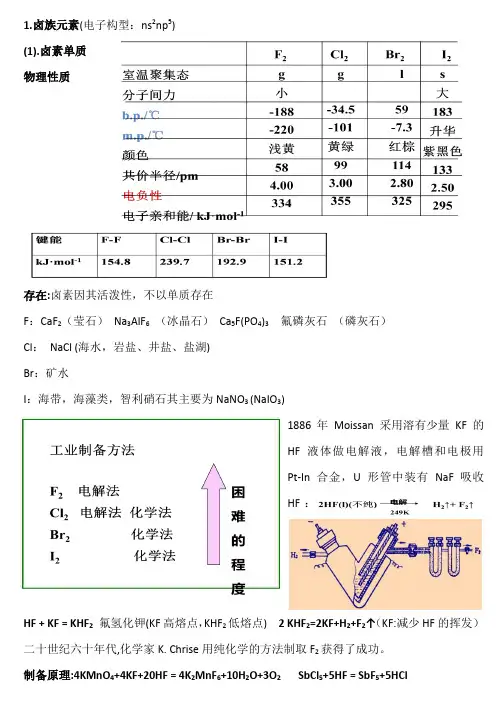
例如:Be 和Al 的还原性相近; Be(OH)2和Al(OH)3 均为两性;例如:LiCl,、MgCl 2 都是共价化合物; LiOH 、Mg(OH)2都是中强碱,微溶于水Li Be B C Na Mg Al Si结束 无机化学 2014/12/1 §12-15 : 9VIIA 族 n s 2n p 59F 17Cl 35Br 53I 85At一、卤族元素的通性 (p284)(1) 是非极性分子,难溶于水,易溶于有机溶剂及碘化钾溶液中:KI + I 2 = KI 3 碘酒(碘酊)(p306习题3) F 2→I 2 的熔点、沸点、密度增大。