第7章 s区和p区元素
- 格式:ppt
- 大小:7.19 MB
- 文档页数:41

s区元素的单质均为金属晶体;p区元素的中间部分,其单质的晶体结构较为复杂,有的为原子晶体,有的是过渡型(链状或层状)晶体,有的为分子晶体。
周期系最右方的非金属和稀有气体则全部为分子晶体。
总的来看,同一周期元素的单质,从左到右,一般由典型的金属晶体经过原子晶体、层状晶体或链状晶体等,最后过渡到分子晶体。
同一族元素单质由上而下,常由分子晶体或原子晶体过渡到金属晶体。
副族元素单质均为金属晶体.表9-5 主族及零族元素单质的晶体类型ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 零一H2分子晶体He分子晶体二Li金属晶体Be金属晶体B原子晶体C金刚石原子晶体石墨片状结构晶体富勒烯碳原子簇分子晶体N2分子晶体O2分子晶体F2分子晶体Ne分子晶体三Na金属晶体Mg金属晶体Al金属晶体Si原子晶体P白磷为分子晶体黑磷为层状结构晶体S斜方硫、单斜硫为分子晶体弹性硫为链状结构晶体Cl2分子晶体Ar分子晶体四K金属晶体Ca金属晶体Ga金属晶体Ge原子晶体As黑砷为分子晶体灰砷为层状结构晶体Se红硒为分子晶体灰硒为链状结构晶体Br2分子晶体Kr分子晶体五Rb金属晶体Sr金属晶体In金属晶体Sn灰锡为原子晶体白锡为金属结构晶体Sb黑锑为分子晶体灰锑为层状结构晶体Te灰碲链状结构晶体I2分子晶体Xe分子晶体六Cs金属晶体Ba金属晶体Tl金属晶体Pb金属晶体Bi层状结构晶体(近于金属晶体)Po金属晶体At金属晶体(具有某些金属性)Rn分子晶体单质的晶体结构和物理性质表9-5列出了主族及零族元素单质的晶体类型。
可以看出:s区元素的单质均为金属晶体;p区元素的中间部分,其单质的晶体结构较为复杂,有的为原子晶体,有的是过渡型(链状或层状)晶体,有的为分子晶体。
周期系最右方的非金属和稀有气体则全部为分子晶体。
总的来看,同一周期元素的单质,从左到右,一般由典型的金属晶体经过原子晶体、层状晶体或链状晶体等,最后过渡到分子晶体。
同一族元素单质由上而下,常由分子晶体或原子晶体过渡到金属晶体。
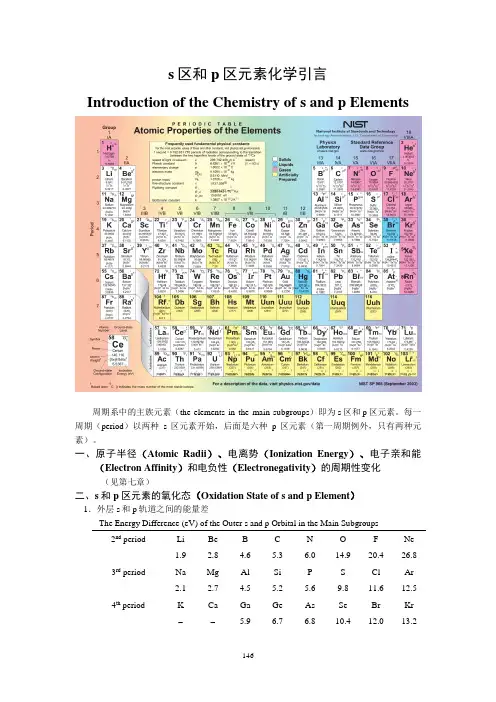
s区和p区元素化学引言Introduction of the Chemistry of s and p Elements周期系中的主族元素(the elements in the main subgroups)即为s区和p区元素。
每一周期(period)以两种s区元素开始,后面是六种p区元素(第一周期例外,只有两种元素)。
一、原子半径(Atomic Radii)、电离势(Ionization Energy)、电子亲和能(Electron Affinity)和电负性(Electronegativity)的周期性变化(见第七章)二、s和p区元素的氧化态(Oxidation State of s and p Element)1.外层s和p轨道之间的能量差The Energy Difference (eV) of the Outer s and p Orbital in the Main Subgroups 2nd period Li Be B C N O F Ne1.92.8 4.6 5.3 6.0 14.9 20.4 26.83rd period Na Mg Al Si P S Cl Ar2.1 2.7 4.5 5.2 5.6 9.8 11.6 12.54th period K Ca Ga Ge As Se Br Kr-- 5.9 6.7 6.8 10.4 12.0 13.25th periodIn Sn Sb Te I Xe 5.2 5.8 6.6 8.8 10.1 - 6th periodTl Pb Bi Po At Rn(7)(9)(10)(12)(16)-(1) 同一周期元素的最高氧化态的稳定性从左到右降低,这是由于s 和p 轨道之间的能级差增大,因此失去n s 2电子的机会减少,例如第三周期:ΔE 3s ~3p :Si(5.2eV),P(5.6eV),S(9.8eV),Cl(11.6eV)∴ ----4243444ClO SO O P SiO 、、、的稳定性从左到右降低(2) ΔE 3s ~3p <ΔE 4s ~4p >ΔE 5s ~5p 可以解释实验上发现如下稳定性序列:PCl 5>AsCl 5<SbCl 5,SF 6>SeF 6<TeF 6,-4ClO >-4BrO <-4IO(3) ΔE 6s ~6p 的值特别大,所以6s 2电子很难参与形成化学键,这种效应称为“6s 2惰性电子对效应”(inert 6s pair effect )2.通常周期系中奇数族元素的氧化数为奇数,偶数族元素的氧化数为偶数+3+5+7+1, 1En sn pEn sn p+4+6+2, 2三、s 和p 区元素的配位数(Coordination Numbers of s and p Elements )1.Fluoro and oxy complexes of selected elements) 2nd period -24BeF-4BF4CF +4NF3rd period -36AlF -26SiF -6PF 6SF+6ClF4th period -36GaF -26GeF-6AsF6SeF2nd period -33BO-23CO -3NO3rd period -44SiO -34PO-24SO-4ClO4th period -44GeO -34AsO -24SeO -4BrO5th period-86SnO-76SbO-66TeO-56IO-46XeO主族元素从上到下,配位数增大;同种元素与不同配体配位,配体体积越小,配位数越大。



电子排布本页我们将了解使用s、p、d标记书写电子排布式的方法。
在阅读本页之前你必须知道一些关于原子轨域的简单内容(原子轨域的名称和它们间能量的高低)。
如果你希望了解单离子(Cl-, Ca2+ , Cr3+等)电子排布式的书写,请点击页面的底部的链接。
重要! 如果你尚未阅读原子轨域这一章,建议你在继续本章内容之前,先了解原子轨域的相关内容。
原子的电子排布轨域填充与元素周期的关系大部分A'level教纲只要求书写从氢(H)到氪(Kr)的电子排布式, 但也有要求从氢写到钡(Ba)的教纲。
钡之后的镧系元素将出现f轨域——这超出了A'level的范围。
除了查阅教纲之外,你还可以看一看以前的试卷,以判断你会遇到哪些题目。
上图是简化后的元素周期表,本页将详细说明表中元素电子排布式的书写方法、演示几个大原子电子排布式的书写。
重要! 如果你需要查阅教学大纲(英文原站),请点击此链接。
第一周期氢唯一的电子位于1s轨域——1s1,氦的第一能级是满的——1s2.第二周期接着是向第二能级填充电子,元素表的第二周期由此开始。
2s轨域的能量低于2p轨域,因此锂的电子将进入2s 轨域。
锂的电子排布为1s22s1。
铍向同一轨域填入第二个电子——1s22s2。
然后轮到2p轨域的填充。
因为所有2p轨域的能量相同,所以电子将尽可能单独的进入轨域。
B 1s22s22px1C 1s22s22px 12py1N 1s22s22px 12py12pz1注意: 我们在这里使用粗体字是为了使轨域的变化醒目,当我们在书写电子排布式时不用将其描粗。
空轨域被占光后,电子只好挤在一起了。
O 1s22s22px 22py12pz1F 1s22s22px 22py22pz1Ne 1s22s22px 22py22pz2随着电子数量的不断增加,电子排布式的书写将变得越来越繁琐。
因此,你需要熟悉二种简写方式。
简写方式1: 能量相同的轨域统一只用一个符号表示。



![中级无机化学[第七章元素与元素性质的周期性]-山东大学期末考试知识点复习](https://uimg.taocdn.com/a18e231311a6f524ccbff121dd36a32d7375c721.webp)
第七章元素与元素性质的周期性1.周期表与元素周期表的分区:按原子最后一个电子占据的轨道,周期表中元素可分为5个区。
s区的价电子构型为ns1~2,p区的价电子构型为ns2np1~6,d区的价电子构型为(n-1)d1~9ns1~2,ds区的价电子构型为(n—1)d10ns1~2,f区的价电子构型为(n —2)f0~14(n—1)d0~2ns2。
构造原理:基态多电子原子的电子填充原子轨道的一般次序为1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p 构造原理的前提条件是连续轨道间具有较大的能级差,而电子间的排斥作用相对较小。
对于d区元素与f区元素,由于价轨道间能级差较小,当电子间排斥作用超过轨道间能级差时,原子的价电子构型就会出现提前到达全满、半满的不符合构造原理的特殊构型。
通常,亚层轨道为全满或半满时比较稳定。
2.原子性质的周期性(1)原子半径一般规律:同一族元素,从上到下原子半径依次增大;同一周期主族元素,从左到右原子半径依次减小.镧系收缩:从镧到镥,原子半径和三价离子半径逐渐减小。
镧系收缩造成镧系后第三系列过渡元素的原子半径比一般的增大幅度小,与第二系列过渡同一族元素的原子半径接近.d电子也具有较差的屏蔽效应,造成d区元素半径收缩.原子半径存在不同的类型,主要有金属半径、离子半径、共价半径、van der Waals半径,使用时需要注意。
(2)电离能元素第一电离能的一般规律:同一族元素,从上到下逐渐减小;同一周期元素,从左到右大体上依次增大。
元素第一电离能最小的元素为周期表左下角的Cs,元素第一电离能最大的元素为周期表右上角的He.该规律一般可用的变化规律来解释。
原子有效核电荷Zeff(3)电子亲和能电子亲和能的周期性变化比较复杂,变化趋势不很清晰。
粗略的规律为:同一周期元素,从左到右原子电子亲和能依次增大,这可用原子有效核电荷Z的变化规律来解释。

第七章 元素与元素性质的周期性7.1 元素的起源与分布大多数科学家能够接受的元素起源的假设是:质子聚变和中子俘获是宇宙中形成化学元素的两个主要过程。
这种假设认为,宇宙中所有元素都起源于氢,它在非常高的温度下,发生聚变反应,形成较重的原子核,首先是氦,其次是轻元素(锂、硼、铍等),这一过程是质子聚变。
氦原子轰击轻元素的原子,就会产生中子,这些中子被轻元素的原子核俘获,就形成较重的元素,从碳、氮、铁一直到原子序数为82和83的铅和铋,这一过程是中子俘获。
这两种产生元素的过程仍在恒星内部继续进行。
元素在自然界的分布情况一般用其丰度表示。
一种元素的丰度是指它在自然界中的平均相对含量。
地壳元素的丰度又称为克拉克值,通常用质量百分比或原子百分比表示。
7.2周期表中元素的分区及各区元素的特征现代的化学元素周期律是19世纪俄国人门捷列夫发现的。
他将当时已知的63种元素以表的形式排列,把有相似化学性质的元素放在同一直行,这就是元素周期表的雏形。
虽然已有上百种各式各样的元素周期表被提出,但被化学家普遍接受的元素周期表是建立在以原子电子结构变化的规律的基础上。
该表有行列构成,左边是 s 区,中间是 d 区,右边是 p 区,而底下两行则是 f 区;与原子结构对应:同一行元素原子电子层数相同,同一列元素原子价电子结构相似。
元素起源与分布周期表中元素的分区电子构型构造原理电子构型的特例及其解释元素的性质周期性反常性氢和第2周期元素的特殊性对角线关系第四周期p 区元素性质变化的反常性惰性电子对效应第五、六周期重过渡元素的相似性1) s 区: , 最后的电子填在ns上, 包括IAIIA, 属于活泼金属, 为碱金属和碱土金属;2) p 区:, 最后的电子填在np上, 包括IIIA-VIIA以及0族元素, 为非金属和少数金属;3) d 区:, 最后的电子填在(n-1)d上, 包括IIIB-VIIB以及VIII族元素, 为过渡金属;4) ds区:, (n-1)d全充满, 最后的电子填在ns上, 包括IB-IIB, 过渡金属(d和ds区金属合起来,为过渡金属);5) f 区: , 包括镧系和锕系元素, 称为内过渡元素或内过渡系.7.3原子结构的周期性,构造原理,电子构型的特例及其解释在结构化学中,我们学过基态原子的电子构型可以借助所谓的“构造原理”来确定,在多电子原子中,相对轨道能量不再只是由主量子数n 值决定,而是由n+l 值确定。