无溶剂反应:羟醛缩合反应
- 格式:doc
- 大小:227.00 KB
- 文档页数:5

R -CH 2-CHO + R 1-CH 2-CHO R -CH 2-CH -CH -CHOOH NaOH 溶液 R 1我对羟醛缩合反应的理解摘要:本文揭示了羟醛缩合反应的实质和原理,强调了羟醛缩合反应的使用和在高考试题中的体现。
关键词:羟醛缩合 原理 反应历程 使用一、羟醛缩合反应的概念:在稀碱或稀酸的作用下,两分子的醛或酮能够互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
这个反应叫做羟醛缩合或醇醛缩合。
例如:通过醇醛缩合,在分子中形成新的碳碳键,并增长了碳链。
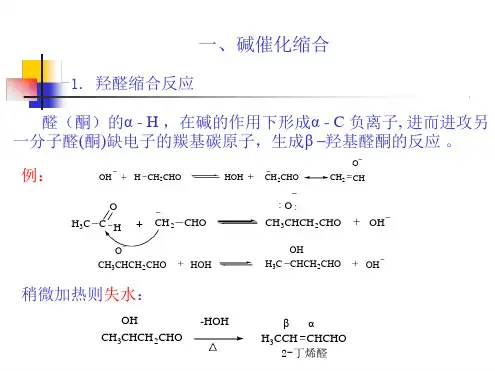
二、羟醛缩合反应历程:以乙醛为例说明如下:第一步,碱与乙醚中的α-氢结合,形成一个烯醇负离子或负碳离子:第二步是这个负离子作为亲核试剂,立即进攻另一个乙醛分子中的羰基碳原子,发生加成反应后生成一个中间负离子(烷氧负离子)。
第三步,烷氧负离子与水作用得到羟醛和OH 。
稀酸也能使醛生成羟醛,但反应历程不同。
酸催化时,首先因质子的作用增强了碳氧双键的极化,使它变成烯醇式,随后发生加成反应得到羟醛。
生成物分子中的α-氢原子同时被羰基和β-碳上羟基所活化,所以只需稍微受热或酸的作用即发生分子内脱水而生成,α,β-不饱和醛:凡是α-碳上有氢原子的β-羟基醛、酮都容易失去一分子水。
这是因为α-氢比较活泼,并且失水后的生成物具有共轭双键,所以比较稳定。
除乙醛外,由其他醛所得到的羟醛缩合产物,都是在α-碳原子上带有支链的羟醛或烯醛。
例如:三、羟醛缩合反应在有机合成上有的使用羟醛缩合反应在有机合成上有重要的用途,它能够用来增长碳链,并能产生支链。
具有α-氢的酮在稀碱作用下,虽然也能起这类缩合反应,但因为电子效应、空间效应的影响,反应难以实行,如用普通方法操作,基本上得不到产物。
一般需要在比较特殊的条件下实行反应。
例如:丙酮在碱的存有下,能够先生成二丙酮醇,但在平衡体系中,产率很低。

Abiko-Masamune羟醛缩合反应去甲麻黄碱(或去甲伪麻黄碱)衍生物作为手性助剂的丙酸酯和醛进行不对称羟醛缩合的反应,称为Abiko-Masamune羟醛缩合反应。
1997年,Abiko和Masamune首先开发了此手性助剂。
此反应条件温和,非对映选择性高,广泛应用于天然产物的全合成。
此反应与Evans羟醛缩合反应类似,反应中形成了硼化烯醇酯,最后生成是syn【3】或anti【2】构型的产物是由二烷基(三氟甲磺酰氧基)硼烷的烷基空间位阻、手性助剂、叔胺和温度(低温更容易生成动力学产物anti构型)共同决定的。
利用大位阻的二环己基(三氟甲磺酰氧基)硼烷和三乙胺通过生成E-硼烯醇酯生成anti构型的产物,而二丁基(三氟甲磺酰氧基)硼烷和DIPEA更容易生成syn构型的产物【10】。
此反应的优点是可以控制条件得到anti构型的产物。
乙酸酯进行此反应可能会生成双羟醛缩合产物【6】。
甲氧基乙酸酯可以高选择性的制备syn构型的乙醇酸衍生物【8】。
反应机理机理和Evans羟醛缩合类似,通过不同硼试剂的选择可以确定得到syn/anti构型。
用Zimmerman-Traxler六元环过渡态模型能够较好的解释说明底物与产物立体化学关系。
syn构型产物时,空间选择性和Evans羟醛缩合类似,由去甲麻黄碱的C1的构型决定最终产物构型。
anti构型产物时,去甲麻黄碱C2的构型决定产物构型。
反应实例anti Selective aldol (3). To a solution of norepinephrine ester (1R, 2S)-1 (4.80 g, 10 mmol) (R1 = Bn, R2= Mes) in CH2Cl2 (50 mL) in an oven-dried 500 mL flask under nitrogen was added via syringeTEA (3.40 mL, 24 mmol). A solution of dicyclohexylboron triflate (1.0 M in hexane, 22 mL) wasadded over 20 min at -78 ℃ and stirring was continued for 30 min. IBA 2 (R = iPr, 1.08 mL,12 mmol) was then added dropwise and the mixture was stirred at -78 ℃ for 30 min and then broughtto r.t. (1h). After quenching with a pH 7 buffer (40 mL), MeOH (200 mL) and 30% H2O2 (20 mL)were added slowly. After stirring overnight at r.t. and usual workup and evaporation a solid wasobtained which was crystallized from hexane (150 mL) to give crude 3 (4.4 g). Removal of cyclohexanol from the mother liquor and chromatography provided an additional product (0.6 g). Crystallization from EA–hexane (1:5) afforded 4.77 g (87%) of pure anti (+)-3.syn Aldol (3).5 As above, reaction of ester (1R, 2S)-1 (R1 = Me, R2 = octahydroanthracenyl(OHA),0.4 mmol) with n-Bu2BOTf (0.8 mmol) and iPr2NEt afforded 3-syn (98%).【J Org Chem. 2002, 67, 5250-5256】【J. Org. Chem.2009, 74, 19, 7220-7229】【Tetrahedron2010, 66, 187–196】【Tetrahedron2011, 67, 7485–7501】【J. Org. Chem. 2012, 77, 1477−1488】相关文献1 Brown HC Tet Lett 1992 33 34212 Abiko A, Masamune S J Org Chem 1996 61 25903 Abiko A, Masamune S J Am Chem Soc 1997 119 25864 Abiko A, Masamune S J Am Chem Soc 2001 123 46055 Abiko A, Masamune S J Org Chem 2002 67 52506 Abiko A Org Syn 2002 79 103,1167 Abiko A, Masamune S J Am Chem Soc 2002 124 107598 Andrus MB Org Lett 2002 4 35499 Abiko A Acc Chem Res 2004 37 38710 Dai W-M Tetrahedron 2010 66 187编译自:Organic Syntheses Based On Name Reactions, 3RdEd, A. Hassner, Page 1.。
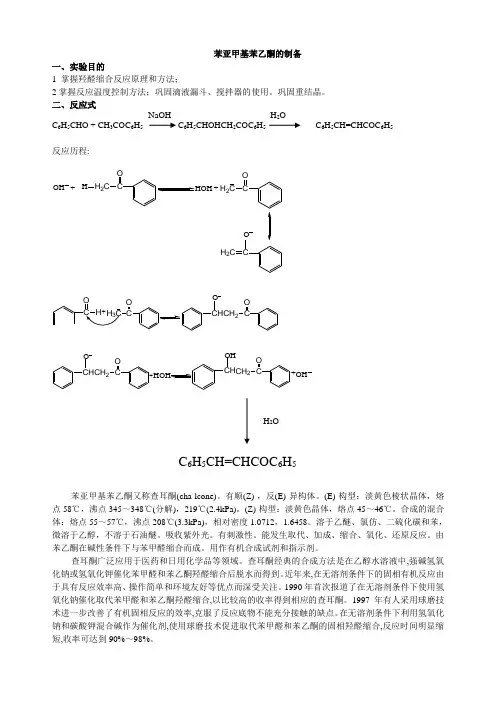
苯亚甲基苯乙酮的制备一、实验目的1 掌握羟醛缩合反应原理和方法;2掌握反应温度控制方法;巩固滴液漏斗、搅拌器的使用。
巩固重结晶。
二、反应式NaOH -H 2OC 6H 5CHO + CH 3COC 6H 5 C 6H 5CHOHCH 2COC 6H 5 C 6H 5CH=CHCOC 6H 5 反应历程:OH +CH 2C OH CH 2C O+CH 2C OCC OC OH CH CCH 2O O+CH CCH 2O O CH CCH 2O OH+OHC 6H 5CH=CHCOC 6H 5苯亚甲基苯乙酮又称查耳酮(cha-lcone)。
有顺(Z)-,反(E)-异构体。
(E)-构型:淡黄色棱状晶体,熔点58℃,沸点345~348℃(分解),219℃(2.4kPa)。
(Z)-构型:淡黄色晶体,熔点45~46℃。
合成的混合体:熔点55~57℃,沸点208℃(3.3kPa),相对密度1.0712,1.6458。
溶于乙醚、氯仿、二硫化碳和苯,微溶于乙醇,不溶于石油醚。
吸收紫外光。
有刺激性。
能发生取代、加成、缩合、氧化、还原反应。
由苯乙酮在碱性条件下与苯甲醛缩合而成。
用作有机合成试剂和指示剂。
查耳酮广泛应用于医药和日用化学品等领域。
查耳酮经典的合成方法是在乙醇水溶液中,强碱氢氧化钠或氢氧化钾催化苯甲醛和苯乙酮羟醛缩合后脱水而得到。
近年来,在无溶剂条件下的固相有机反应由于具有反应效率高、操作简单和环境友好等优点而深受关注。
1990年首次报道了在无溶剂条件下使用氢氧化钠催化取代苯甲醛和苯乙酮羟醛缩合,以比较高的收率得到相应的查耳酮。
1997年有人采用球磨技术进一步改善了有机固相反应的效率,克服了反应底物不能充分接触的缺点。
在无溶剂条件下利用氢氧化钠和碳酸钾混合碱作为催化剂,使用球磨技术促进取代苯甲醛和苯乙酮的固相羟醛缩合,反应时间明显缩短,收率可达到90%~98%。
-H 2O三、物理常数分子量状态熔点/℃沸点/℃比重溶解性苯乙酮120.15无色晶体,或淡黄色油状液体,有象山楂的香气。


羟醛缩合机理一、引言羟醛缩合是有机化学中一种重要的反应类型,也是生物大分子合成中最基本的反应之一。
本文将详细介绍羟醛缩合的机理。
二、羟醛缩合概述羟醛缩合是指在弱碱性条件下,甲醛或其他羰基化合物与具有活泼亲核性能的化合物(如胺、酚等)进行缩合反应,生成稳定的亚甲基或烷基化合物的过程。
在此过程中,甲醛分子首先被氢氧根离子(OH-)攻击,形成甲氧根离子和一个极性质子,然后极性质子进一步被亲核试剂(如胺、酚等)攻击,形成新的碳-碳键。
三、羟醛缩合机理1. 羟醛生成首先,在弱碱性条件下,甲醛分子与氢氧根离子发生反应,生成羟甲基或甲氧根离子。
这个步骤是整个反应过程中最重要的步骤之一。
2. 美拉德反应接着,在第一个步骤的基础上,羟甲基或甲氧根离子与亲核试剂(如胺、酚等)发生缩合反应,形成亚甲基或烷基化合物。
这个步骤被称为美拉德反应。
3. 羟醛缩合的条件羟醛缩合反应需要一定的条件,包括弱碱性环境、适当的温度和压力等。
在实际应用中,常用的催化剂包括氢氧化钠、氢氧化钾和三乙胺等。
四、羟醛缩合反应的机理解析1. 羰基亲核加成羰基亲核加成是指亲核试剂(如胺、酚等)中的负电子对攻击羰基碳上电子不足原子所形成的中间体。
在羟醛缩合反应中,亲核试剂(如胺、酚等)中的负电子对攻击了甲醛分子上电子不足原子所形成的中间体。
2. 产物稳定性分析产物稳定性是指产物分子内部键能与外界环境作用力之间平衡状态下所达到的最低自由能状态。
在羟醛缩合反应中,产物的稳定性是由产物分子内部键能和外界环境作用力之间的平衡状态所决定的。
3. 美拉德反应机理美拉德反应机理是指亲核试剂与甲醛分子发生缩合反应时,中间体的生成和消失过程。
在羟醛缩合反应中,美拉德反应机理包括亲核试剂攻击甲醛分子、中间体生成、中间体消失和产物生成等步骤。
五、羟醛缩合反应的影响因素1. 催化剂种类和用量催化剂种类和用量对羟醛缩合反应有重要影响。
常用的催化剂包括氢氧化钠、氢氧化钾和三乙胺等。

羟醛缩合实验报告羟醛缩合实验报告引言:羟醛缩合是一种有机合成反应,通过将羟醛与胺类化合物反应,生成羟醛缩合产物。
这种反应具有广泛的应用领域,包括药物合成、高分子材料制备等。
本实验旨在通过羟醛缩合反应,合成一种具有生物活性的化合物,并通过实验结果分析反应的效果和机理。
实验方法:1. 实验材料准备:- 羟醛:选择一种合适的羟醛化合物,如甲醛或乙醛。
- 胺类化合物:选择一种胺类化合物作为反应底物,如苯胺或甲胺。
- 溶剂:选择一种适合的溶剂,如甲醇或乙醇。
- 催化剂:选择一种适合的催化剂,如硫酸或氢氧化钠。
2. 实验步骤:a) 在实验室条件下,将羟醛和胺类化合物按一定摩尔比例混合。
b) 在混合物中加入适量的溶剂,以促进反应的进行。
c) 加入催化剂,提高反应速率。
d) 在适当的温度下进行反应,一般选择室温或加热至沸腾。
e) 反应一定时间后,将反应混合物进行分离和提纯。
f) 通过合适的实验方法,如红外光谱分析、核磁共振等,对合成产物进行表征和鉴定。
实验结果与讨论:通过羟醛缩合反应,我们成功合成了一种具有生物活性的化合物。
通过红外光谱分析,我们确定了产物的结构,并与已有文献进行了比对。
实验结果表明,羟醛缩合反应在适当的条件下可以高效地进行,产物的产率较高,并且具有较好的结构稳定性。
在本实验中,我们选择了甲醛和苯胺作为反应底物,甲醇作为溶剂,硫酸作为催化剂。
反应在室温下进行,反应时间为2小时。
通过红外光谱分析,我们观察到了产物中羟基和胺基的吸收峰,进一步证实了反应的进行和产物的结构。
羟醛缩合反应的机理较为复杂,主要涉及羟醛的亲核加成和缩合反应。
在反应中,羟醛的羰基碳上的氢被胺类化合物的氮原子亲核攻击,生成中间体,然后经过质子转移和缩合反应,形成羟醛缩合产物。
羟醛缩合反应具有许多优点,如反应条件温和、产物结构多样性等。
然而,该反应也存在一些问题,如产物的选择性和纯度的控制等。
在实际应用中,需要根据具体情况对反应条件进行优化,以提高产物的产率和纯度。

羟醛缩合反应及其区域选择性和立体选择性【摘要】:介绍羟醛缩合反应的基本概念、性质、用途,以及近年来关于定向羟醛缩合反应的区域选择性和立体选择性方面研究的新动向。
并举例说明该反应在有机合成中的应用。
【abstract】:This article mainly talks about the basic concept,properties and uses of aldol condensation reactions, and new trends of the researches on the regioselectivity and stereo-selectivity of directional aldol condensation reactions in recent years. Several examples will be given to show the applications of this reaction in organic synthesis.一、羟醛缩合反应:羟醛缩合反应,是指两个羰基化合物,通过第一个化合物的羰基与第二个化合物的羰基α-H原子进行缩合,形成β-羟基醛(酮)的反应。
在一些情况下反应能继续进行,生成不饱和羰基化合物。
通式为:它包括醛-醛缩合,酮-酮缩合,醛酮缩合以及一些自缩合等,醛在反应中并不一定存在的,但为方面起见,仍把这类反应成为羟醛缩合,它是有机化学中比较重要的一个反应。
羟醛缩合的本质是失去α-H的碳负离子作为亲核试剂,进攻另一个羰基,形成氧负离子,再夺取水中质子的过程。
这是一种增长碳链的方法,在有机合成上有很多的应用。
通常利用同一种醛或酮自身缩合,合成之后可比原料碳原子增加一倍。
例如工业上以乙醛为原料合成正丁醇就是利用了羟醛缩合反应:若是两种含α-H的羰基化合物进行缩合,则除了两种反应物之间的缩合之外,同一种化合物自身也会进行反应,成为交错羟醛缩合,反应最后会生成多种不同产物的混合物,难以分离。

羟醛缩合反应在有机化学中的应用摘要:羟醛缩合反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
羟醛缩合反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用羟醛缩合反应的机理:羟醛缩合反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
羟醛缩合反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。
③故羟醛缩合从机理上讲,是碳负离子对羰基碳的亲核加成。

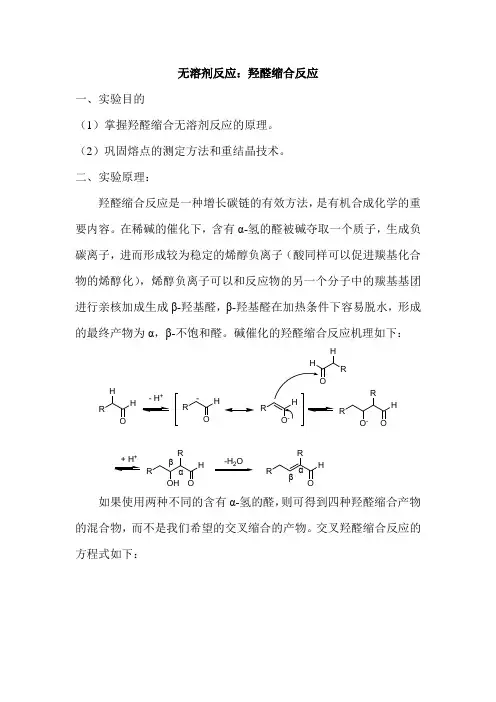
无溶剂反应:羟醛缩合反应一、实验目的(1)掌握羟醛缩合无溶剂反应的原理。
(2)巩固熔点的测定方法和重结晶技术。
二、实验原理:羟醛缩合反应是一种增长碳链的有效方法,是有机合成化学的重要内容。
在稀碱的催化下,含有α-氢的醛被碱夺取一个质子,生成负碳离子,进而形成较为稳定的烯醇负离子(酸同样可以促进羰基化合物的烯醇化),烯醇负离子可以和反应物的另一个分子中的羰基基团进行亲核加成生成β-羟基醛,β-羟基醛在加热条件下容易脱水,形成的最终产物为α,β-不饱和醛。
碱催化的羟醛缩合反应机理如下:R HH- H+RHO-HROO-+ROHHRO-H ORRHOααββ如果使用两种不同的含有α-氢的醛,则可得到四种羟醛缩合产物的混合物,而不是我们希望的交叉缩合的产物。
交叉羟醛缩合反应的方程式如下:RH HO R'HHO+R'R'HROH R'OHR'RHRRH++交叉羟醛缩合反应同种分子羟醛缩合反应然而,如果仅有一种羰基化合物,则α-氢去质子化后形成烯醇负离子就可以和其它含有羰基的化合物发生交叉羟醛缩合反应得到希望得到的产物,从而提高产物的合成效率。
例如苯甲醛不能转化成烯醇化物,可以与丙酮产生的烯醇负离子发生反应,就是一个成功的交叉羟醛缩合反应,其反应式如下:O H+H 3COCH 3OH OCH 3O CH 3由于空间位阻的关系,两分子的酮(丙酮和甲基酮除外)发生羟醛缩合反应,通常生成的产物量很少。
如果在反应过程中将产物从系统中不断取出,则可以提高产率。
在本实验中,将探索3,4-二甲氧苯甲醛和1-茚酮的羟醛缩合反应。
其反应如下:H 3CO H 3COH O+ONaOHOOCH 33与典型的羟醛缩合反应实验步骤相比,这个反应将在无溶剂条件下进行。
研究显示,很多反应不需溶剂就能很好地进行,这意味着在有机合成中可能不再需要通过选择溶剂来提高反应效率。
这些反应经常被看成是“固态”反应,虽然是在无溶剂状态下,但是固态反应物的混合物最终可能熔化,实际上反应依旧是在液态下进行。
羟醛缩合是一种有机反应:烯醇或烯醇负离子和羰基化合物反应形成β-羟基醛或者β-羟基酮,然后发生脱水得到共轭烯酮。
羟醛缩合在有机合成当中很重要,它是形成碳碳单键的关键条件之一,罗宾逊成环反应中有一步就是羟醛缩合反应。
羟醛缩合在大学有机化学课程中常作为一个经典构建碳键的反应进行讲解,并用该反应介绍反应机理。
在普通的羟醛缩合反应中,包涵了酮的烯醇对于醛的亲核加成,形成β-羟基酮或者“羟醛”(广泛出现于各种天然产物及药物中的一种结构单元)。
羟醛缩合在生物化学中也同样广泛存在。
羟醛反应自身由醛缩酶催化,然而该反应不是正式的缩合反应,这是因为过程中并未脱除小分子。
反应在醛和酮之间发生(交叉羟醛缩合),或者在两个醛之间发生,则称为Claisen-Schmidt缩合反应。
这些反应都被冠以发现人的名字莱纳·路德维希·克莱森和J.G.施密特。
他们分别于1880和1881年发表了自己在该领域的论文。
机理:
反应的第一步为羟醛反应,第二步为脱水反应即消除反应。
当分子内有活性羧基的情况下,该脱水反应还会伴随脱羧反应。
羟醛加成产物可通过两种机理进行脱水反应:强碱如:叔丁醇钾、氢氧化钾或氢氧化钠通过烯醇机理进行反应,[10]或通过酸-催化进行的烯醇机理进行反应。
酸催化的羟醛反应机理
酸催化的脱水反应
做碱)
碱催化的羟醛反应 (图例使用−OCH
3
碱催化的脱水反应 (这里通常被错写为简单一步,见E1cB消除反应)。
羟醛的缩合-概述说明以及解释1.引言1.1 概述羟醛的缩合是一种重要的化学反应,广泛应用于有机合成领域。
羟醛(也称为醛酮)是一类化合物,含有一个碳氧双键和一个碳氢双键的官能团,具有很强的活性。
羟醛缩合指的是两个或多个羟醛分子之间发生的反应,生成一个更大的分子,并且伴随着碳-碳键的形成。
羟醛缩合反应的机理一般包括羟基的负离子产生、亲核试剂的加成和负离子的消除等步骤。
在缩合反应中,羟醛分子发生自身的缩合,可以通过内部的亲核试剂(如羟基)攻击羰基碳上的电子云,从而形成新的碳-碳键。
羟醛缩合在有机合成中具有广泛的应用。
首先,它可以用于构建碳骨架,生成各种有机化合物,如酮、糖和天然产物等。
其次,羟醛缩合反应还可用于合成杂环化合物,如吡咯、噻吩和咪唑等。
此外,羟醛缩合还可以被用作多步合成中的关键步骤,实现合成目标化合物的合成。
综上所述,羟醛缩合反应在有机化学合成中起着重要作用,具有广泛的应用前景。
对羟醛缩合反应的研究不仅有助于深入理解其反应机理,还为合成新型有机化合物提供了有力的工具。
随着合成化学的不断发展,相信羟醛缩合反应将在未来的有机合成中发挥更大的作用。
1.2文章结构1.2 文章结构本文主要介绍了羟醛的缩合反应。
文章结构如下:1. 引言1.1 概述:简要介绍了羟醛的基本概念和缩合反应的背景。
1.2 文章结构:介绍了本文的整体结构和各个章节的内容。
1.3 目的:明确了本文的目标和意义。
2. 正文2.1 羟醛的定义和性质:详细介绍了羟醛的化学结构、命名规则和一些基本性质。
2.2 羟醛缩合反应的机理:探讨了羟醛缩合反应的基本原理和常见的机理路径。
2.3 羟醛缩合在有机合成中的应用:列举了羟醛缩合在有机合成中的一些重要应用,并说明其在合成中的优势和局限性。
3. 结论3.1 总结羟醛缩合的重要性:总结了羟醛缩合在有机合成中的重要性和广泛应用的现状。
3.2 展望羟醛缩合的未来发展:对羟醛缩合反应的未来发展方向和可能的改进进行了展望。
碱催化羟醛缩合反应机理
羟醛缩合反应机理是,具有α-H的醛或酮,在碱催化下生成碳负离子,然后碳负离子作为亲核试剂对醛或酮进行亲核加成,生成β-羟基醛,β-羟基醛受热脱水生成α-β不饱和醛或酮。
在稀碱或稀酸的作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
这个反应叫做羟醛缩合或醇醛缩合。
通过醇醛缩合,可以在分子中形成新的碳碳键,并增长碳链。
羟醛缩合反应过程
1、碱与乙醛中的α-氢结合,形成一个烯醇负离子或负碳离子。
2、这个负离子作为亲核试剂,立即进攻另一个乙醛分子中的羰基碳原子,发生加成反应后生成一个中间负离子(烷氧负离子)。
3、烷氧负离子与水作用得到羟醛和OH。
稀酸也能使醛生成羟醛,但反应历程不同。
酸催化时,首先因质子的作用增强了碳氧双键的极化,使它变成烯醇式,随后发生加成反应得到羟醛。
生成物分子中的α-氢原子同时被羰基和β-碳上羟基所活化,因此只需稍微受热或酸的作用即发生分子内脱水而生成,α,β-不饱和醛。
凡是α-碳上有氢原子的β-羟基醛、酮都容易失去一分子水。
这是因为α-氢比较活泼,并且失水后的生成物具有共轭双键,因
此比较稳定。
除乙醛外,由其他醛所得到的羟醛缩合产物,都是在α-碳原子上带有支链的羟醛或烯醛。
羟醛缩合反应在有机合成上有重要的用途,它可以用来增长碳链,并能产生支链。
羟醛缩合反应
羟醛缩合反应是一种化学反应,它发生在水溶液中,其结果是两个或多个羟醛分子形成一个稳定的羟醛缩合物。
羟醛缩合反应主要出现在碳水化合物分解和激活期间,它是在水溶液中发生的反应,在这些反应中,羟醛也被称为烷醛或醛羟酸。
在羟醛缩合反应中,羟醛被视为酸性物质,而参与缩合的其他羟醛分子被视为碱性物质。
当参与反应的羟醛分子在水溶液中相遇时,它们会缩合以形成一个新的羟醛缩合物。
羟醛缩合反应的化学反应表达式如下:
R-COOH + ROH R-CO-R + H2O
其中,R-COOH和ROH分别是参与反应的两个羟醛分子,R-CO-R 是最终形成的羟醛缩合物。
羟醛缩合反应是一种十分常见的反应,它也是碳水化合物分解时必不可少的一部分。
这种反应有助于生物体进行能量的储存和转换,因为在羟醛缩合反应中,能量被释放出来,从而可以帮助细胞进行其他生理过程,并保证机体的正常运行。
此外,羟醛缩合反应也可以用于合成一系列重要的有机化合物,如碳水化合物、糖、脂肪酸等,这些化合物对于人体的正常运转至关重要。
此外,羟醛缩合反应也可以用于实验室和工业生产。
在实验室,可以通过酸碱反应或电催化反应来合成有机物,这就加快了有机化合物的合成速度。
在工业生产中,可以使用羟醛缩合反应来制备聚合物材料,如水体胶。
羟醛缩合反应是一种相当重要的反应,它涉及到所有生物体的能量转换和储存过程,也被广泛应用于化学实验室和工业生产。
然而,它也有一定的局限性,因为反应速度受到温度和pH值的影响。
因此,在进行羟醛缩合反应时,需要考虑这些因素,以确保反应的顺利进行。
乙醛自身羟醛缩合反应条件(二)乙醛自身羟醛缩合反应条件1. 简介乙醛自身羟醛缩合反应是有机化学中常见的一种缩合反应,主要用于合成以羟基醛为核心结构的化合物。
本文将就乙醛自身羟醛缩合反应的条件进行详细介绍。
2. 反应条件乙醛自身羟醛缩合反应通常需要一定的催化剂和适当的反应条件才能进行。
以下是该反应常用的反应条件:•催化剂:一般情况下,常用的催化剂包括碱性条件下的氢氧化钠(NaOH)或碳酸钠(Na2CO3),酸性条件下的硫酸(H2SO4)等。
•温度:反应通常在适宜的温度下进行,一般为室温至反应溶液的沸点。
具体的温度要根据反应体系的不同而定。
•反应时间:乙醛自身羟醛缩合反应的反应时间会受到温度、催化剂和底物浓度等因素的影响。
通常情况下,反应时间为数小时至数天不等。
•溶剂:反应过程中常需要添加适量的溶剂来调节反应体系的浓度和稳定性。
常用的溶剂包括乙醇、甲醇、二甲基甲酰胺(DMF)等。
3. 反应机理乙醛自身羟醛缩合反应的机理较为复杂,下面将简要介绍一下其主要反应路径:1.首先,乙醛发生部分氧化反应生成乙酸和乙醇。
2.乙醇与乙醛发生酯化反应生成乙醇醋酸酯。
3.乙醇醋酸酯经酯水解反应生成对应的羟基醛化合物。
4. 应用和发展乙醛自身羟醛缩合反应在有机合成中具有广泛的应用价值,可以合成多种具有生物活性和药物活性的化合物。
在农药、药物和精细化工等领域有着重要的应用。
然而,乙醛自身羟醛缩合反应的高效催化剂的研发、反应条件优化和反应机理的深入研究仍然是当前的研究重点。
通过对反应条件和机理的探究,可以进一步提高该反应的选择性和产率,推动该领域的发展。
5. 总结乙醛自身羟醛缩合反应是一种常用的有机合成反应,其条件包括催化剂、温度、反应时间和溶剂等。
了解这些条件和反应机理对于控制反应的产率和选择性具有重要意义。
未来需要进一步的研究和优化,以推动该反应在有机合成领域的应用。
无溶剂反应:羟醛缩合反应
一、实验目的
(1)掌握羟醛缩合无溶剂反应的原理。
(2)巩固熔点的测定方法和重结晶技术。
二、实验原理:
羟醛缩合反应是一种增长碳链的有效方法,是有机合成化学的重要内容。
在稀碱的催化下,含有α-氢的醛被碱夺取一个质子,生成负碳离子,进而形成较为稳定的烯醇负离子(酸同样可以促进羰基化合物的烯醇化),烯醇负离子可以和反应物的另一个分子中的羰基基团进行亲核加成生成β-羟基醛,β-羟基醛在加热条件下容易脱水,形成的最终产物为α,β-不饱和醛。
碱催化的羟醛缩合反应机理如下:
R H
H
- H+
R
H
O
-
H
R
O
O-
+
R
OH
H
R
O
-H O
R
R
H
O
α
α
β
β
如果使用两种不同的含有α-氢的醛,则可得到四种羟醛缩合产物的混合物,而不是我们希望的交叉缩合的产物。
交叉羟醛缩合反应的方程式如下:
R
H H
O R'
H
H
O
+
R'
R'
H
R
OH R'
O
H
R'
R
H
R
R
H
+
+
交叉羟醛缩合反应
同种分子羟醛缩合反应
然而,如果仅有一种羰基化合物,则α-氢去质子化后形成烯醇负离子就可以和其它含有羰基的化合物发生交叉羟醛缩合反应得到希望得到的产物,从而提高产物的合成效率。
例如苯甲醛不能转化成烯醇化物,可以与丙酮产生的烯醇负离子发生反应,就是一个成功的交叉羟醛缩合反应,其反应式如下:
O H
+
H 3C
O
CH 3
OH O
CH 3
O CH 3
由于空间位阻的关系,两分子的酮(丙酮和甲基酮除外)发生羟醛缩合反应,通常生成的产物量很少。
如果在反应过程中将产物从系统中不断取出,则可以提高产率。
在本实验中,将探索3,4-二甲氧苯甲醛和1-茚酮的羟醛缩合反应。
其反应如下:
H 3CO H 3CO
H O
+
O
NaOH
O
OCH 33
与典型的羟醛缩合反应实验步骤相比,这个反应将在无溶剂条件下进行。
研究显示,很多反应不需溶剂就能很好地进行,这意味着在有机合成中可能不再需要通过选择溶剂来提高反应效率。
这些
反应经常被看成是“固态”反应,虽然是在无溶剂状态下,但是固态反应物的混合物最终可能熔化,实际上反应依旧是在液态下进行。
这种熔化现象非常有趣,而且是这个实验的一个关键。
我们已经知道,不纯混合物导致熔点降低,本实验即能较好地验证两种固态反应物混合,更易熔化,本实验还阐述了在没有溶剂存在的条件下实现有机化学反应的可能性。
这个实验还突出另一个重要的绿色概念——原子经济性反应。
羟醛缩合,如果无脱水的影响,有100%的原子经济性,而且只需要很少的酸或碱来催化,即使在有脱水的条件下,原子经济性仍然很高。
四、实验仪器和药品
仪器:烧杯(50 mL,250 mL,100 mL)各1个,研钵(瓷),水浴锅,金属刮勺,玻璃棒,电子天平,量筒(10 mL,100 mL)各1个,减压过滤装置一套,PH试纸,熔点仪,红外光谱仪。
药品:3,4 - 二甲氧基苯甲醛,1-茚酮,固态氢氧化钠,10%HCl 溶液,90%乙醇。
五、实验步骤
1、称取0.75g 3,4 - 二甲氧基苯甲醛和0.6 g 1-茚酮放入50mL烧杯中,用平头玻璃棒不断的搅拌和压碎固体混合物直到变成棕色油状物。
2、向反应混合物中加入约0.15 g已用瓷研钵磨好的氢氧化钠固体,注意放入时尽量让氢氧化钠分散开,不要集中在烧杯的某一个角落,然后用玻璃棒搅拌,直至混合物变成固体(在压碎过程中注意不
要将固体小颗粒飞出烧杯外,不要过于用力以免将烧杯捣碎)。
在搅拌过程中,注意尽量不要让很大块的固体集结在一起,为此可以边搅边用玻璃棒将大块的研开,然后继续搅拌,以便反应物和催化剂充分接触,静置15 min 。
3、加入6 mL 10%的HCl溶液,用金属刮勺把产物从烧杯壁和玻璃棒上刮下来,尽量刮干净,用玻璃棒捣碎,用玻璃棒蘸取少量溶液至pH试纸上,测pH值,确定其显酸性。
4、减压过滤(多抽虑一会),得固体产物。
5、重结晶:固体产物置于250 mL的烧杯中,并用70℃ 60 mL的90%乙醇,洗涤烧杯和滤纸,与上述溶液合并,70℃的水浴加热,并不断搅拌约8 min,促进其溶解(若在溶解过程中,溶液由淡黄色变深,可滴加几滴10%的盐酸),水浴恒温2 min让烧杯中的不溶物沉降(在溶解过程中为避免乙醇挥发过多,时间不得超10 min)。
待溶液澄清后,趁热将上清液转入100 mL的烧杯中,静止冷却至室温后有淡黄色丝状晶体析出,减压过滤,产物转移至并事先称好的干燥表面皿中,110℃的烘箱中干燥30 min,称量产物的质量并计算产率。
6、用研钵研碎,测量熔点(熔程)并记录。
七.注意事项:
2、避免与固态氢氧化钠或反应混合物接触。
注:1、产物颜色为淡黄色。
2.熔程为(176—179℃)。