03章_热力学第二定律9-13
- 格式:ppt
- 大小:1.20 MB
- 文档页数:76



第三章热⼒学第⼆定律第三章热⼒学第⼆定律⼀、本章⼩结热⼒学第⼆定律揭⽰了在不违背热⼒学第⼀定律的前提下实际过程进⾏的⽅向和限度。
第⼆定律抓住了事物的共性,推导、定义了状态函数—熵,根据熵导出并定义了亥姆霍兹函数和吉布斯函数,根据三个状态函数的变化可以判断任意或特定条件下实际过程进⾏的⽅向和限度。
通过本章的学习,应该着重掌握熵、亥姆霍兹函数和吉布斯函数的概念、计算及其在判断过程⽅向和限度上的应⽤。
同时,进⼀步加深对可逆和不可逆概念的认识。
⾃然界⼀切⾃发发⽣的实际宏观过程均为热⼒学不可逆过程。
⽽在没有外界影响的条件下,不可逆变化总是单向地趋于平衡态。
主要定律、定义及公式:1. 热⼒学第⼆定律克劳修斯说法:“不可能把热从低温物体传到⾼温物体⽽不产⽣其它影响。
” 开尔⽂说法:“不可能从单⼀热源吸取热量使之完全转化为功⽽不产⽣其它影响。
” 2. 热⼒学第三定律: 0 K 时纯物质完美晶体的熵等于零。
()*m 0lim ,0T S T →=完美晶体或 ()*m0K 0S =完美晶体,。
3. 三个新函数的定义式r δd Q S T =或 2r1δΔQ S T=?A U TSG H TS=-=-物理意义:恒温过程 r dA W δ=恒温恒压过程 'r dG W δ=4. 定理卡诺定理:在T 1与T 2两热源之间⼯作的所有热机中,卡诺热机的效率最⾼。
12121T T Q Q T Q ?-+≥?>不可逆循环=可逆循环 12120,0,Q Q T T=?不可逆循环可逆循环克劳修斯不等式:2121δ,Δδ,Q TS Q T>=不可逆过程可逆过程熵增原理:0,Δ0,S >??=?绝热不可逆过程绝热可逆过程 5. 过程判据熵判据:适⽤于任何过程;iso sysamb ΔΔΔS S S =+ 000>??=??,不可逆,可逆,不可能发⽣的过程亥姆霍兹(函数)判据:适⽤于恒温恒容,W '=0的过程;,0,d 00T VA>?⾃发=,平衡,反向⾃发吉布斯(函数)判据:适⽤于恒温恒压,W '=0;,0,d 00T p G>?⾃发=,平衡,反向⾃发 6. 熵变计算公式最基本计算公式:2r1δΔQ S T=?次基本计算公式:21d d ΔU p VS T(δW '= 0 )理想⽓体pVT 变化熵变计算公式:22,m 11Δln ln V T V S nC nR T V =+ 21,m 12Δlnln p T p S nC nR T p =+ 22,m ,m 11Δlnln V p p V S nC nC p V =+ 请读者⾃⼰从次基本计算公式推出以上三式,再由以上三式分别推导出理想⽓体恒温、恒压、恒容熵变计算公式。


第三章 热力学第二定律§3.1 热力学第二定律1.自发过程自发过程:在自然条件下,能够发生的过程,称为自发过程。
自发过程的逆过程称为非自发过程。
所谓自然条件,是指不需要人为加入功的过程。
例如:(1) 热量从高温物体传入低温物体; (2)气体向真空膨胀;(3)锌片与硫酸铜的置换反应等,。
说明:自发过程是热力学中的不可逆过程,这是自发过程长的共同特征。
自发过程的逆过程都不能自动进行,自发过程的逆向必须消耗功。
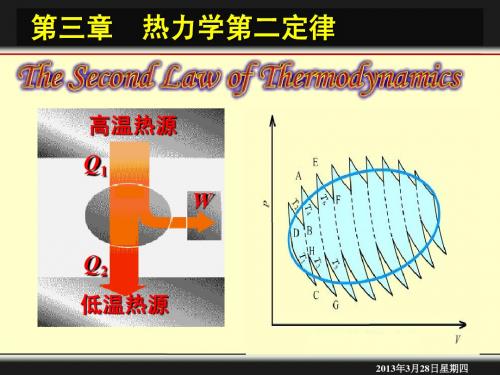
2.热、功转换任何热机从高温1T 热源吸热1Q ,一部分转化为功W ,另一部分2Q 传给低温2T 热源。
将热机所作的功与所吸的热之比值称为热机效率,或称为热机转换系数,用η表示。
恒小于1。
即1W Q η-=若热机不向低温热源散热,20Q =,此时热机效率可达到100%,将所吸收的热全部变为功,实践证明这样的机器永远造不成。
人们将这种从单一热源吸热全部用来对外作功的机器,称为第二永动机。
2.热力学第二定律克劳修斯(Clausius )的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。
”开尔文(Kelvin )的说法:“不可能从单一热源取出热使之完全变为功,而不发生其他的变化。
”克劳修斯和开尔文的说法都是指某一件事情是“不可能”的,即指出某种自发过程的逆过程是不能自动进行的。
克劳修斯的说法是指明热传导的不可逆性,开尔文的说法是指明功转变为热的过程的不可逆性,这两种说法实际上是等效的。
热力学第二定律和热力第一定律一样,是建立在无数事实的基础上,是人类经验的总结。
它不能从其它更普遍的定律推导出来。
§3.2 卡诺循环与卡诺定理1.卡诺循环(Carnot cycle )卡诺循环:由恒温可逆膨胀、绝热可逆膨胀、恒温可逆压缩、绝热可逆压缩四个可逆步骤组成的循环过程。
以理想气体为工作物质,从高温T 1热源吸收Q 1的热量,一部分通过理想热机用来对外做功W ,另一部分的热量Q 2放给低温T 2热源。
第03章热⼒学第⼆定律第3章热⼒学第⼆定律练习1、发过程⼀定是不可逆的。
⽽不可逆过程⼀定是⾃发的。
上述说法都对吗?为什么?答案:(第⼀句对,第⼆句错,因为不可逆过程可以是⾮⾃发的,如⾃发过程的逆过程。
)2、什么是可逆过程?⾃然界是否存在真正意义上的可逆过程?有⼈说,在昼夜温差较⼤的我国北⽅冬季,⽩天缸⾥的冰融化成⽔,⽽夜⾥同样缸⾥的⽔⼜凝固成冰。
因此,这是⼀个可逆过程。
你认为这种说法对吗?为什么? 答案:(条件不同了)3、若有⼈想制造⼀种使⽤于轮船上的机器,它只是从海⽔中吸热⽽全部转变为功。
你认为这种机器能造成吗?为什么?这种设想违反热⼒学第⼀定律吗?答案:(这相当于第⼆类永动机器,所以不能造成,但它不违反热⼒学第⼀定律)4、⼀⼯作于两个固定温度热源间的可逆热机,当其⽤理想⽓体作⼯作介质时热机效率为η1,⽽⽤实际⽓体作⼯作介质时热机效率为η2,则A .η1>η2B .η1<η2 C.η1=η2 D.η1≥η2 答案:(C )5、同样始终态的可逆和不可逆过程,热温商值是否相等?体系熵变 ΔS 体⼜如何?答案:(不同,但 ΔS 体相同,因为 S 是状态函数,其改变量只与始、终态有关)6、下列说法对吗?为什么?(1)为了计算不可逆过程的熵变,可以在始末态之间设计⼀条可逆途径来计算。
但绝热过程例外。
(2)绝热可逆过程 ΔS =0,因此,熵达最⼤值。
(3)体系经历⼀循环过程后,ΔS =0 ,因此,该循环⼀定是可逆循环。
(4)过冷⽔凝结成冰是⼀⾃发过程,因此,ΔS >0 。
(5)孤⽴系统达平衡态的标态是熵不再增加。
答案:〔(1) 对,(2) 不对,只有孤⽴体系达平衡时,熵最⼤,(3)不对,对任何循环过程,ΔS =0 不是是否可逆,(4) 应是 ΔS 总>0,⽔→冰是放热,ΔS <0,ΔS >0,(5) 对〕7、1mol H 2O(l )在 373.15K 、下向真空蒸发变成 373.15K 、的 H 2O(g ),试计算此过程的 ΔS 总,并判断过程的⽅向。