溶液的配制及分析2(课件)
- 格式:ppt
- 大小:589.50 KB
- 文档页数:20




班级 姓名:一:学习目标1. 初步掌握配制一定物质的量浓度溶液的方法和步骤。
2. 了解生产和研究中经常要用中和滴定等方法进行定量测定。
3. 进一步认识实验方案设计、实验条件控制、实验现象分析和实验数据处理等方法在化学学习和科学研究中的应用。
二:课前预习1.容量瓶上标有容量瓶的 (常见规格有 、 、 、 等)、 (一般标记的为 )。
在容量瓶上所标记的温度下,当溶液的 与 相切时容量瓶中溶液的体积即为容量瓶上所表记的体积。
容量瓶不能用作物质 或 的容器,热溶液需待 后才能转移到容量瓶中。
2.配制100mL0.1 mol ·L -1的Na 2CO 3步骤:(1)计算:计算所需Na 2CO 3固体的质量为 g 。
(2)称量:用 准确称取 g 无水Na 2CO 3固体。
(3)溶解:将无水Na 2CO 3固体放入 中,用 溶解, 到室温(4)转移:将烧杯中的溶液用 小心地引流到 中。
用洗涤 ,并将每次洗涤后的溶液注入 中。
轻轻振荡容量瓶,使溶液混合均匀。
(5)定容: 地将 注入到容量瓶中,直到容量瓶中的液面接近刻度线 处。
改用 滴加蒸馏水至 ,再将容量瓶塞盖好,反复上下 。
(6)贮存溶液:将配制好的溶液倒入试剂瓶中,贴好标签。
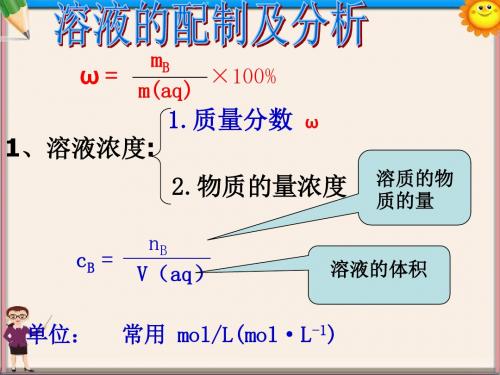
三:课堂研讨配制溶液时的误差分析浓度误差的判断方法:将称量误差和定容误差结合公式 进行判断: V 一定时,B n 增大,B C ;B n 减小,B CB n 一定时,V 减小,BC ;V 增大,B C 。
以配制某浓度的NaOH 溶液为例分析如下:a.称取时间过长或用滤纸称量,导致n ,则c 。
b.向容量瓶内转移溶液时有少量液体溅出,导致n ,则c 。
c.未洗涤烧杯和玻璃棒,导致n ,则c 。
d.未冷却至室温即转移至容量瓶,导致V ,则c 。
e.定容时加水量过多,用滴管吸出,导致n ,则c 。
f.定容时仰视,导致V ,则c 。
g. 定容时俯视,导致V ,则c 。
h. 定容后摇匀,发现液面下降又加水,导致V ,则c 。

课题:溶液的配制及分析(第二课时)教学目标:1.知识与技能(1)会使用容量瓶(2)会配制一定物质的量浓度的溶液2.过程与方法掌握配制一定物质的量浓度的溶液的实验方法,并且可以初步进行实验误差的分析。
3.情感态度与价值观(1)培养学生动手实验的操作能力和分析、解决问题的能力;(2)培养学生根据具体的实验要求自己设计实验步骤,选择实验方案和实验仪器的能力,培养学生注重实验,崇尚科学的认知态度。
教学重点:容量瓶的使用方法;一定物质的量浓度的配制过程;误差分析教学难点:误差分析教学方法:演示实验法、谈话法教学用具:100mL 烧杯、250mL 烧杯、玻璃棒、容量瓶、胶头滴管、NaCl 固体课时安排:1个课时教学过程:一、导入新课【复习】我们学习了用物质的量浓度表示溶液的组成,溶质物质的量单位是mol ,体积是指溶液的体积,单位为L ,所物质的量浓度的单位为mol/L 。
那如何配制一定物质的量浓度的溶液呢?需要哪些仪器?哪些步骤?这就是这节课学习的重点。
二、讲授新课内容【展示】(ppt1)大小不同容量瓶图片和实物图【介绍】这种梨形大肚子长颈的玻璃容器叫做容量瓶,是专门用来精确配制一定体积、一定浓度的溶液的仪器。
【介绍】容量瓶由瓶体与瓶身组成。
大家可以看到,容量瓶有大小不同的规格:50mL 、100mL 、250mL 、500mL 、1000mL 等。
大家再认真观察可以发现,容量瓶上有三个标注需要注意。
一个是容量瓶的规格,老师手上这个容量瓶的规格是250mL (请同学看);另一个是温度,一般是20°。
另外,瓶颈上还有一个没有数字标识的刻度线,该刻度线表示在所标示温度下,当溶液的凹液面正好与该刻度线相切时,容量瓶中的溶液的体积为容量瓶上所标注规格n B Vc B的体积。
(ppt2大个清楚的容量瓶,各标注指出来。
)【板书1】一、容量瓶标注:规格、刻度线、温度【讲述】下面我们以配制250mL0.2mol/LNaCl溶液为例,说明容量的使用方法、使用注意事项和配制一定物质的浓度溶液步骤以及注意事项。