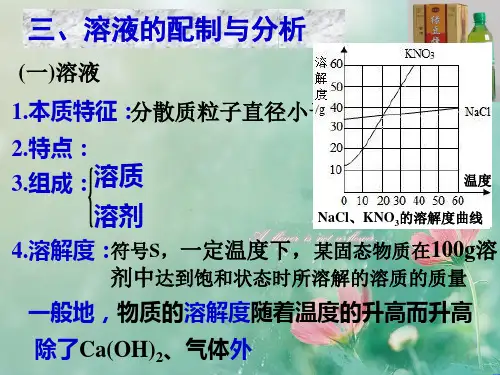
(二)表示溶液浓度的物理量 1.质量分数ω(a%)
ω=
m(溶质) m(溶液)
×100%
=
m(溶质) m(溶剂)+ m(溶质)
例:25℃, NaCl的溶解度为36g。现将20gNaCl投入 50g水中,求该溶液中NaCl的质量分数?
实验:一定质量分数的溶液的配制
2
用稀盐酸中和含1molNaOH的溶液,需要 多少体积盐酸?
7
注意 Ⅲ.物质与水发生化学反应,溶质是生成物 IV.NH3、Cl2等溶于水后成分复杂,求算浓度时 仍以NH3、Cl2为溶质 ② 格式的规范和带单位运算 ③从溶液中取出任意体积的溶液,其溶质的物 质的量浓度相同,但所含溶质的物质的量不同
8
物质的量浓度 (cB)
粒子数 (NB)
物质的量 (nB)
质量 (mB)
xmL× 1.84g/mL98%=5mol/L×0.1L ×98g/mol
c浓 V(aq)浓 = c稀 V(aq)稀
带单位计算
15
3.有关计算
3)利用化学方程式的计算
例5.实验室用0.1000mol·L-1NaOH溶液 中反该·和盐应·酸时25.的,00物消m质耗L盐的Na酸O量,H浓当溶度酸液?与24碱.5恰0·m·好L·完。·全求 方法根据反应时消耗已知浓度溶液的体积,
注意④ V(aq)≠ V(溶剂), V(aq) ≠V(溶剂)+ V(溶质)
V(aq)=
m(溶液) ρ
mL ×10—3L/mL
10
想一想
1.已知98%的H2SO4溶液的密度为 1.84g/cm3,求其物质的量浓度?
18.4mol·L—1
11
3.有关计算
1)两个物理量的互换