常规考马斯亮蓝染色液
- 格式:pdf
- 大小:239.10 KB
- 文档页数:2
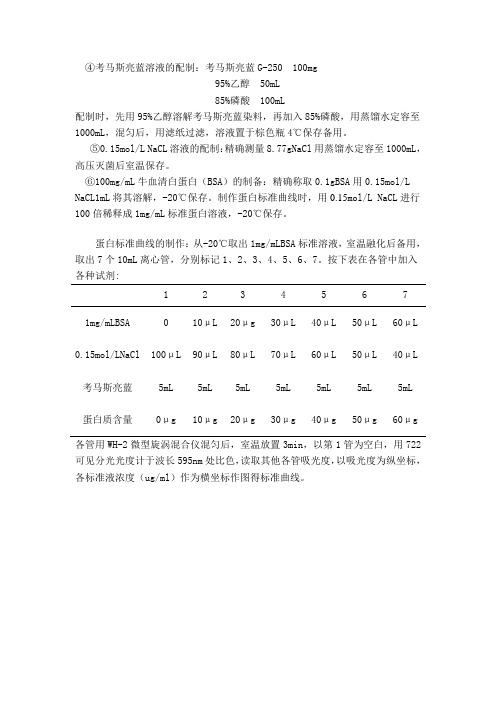
④考马斯亮蓝溶液的配制:考马斯亮蓝G-250 100mg
95%乙醇 50mL
85%磷酸 100mL
配制时,先用95%乙醇溶解考马斯亮蓝染料,再加入85%磷酸,用蒸馏水定容至1000mL,混匀后,用滤纸过滤,溶液置于棕色瓶4℃保存备用。
⑤0.15mol/L NaCL溶液的配制:精确测量8.77gNaCl用蒸馏水定容至1000mL,高压灭菌后室温保存。
⑥100mg/mL牛血清白蛋白(BSA)的制备:精确称取0.1gBSA用0.15mol/L NaCL1mL将其溶解,-20℃保存。
制作蛋白标准曲线时,用0.15mol/L NaCL进行100倍稀释成1mg/mL标准蛋白溶液,-20℃保存。
蛋白标准曲线的制作:从-20℃取出1mg/mLBSA标准溶液,室温融化后备用,取出7个10mL离心管,分别标记1、2、3、4、5、6、7。
按下表在各管中加入各种试剂:
1 2 3 4 5 6 7
1mg/mLBSA 0 10μL 20μg 30μL 40μL 50μL 60μL 0.15mol/LNaCl 100μL 90μL 80μL 70μL 60μL 50μL 40μL 考马斯亮蓝5mL 5mL 5mL 5mL 5mL 5mL 5mL 蛋白质含量0μg 10μg 20μg 30μg 40μg 50μg 60μg
各管用WH-2微型旋涡混合仪混匀后,室温放置3min,以第1管为空白,用722可见分光光度计于波长595nm处比色,读取其他各管吸光度,以吸光度为纵坐标,各标准液浓度(ug/ml)作为横坐标作图得标准曲线。

考马斯亮蓝染色详细实验步骤考马斯亮蓝染色液R250配方(100ml):考马斯亮蓝R250 0.25g甲醇45ml冰醋酸10mlddH2O 45ml考马斯亮蓝脱色液配方:甲醇250ml冰醋酸80mlddH2O定容至1000ml。
具体操作步骤:1电泳结束后,切取少量含有MARK蛋白以及少许样品的小部分凝胶进行染色,其余部分用保鲜膜包好,放在4℃冰箱保存。
取凝胶放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶。
置于水平摇床或侧摆摇床上缓慢摇动,室温染色1小时或更长时间。
注:具体的染色时间取决于凝胶的厚度和染色时的温度。
凝胶较厚,温度较低,则染色时间宜适当延长。
凝胶较薄,温度较高,则染色时间可以适当缩短。
通常染色至凝胶的颜色和染色液的颜色非常接近,在染色液中几乎看不清凝胶时,可以认为已染色充分。
染色2-4个小时或更长时间不会对最终的染色效果产生负面影响。
2 倒出染色液。
染色液可以回收重复使用至少2-3次。
3 加入适量考马斯亮蓝染色脱色液,确保脱色液可以充分覆盖凝胶。
置于水平摇床或侧摆摇床上缓慢摇动,室温脱色4-24小时。
期间更换脱色液2-4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。
通常蛋白条带在脱色1-2小时后即可出现。
注:脱色期间可以在脱色液中加入一片吸水纸,可以使部分染料吸附在吸水纸上,加快脱色。
脱色时间过长也会导致蛋白条带的颜色变浅。
4 完成脱色后,用ddH2O浸泡,至于未染色凝胶长度相等时,参照MARK蛋白,与未染色凝胶对比,切下所需蛋白成分的凝胶,收集起来。
然后把所要提纯的蛋白从凝胶中分离出来。

考马斯亮蓝染色液(常规法)的详细信息考马斯亮蓝染色液(常规法)规格:250ml500ml公司提取试剂盒不同样本提取DNA一次时间:15-30min, 并且可以适用于配备仪器大批量提取使用。
同系列产品:大鼠可溶性CD30配体(sCD30L)ELISA试剂盒大鼠可溶性CD40配体(sCD40L)ELISA试剂盒大鼠干细胞因子受体(SCFR)ELISA试剂盒大鼠基质细胞衍生因子1β(SDF-1β/CXCL12)ELISA试剂盒考马斯亮蓝染色液(常规法)大鼠血管生成素受体Tie1(ANG-R-Tie1)ELISA试剂盒大鼠含免疫球蛋白样环和上皮生长因子样域酪氨酸激酶2(Tie-2)ELISA试剂盒大鼠基质金属蛋白酶抑制因子2(TIMP-2)ELISA试剂盒许多因素都能够影响质粒的产量,包括细菌培养液的体积,质粒的拷贝数,培养基的种类及所使用的菌株。
纯化的质粒不需后续处理即可用于DNA的各种分子生物学操作,但若用于体外转录实验,还需配合核糖考马斯亮蓝染色液(常规法)核酸酶抑制剂的使用。
溶液II-NaOH-SDS液:NaOH:核酸在pH大于5,小于9的溶液中,是稳定的。
但当pH>12或pH<3时,就会引起双链之间氢键的解离而变性。
在溶液II中的NaOH浓度为0.2mo1/L,加抽提液时,该系统的pH 就高达12.6,因而促使染色体DNA 与质粒DNA 的变性。
SDS:SDS是离子型表面活性剂。
它主要功能有:(1)溶解细胞膜上的脂质与蛋白,因而溶解膜蛋白而破坏细胞膜。
(2)解聚细胞中的核蛋白。
(3)SDS能与蛋白质结合成为R-O-SO3-…R+-蛋白质的复合物,使蛋白质变性而沉淀下来。
但是SDS能抑制核糖核酸酶的作用,所以在以后的提取过程中,必须把它去除干净,防止在下一步操作中(用RNase去除RNA 时)受到干扰。
DNA 溶液是DNA 以水合状态稳定存在,当加入乙醇时,乙醇会夺去DNA 周围的水分子,使DNA 失水而易于聚合。

考马斯亮蓝蛋白胶快速染色液使用说明货号:P1300规格:500ml组成:溶液A10ml、溶液B500ml保存:2-8℃保存,1年有效。
产品简介:考马斯亮蓝蛋白胶快速染色液是一种即用型快速灵敏而且安全的染液,以考马斯亮蓝G-250为染料,可用于SDS-PAGE或者非变性电泳蛋白凝胶的快速染色,染色时间短,半小时内即可检测到蛋白电泳条带。
使用方法:工作液的配制,取100ml溶液B,加入2ml溶液A,混匀,此为工作液。
此工作液配好后请在一周内使用完,过期效果会有一定的影响。
1.将电泳后的PAGE胶(以8cm×10cm大小为例)取下放入容器中,加入50ml双蒸水或去离子水,加热至沸腾后停止,(可选:继续在脱色摇床上摇动5分钟),弃去水溶液。
2.加入25ml快速染色工作液,加热至沸腾后保持沸腾状态30-60秒,停止加热后继续在脱色摇床上摇动5-10分钟,弃去染色液(此时蛋白条带应已可见)。
3.加入约50ml水,加热至沸腾后保持沸腾状态30-60秒,停止加热后继续在脱色摇床上摇动5-10分钟,换水即可完成脱色,观察结果。
注意事项:1.染色前的清洗步骤(第一步)中,水的质量非常重要,质量越好灵敏度越高,研究证明若用自来水加热清洗,染色效果与灵敏度仅与常规甲醇考马斯亮蓝染色(分子克隆第二版)相同。
2.脱色时可用自来水清洗。
3.若要得到无背景的染色胶,可重复脱色步骤或将胶放在水中过夜。
4.经本产品染色的PAGE胶,胶的缩涨度小于5%,染色后的胶可在水中放置数月而无明显脱色。
5.每次加热后,继续在脱色摇床上摇动5分钟,可增强染色效果。
6.本染色液有轻微腐蚀性,请带手套操作。
相关试剂:P10154×蛋白上样缓冲液(含DTT)P1305考马斯亮蓝染色套装(染色液+脱色液)A101030%丙烯酰胺(29:1)T10705×Tris-甘氨酸电泳缓冲液SP1060SDS-PAGE凝胶制备试剂盒P001210×丽春红染色液。

考马斯亮蓝R-250及G-250染料考马斯亮兰G-250;名称:考马斯亮兰G-250 别名:考马斯亮兰G250,酸性蓝90,考马斯亮蓝G,康美赛蓝G-250,亮蓝G英文:COOMASSIE BRILLIANT BLUE G-250CAS:6104-58-1相对分子量:854.04分子结构:性状:暗蓝-紫-棕色结晶粉末。
水中溶解度:40 g/L (20℃),溶于甲醇、乙醇;介绍及用途:考马斯亮兰G-250用于凝胶电泳和蛋白质染色。
不用渗透到胶里就比萘酚蓝黑B1(Naphthol Blue Black B1)灵敏度高3倍,简单而又灵敏;可以进行各种蛋白检测,和劳里反应相牵连的化学物质和游离氨基酸对此蛋白染色检测无任何影响。
也是P2X7嘌呤能受体激动剂。
考马斯亮兰法(Bradford法)测定蛋白浓度(一)实验原理双缩脲法(Biuret法)和Folin―酚试剂法(Lowry法)的明显缺点和许多限制,促使科学家们去寻找更好的蛋白质溶液测定的方法。
1976年由Bradford建立的考马斯亮兰法(Bradford法),是根据蛋白质与染料相结合的原理设计的。
这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。
这一方法是目前灵敏度最高的蛋白质测定法。
考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置(lmax),由465nm变为595nm,溶液的颜色也由棕黑色变为兰色。
经研究认为,染料主要是与蛋白质中碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。
在595nm下测定的吸光度值A595,与蛋白质浓度成正比。
Bradford法的突出优点是:(1)灵敏度高,据估计比Lowry法约高四倍,其最低蛋白质检测量可达1mg。
这是因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高的消光系数,因而光吸收值随蛋白质浓度的变化比Lowry法要大的多。
(2)测定快速、简便,只需加一种试剂。

考马斯亮蓝G250染液的配制
1R250。
2100mg考马斯亮蓝G-250,溶于50mL 90%乙醇中,加入85%的磷酸100mL,最后用蒸馏水定容到1000mL。
此溶液在常温下可放置一个月。
310mg G-250,溶于5mL的95%乙醇中,此时溶液为蓝色,再加入了10mL的85%的磷酸,溶液为血红色,可是加水定容到100mL时又成为了蓝色,据文献说应该是褐色,原因:配置溶液的容器未洗干净,可能沾有蛋白质类药品。
用乙醇把容器全部认真的洗干净后重配,不过配好之后需要过滤才可以用。
4中文名为考马斯亮蓝G250,简称G250,分子式为C47H48N3O7S2Na,分子量为854.02,分析纯。
考马斯亮蓝G250是常用蛋白染色剂,在游离状态下呈红色,当它与蛋白质结合后变为青色。
蛋白质含量在0~1000μg范围内,蛋白质一色素结合物在595nm下的吸光度与蛋白质含量成正比,故可用比色法测定。
5中文名为考马斯亮蓝R250,简称R250,分子式为C45H44N3O7S2Na,分子量为825.97,考马斯亮蓝R250是常用蛋白染色剂,可用于染色丙烯酰氨凝胶和琼脂糖凝胶中的蛋白质。
6、考马斯亮蓝G250和R250都可以作为染色剂,不同的配方、不同的染色方法适合于不同性质的蛋白质。
7、考马斯亮蓝分为G250、R250和R350等,R为红蓝色,G为蓝绿色。
例如考马斯亮蓝G250即二甲花青亮蓝。
考马斯亮蓝染色法测定蛋白质的含量
原理:考马斯亮蓝G-250与蛋白质结合后,染料的最大吸收从465nm变为596nm,蛋白质-染料复合物具有很高的消光系数,因此蛋白质测定的灵敏度较高,最低检出量为1ug蛋白质.染料与蛋白质的结合,大约只需2min,结合物的颜色在1h内是稳定的.一些阳离子乙醇等物质不干扰测定,但去污剂严重干扰测定,少量的去污剂可通过用适当的对照而消除,犹豫染色法简单迅速,干扰物质少,灵敏度高,现已广泛用于蛋白质含量的测定.
试剂:○1标准蛋白质溶液:可用牛血清清蛋白。
或根据牛血清清蛋白的紫外消光系数来确定
○2蛋白染色剂的配置:取100mg考马斯亮蓝G-250溶于50ml95%愚蠢,假如100ml85%磷酸,将溶液用水稀释到1000ml。
试剂的终浓度为0.01%考马斯亮蓝G-250,4.7%乙醇和8.5%磷酸
操作:1.标准曲线的绘制
(1)取7支试管,分别假如0.4ml,0.6ml,0.8ml,1.0ml,1.2ml,
1.4ml,1.6ml标准蛋白质溶液,用水不足到2ml
(2)去8支试管,0号加入0.1ml蒸馏水,1~7号试管一次加入0.1ml步骤(1)的标准蛋白质稀释液,然后各加入5ml
蛋白染色剂,充分振荡混合,2min后于595nm测定光吸收
值。
以蛋白质浓度为横坐标,光吸收值为纵坐标,绘制标
准曲线作为定量的依据。
2.样品的测定
去样品溶液0.1ml,用制定标准曲线的方法测595nm光吸度,用标准曲线计算蛋白质的含量。
实验结果
测定所用的标准曲线方程为:v=0.1296x+0.0907。
考马斯亮蓝G-250法测量蛋白质含量与凯氏定氮法相比较误差范围3%~8%。
可溶性蛋白含量测定(考马斯亮蓝染色法)
1.试剂配制
(1)考马斯亮蓝溶液配制:称取100 mg考马斯亮蓝,溶于50ml 90%乙醇中,加入100ml 85%(W/V)磷酸,再用蒸馏水定容到1L。
贮于棕色瓶中,常温下可保存一个月。
90% 乙醇配制:95%乙醇和75%乙醇按3:1体积比混合配制,即95%乙醇37.5ml,75%乙醇12.5ml或取45ml无水乙醇直接定容至50ml。
(2)100 μg/ml牛血清蛋白(BSA)标准溶液:称取10mg BSA,用质量分数为0.9%的氯化钠溶解,并定容至100 ml即为100 μg/ml。
2. 标准曲线绘制
取6支具塞试管,按下表加入试剂,摇匀,向各管中加入5ml考马斯亮蓝试剂,5min 左右,以0号试管为空白对照,在595nm下比色测定吸光度,以蛋白质含量为横坐标,以吸光度为纵坐标绘制标准曲线。
3. 样品测定
(1)样品提取:取鲜样2g,加2ml蒸馏水研磨成匀浆后,移到离心管中,然后用6ml蒸馏水分次洗涤研钵,完全转移至离心管后,放置0.5-1小时以充分提取,然后4000r/min离心20min,弃去沉淀,上清液转移至容量瓶,以蒸馏水定容至10ml,待测。
(2)吸取样品提取液 1.0ml(视蛋白质含量适当稀释),放入带塞试管中(每个样品重复两次),加入5ml考马斯亮蓝试剂,摇匀,放置2min待反应完成,在595nm下比色,测定吸光度,并通过标准曲线查蛋白质含量。
4. 蛋白质含量计算
可溶性蛋白含量(mg/g)=(C·V T)/(1000V S·W F)
C—查标准曲线值,μg;
V T—提取液总体积,ml;
W F—样品鲜重,g;
V S—测定时加样量,ml。
考马斯亮蓝染色及丽春红染色操作规程附录7:考马斯亮蓝染色及丽春红染色操作规程
1. 考马斯亮蓝染色
1.1 染色液配制
醋酸脱色液。
5%(V/V)甲醇,7%(V/V)醋酸,88%HO。
2
固定液。
50%(V/V)甲醇,10%(V/V)冰醋酸,40%HO。
2
考马斯亮蓝染液。
50%(V/V)甲醇,0.05%(V/V)考马斯亮蓝,10%(V/V)冰醋酸,40%HO。
2
1.2.实验步骤
将胶条置于固定液中,摇床固定1 h;? 倒掉固定液,加考马斯亮蓝染液染色2 h;?去离子水漂洗1-2次,脱色液漂洗1次;? 脱色液中脱色1 h,最后置于去离子水中。
2. 丽春红染色
2.1. 染色液配制
10×丽春红染液
丽春红S 2g
三氯乙酸 30g
磺基水杨酸 30g
加蒸馏水至 100ml。
使用时将其稀释10倍,即为应用液。
2.2. 实验步骤转膜完成后,取出膜在甲醇里泡1分钟;?将膜于双蒸水中漂洗数次后,浸入丽春红染液着色;? 室温下,于摇床上轻摇5-30 min;? 将染好的膜置于双蒸水中漂洗数次,不要洗的太久,只需把表面的丽春红洗掉即可,此时可看到红色的蛋白条带。
常规考马斯亮蓝染色液
简介:
考马斯亮蓝染色液(Commassie Blue Staining Solution)是以考马斯亮蓝R250为染料可用于SDS-PAGE 或非变性PAGE 等蛋白电泳胶的常规染色或Western 转膜后PAGE 胶上残余蛋白的检测。
采用常规染色方法需至少1h ,采用快速染色方法一般数分钟即可。
本染色液经过改良,不含有毒的甲醇,但含有刺激性气味的乙酸。
组成:
操作步骤(仅供参考):
(一)常规染色脱色方法
1、PAGE 电泳结束后取凝胶放入适量考马斯亮蓝染色液中,确保染色液可以充分覆盖凝胶。
2、置于水平摇床或侧摆摇床上缓慢摇动,室温染色1小时或更长时间。
具体的染色时间取决于凝胶的厚度和染色时的温度。
凝胶较厚,温度较低,则染色时间宜适当延长。
凝胶较薄,温度较高,则染色时间可以适当缩短。
通常染色至凝胶的颜色和染色液的颜色非常接近,在染色液中几乎看不清凝胶时,可以认为已染色充分。
染色小时或更长时间不会对最终的染色效果产生负面影响。
3、倒出染色液。
染色液可以回收重复使用次。
4、加入适量脱色液,确保脱色液可以充分覆盖凝胶。
Leagene 推荐脱色液的配方是:40%乙醇,10%乙酸,50%蒸馏水。
5、置于水平摇床或侧摆摇床上缓慢摇动,室温脱色。
期间更换脱色液2~4次,直至蓝色背景基本上全部被脱去,并且蛋白条带染色效果达到预期。
通常蛋白条带在脱色1~2h 后即可出现。
6、完成脱色后把凝胶保存在水中,用于后续的拍照等。
保存在水中的凝胶会发生溶涨。
如需避免溶涨,可以把胶保存在含20%甘油水溶液中,长期保存可以制备干胶。
(二)快速染色脱色方法
1、PAGE 电泳结束后取胶放入适量考马斯亮蓝染色液中,微波炉加热至接近沸腾或刚刚沸腾,立即停止加热。
2、随后在染色液温度较高的情况下,在室温摇床上摇动。
3、倒出染色液。
染色液可以回收重复使用2~3次。
编号 名称 PT0018 PT0018 Storage Commassie Blue Staining Solution 100ml 500ml RT 使用说明书 1份
4、加入适量脱色液,确保染色液可以充分覆盖凝胶。
5、微波炉加热至接近沸腾或刚刚沸腾,立即停止加热。
6、随后在脱色液温度较高的情况下,在摇床上摇动。
此时通常可以观察到比较清楚的蛋白条带。
8、完成脱色后,把凝胶保存在水中,用于后续的拍照等。
保存在水中的凝胶会发生溶涨。
如需避免溶涨,可以把胶保存在含20%甘油水溶液中,长期保存可以制备干胶。
注意事项:
1、染色时,如果把凝胶和染色液一起放置在微波炉中适当加热,可以大大加快染色速度。
但加热时宜尽量避免沸腾,以免出现因暴沸而导致的凝胶碎裂。
2、脱色期间可以在脱色液中加入一片吸水纸,可以使部分染料吸附在吸水纸上,加快脱色。
脱色时间过长也会导致蛋白条带的颜色变浅。
3、如果希望染色的背景更低,希望获得更加清晰的蛋白条带,可以加入适量的室温蒸馏水进行洗涤。
通过蒸馏水洗涤可以进一步降低背景。
4、常规染色脱色方法耗时较长,但检测灵敏度更高,染色效果更加稳定
5、为了您的安全和健康,请穿实验服并戴一次性手套操作。