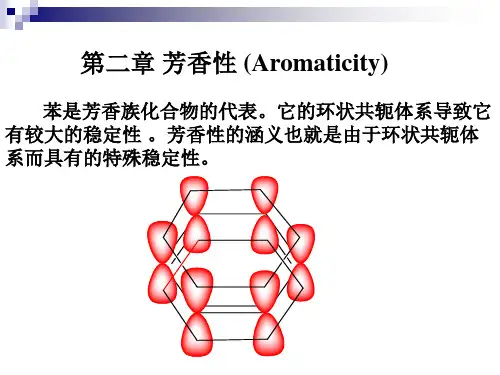
芳香性及其判据摘要以及莫比乌斯芳香性
- 格式:ppt
- 大小:121.00 KB
- 文档页数:8



有机化学基础知识点整理芳香性和芳香化合物的性质芳香性和芳香化合物的性质有机化学是化学领域中的一个重要分支,研究有机物的结构、性质和合成方法等。
芳香性和芳香化合物是有机化学中的重要概念和研究内容之一。
本文将对芳香性和芳香化合物的基础知识点进行整理。
一、芳香性的概念芳香性是指含有芳香环结构的化合物所特有的性质或现象。
它是由芳香环中的π电子云形成的高度共轭体系所决定的。
具备芳香环结构的化合物表现出一系列独特的性质,包括稳定性高、反应活性低、呈现特殊的气味等。
二、芳香性的规则和条件1. 符合Hückel规则Hückel规则是判断一个化合物是否具备芳香性的一个重要准则。
根据Hückel规则,一个环状分子具备芳香性必须满足:- 分子是平面的;- 分子中含有 4n+2 个π电子,其中 n 是非负整数。
2. 产生高度共轭体系芳香性是由共轭体系中的π电子云形成的,因此产生芳香性的分子通常具有大范围的共轭结构。
对于苯环来说,由于其电子云在整个环上共轭,因此苯是最简单的芳香化合物。
3. 具备极性芳香化合物中的芳香环带有电负性较大的原子团,如氧、氮等,因此具备一定的极性。
然而,芳香化合物整体上常表现出较弱的极性,主要由于π电子在环上的扩散。
三、芳香化合物的性质1. 化学稳定性芳香化合物的共轭结构使其更加稳定。
对于具有芳香性的化合物,由于能量更低,其化学稳定性也相对较高。
这也是为什么芳香化合物常用作药物、染料和香料等方面的原料。
2. 同位素标记由于芳香化合物的稳定性,可以通过同位素标记来追踪其在化学反应中的转化过程。
同位素标记技术在有机化学的研究和应用中扮演着重要的角色,有助于揭示化学反应的机理和动力学。
3. 气味和香味芳香化合物常常具有独特的气味和香味,广泛应用于香水、香料和食品添加剂等方面。
因为芳香化合物形成的芳香环结构能够与嗅觉受体结合,产生特殊的感官效应。
4. 光谱特性芳香化合物在红外光谱、紫外光谱和核磁共振光谱等光谱中表现出特殊的峰值和吸收特性,这对于准确鉴定和表征芳香化合物具有重要意义。


有机化学中的芳香性与反芳香性有机化学是研究有机化合物的合成、性质和结构的学科。
其中,芳香性和反芳香性是有机化学中常见的概念。
本文将讨论芳香性与反芳香性的定义、特征以及其在化学反应和有机合成中的应用。
一、芳香性的定义和特征芳香性最早是由德国化学家奥古斯特·考库勒于1825年提出的。
它是指一类分子具有稳定的环状结构,并且在化学反应中表现出与它们的结构有关的稳定性、活性和特殊性质。
具有芳香性的分子通常由苯环(C6H6)或类似结构组成,其中每个碳原子都与一个氢原子相连,并且有共轭的π电子体系。
这种π电子体系的存在使得芳香性分子具有以下特征:1. 稳定性:芳香性分子相对稳定,不容易发生化学反应,尤其是加成反应。
2. 共轭系统:具有芳香性的分子的π电子呈现共轭结构,形成共轭系统。
这种共轭能够提高分子的稳定性。
3. 共平面性:芳香性分子中的原子排列通常呈平面结构,由于π电子的共轭作用,这种平面结构也增强了分子的稳定性。
4. 可遵守6π电子规则:具有芳香性的分子必须满足Hückel的4n+2(n为整数)规则,即共轭体系中π电子的数目必须为6的倍数加2。
二、反芳香性的定义和特征反芳香性是与芳香性相对应的概念。
反芳香性分子也有稳定的环状结构,但其具有与芳香性相反的特征。
反芳香性分子通常由四个或更多的π电子构成的环状结构组成。
与芳香性相比,反芳香性分子有以下特征:1. 不稳定性:反芳香性分子相对不稳定,容易参与化学反应,并且往往表现出高反应活性。
2. 不遵守6π电子规则:与芳香性分子不同,反芳香性分子不遵守Hückel的4n+2规则,其π电子的数量不是6的倍数加2,而是4n(n为整数)。
3. 反共轭系统:反芳香性分子的π电子体系呈现反共轭结构,不同于芳香性分子中的共轭结构。
4. 异常活性:由于反芳香性分子的不稳定性,容易发生环扩张、开环反应等化学反应。
三、芳香性与反芳香性的应用芳香性和反芳香性不仅仅是有机化学的基础概念,还在各种化学反应和有机合成中发挥着重要作用。


芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把 n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π电子数的计算也许你在做题目的时候对于π电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性. 两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,http://206.108.48.51/forumdisplay.php?fid=63。


芳香性判断13144233周楠乳品2班摘要 :探讨了几类环状化合物“芳香性”的判断方法 ,阐述了解决这类问题的基本思路.关键词:环状化合物 ;芳香性 ;判断方法。
正文:关于“芳香性”的早期定义是考虑动力学稳定性 ,即化合物的取代反应比加成反应更容易发生. 后来定义则依靠化学的稳定性 ,以共振能的大小来量度. 最近的定义提供用光谱及核磁的标准 ,磁有向性在平面π电子体系中能受感应 ,并可用质子磁共振 (Pmr)光谱中位移到较低的场来检定或借反磁性的灵敏度上升的测定 ,π电子流也产生电子光谱 ,和简单的共轭烯类所显示的光谱有重大的不同.关于“芳香性”的另一种物理标准 ,为整个芳香体系具有相同键长和共平面的特性 ,这种分析需要 X光结晶学、微波光谱或电子衍射技术。
一.关于芳香性概念芳香性是化学中使用频率最高且最重要的概念之一。
“芳香性”研究真正始于1825年,因为当年Michael Faraday 成功分离出具有特殊芳香气味的苯。
此后人们把具有类似气味的化合物统称为芳香化合物。
最初芳香性内涵特指像苯及其衍生物之类的有机分子的化学反应性质的总称,认为芳香分子,如苯、萘、蒽,是平面环状的、共轭的、含有4n+2个π电子,并且具有容易进行亲电取代反应,但不易发生加成、氧化等特殊的化学性质。
然而环丁二烯和环辛四烯化学性质活泼,分别具有4、8个π电子,则具有反芳香性。
容易看出,早期芳香性定义实际上是一个特别强调化学反应性能的“化学定义”。
随着研究的深入,当前芳香化合物已经先后扩展到杂原子分子、有机金属、全金属化合物。
在范畴上,已经成功地实现了从有机物到无机物、由非金属化合物到全金属化合物的过渡;在几何结构上,也从最初的二维平面分子延展到准平面分子,甚至三维封闭式笼状分子;类型上,由早期单纯的π型芳香性扩展到σ芳香性甚至δ芳香性。
二.常见芳香性判据及讨论芳香性的判据和定义是密切相关的。
所谓判据就是判断是否具有芳香性的依据或标准。

Hückel规则(休克尔规则)是有机化学的经验规则,它指当闭合环状平面型的共轭多烯(轮烯)π电子数为(4n+2)时(其中n为0或者正整数),具有芳香性。
从凯库勒(Kekule)提出苯的环状结构,并发现苯和类苯化合物有特殊性质(芳性)以来,人们对芳性及其和结构之间的关系的研究也逐步深入,到1931年休克尔用其简单的分子轨道法计算了单环多烯的π电子能级,提出了4n+2规则;称为休克尔规则。
随着微扰分子轨道理论的建立和发展,使得休克尔规则的理论根据更加充分。
休克尔规则表明,对完全共轭的、单环的、平面多烯来说,具有(4n+2)个π电子(这里n是大于或等于零的整数)的分子,可能具有特殊芳香稳定性。
随着磁共振实验方法的出现,对决定一化合物是否具有芳香性起了重要的作用,并对芳香性的本质有了进一步的了解。
因此芳香性更广泛的含义为:分子必须是共平面的封闭共轭体系;键发生了平均化;体系较稳定(有较大的共振能);从实验看,易发生环上的亲电取代反应,不易发生加成反应;在磁场中,能产生感磁环流;从微观上看,π电子数符合4n+2规则。
规则作用1.特点分子的分析从休克尔规则我们可以得知,具有芳香性的通常是具有如下四个特点的分子:(1)它们是包括若干数目π键的环状体系(π电子总数必须等于4n+2,其中n为自然整数(注意n不是指环碳原子数));(2)它们具有平面结构,或至少非常接近平面(平面扭转不大于0.1nm);(3)环上的每一个原子必须是sp 2杂化(某些情况也可以是sp杂化);(4)环上的π电子能够发生离域。
2.分子具有芳香性的标志分子具有芳香性的标志是:(1)这类化合物虽有不饱和键,但不易进行加成反应,而与苯相似,容易进行亲电取代;(2)通过氢化热或燃烧热对离域能的热化学测量表明,这类具有芳香性的环状分子比相应的非环体系具有低的氢化热低的燃烧热,而显示特殊的稳定性。
(3)用物理方法和核磁共振谱进行测定,这类化合物的质子与苯及其衍生物的质子一样,显示类似的化学位。
有机化学论文——芳香性判断学院:专业:学号:13032424姓名:李秋2014年11 月8 日芳香性的判断13032424 李秋摘要:学习有机化学,我们经常会碰到“芳香性”这一概念,如何确定一个化合物是否有“芳香性”呢?关键词:共轭能、高C/H比、分子共平面性、键长趋于平均化、轮烯、π电子数、Hückel -Platt 规则一、芳香性的概念:芳香性是一种物理化学性质,即:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定,在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应的物理化学性质。
在有芳香性的分子中,由不饱和键、孤对电子和空轨道组成的共轭系统具有特别的、仅考虑共轭时无法解释的稳定作用。
可以将芳香性看作是环状离域和环共振的体现。
一般认为在这些体系中的电子,可以自由在由原子组成的环形结构上运动(离域),这些环形结构含有单键和双键相间,离域的结果是环键的键级趋于均化,给予体系稳定作用。
二、芳香性具备的一些特点:1. 较高的C/H 比芳香性化合物多数都有较高的C/H 比,而脂肪族化合物绝大多数的C/H 比都较低。
2. 键长趋于平均化如:X-衍射测定苯的6个C—C键长相等,均为0.139nm,没有单键(0.154nm)和双键(0.134nm)之分。
3. 分子共平面性组成芳香环的原子都在一个平面或接近一个平面。
4. 化学活性不饱和化合物的特征之一就是易发生加成反应,但芳香性化合物不易发生加成反应,而倾向于发生取代反应,尤其是亲电取代反应。
5. 共轭能氢化热和燃烧热的测定表明芳香化合化合物稳定性和体系的共轭能(或称为离域能)密切相关。
如,苯的氢化热是-208.5kJ/mol ,环已烯的氢化热是-119.7kJ/mol 。
假定环已三烯为苯的定域化模型,比较1mol 苯和3mol 环已烯的氢化热,计算得苯的共轭能约为150.7kJ/mol (3×119.7-208.5 )。
一,芳香性判据——Hu ckel规则H u ckel规则:一个单环化合物只要具有平面离域体系,它的n电子数为4n+2(n=0,1,3, ••整数),就有芳香性(当n>7时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了•非苯芳烃:凡符合Huckel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等•二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n》10的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Huckei规则判断,首先看环上的碳原子是否均处于一个平面内,其次看n 电子数是否符合4n+2.[18]轮烯环上碳原子基本上在一个平面内,n电子数为4n+2(n=4),因此具有芳香性.又如[10]轮烯,n电子数符合4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性•如环戊二烯无芳香性,但形成负离子后,不仅组成环的5个碳原子在同一个平面上,且有6个n电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性•因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有10个n电子(n二2),故有芳香性环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(I),环丁二烯两价正离子(n)和两价负离子(川),环庚三烯正离子(W ).因为它们都具有平面结构,且n电子数分别位2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蔥,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且n电子数分别为10和14,符合Huckel规则,具有芳香性. 虽然萘,蔥,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Huckel规则来判断其芳香性.与萘,蔥,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围n 电子,也可用Huckel规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围n电子有10个,相当于[10]轮烯,符合Huckel规则(n=2),也具有芳香性.三• n电子数的计算也许你在做题目的时候对于n电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢•我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个n电子, 有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个n电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个n电子这种结构的也具有芳香性, 看起来这个七元环没有达到共轭结构, 我的也是经验两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算n电子数,也是 6 个. 注意: 若隔的是碳负离子就不能这样了, 一定要是碳正离子才可以这样算.这个和上面那个有点相似, 但隔的是碳负离子, 一个碳负离子算2个电子, 图中有2个碳负离子,还有3个双键,有10个n电子.图中左边, 一双键连接两个环, 可以写出它的共振体, 当然尽量往有芳香性的写, 而且芳香性的环稳定,贡献大.这样下面的五元环有6 n电子,上面的三元环有2n 电子. 都有芳香性.因为三键中两n键互相垂直,孤只有一个能与其他双键共轭,。
*作品编号:DG13485201600078972981*创作者:玫霸*一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+2(n=0,1,3,…整数),就有芳香性(当n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel 规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π电子数是否符合4n+2.[18]轮烯环上碳原子基本上在一个平面内,π电子数为4n+2(n=4),因此具有芳香性.又如[10]轮烯,π电子数符合4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的5 个碳原子在同一个平面上,且有6 个π电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有10 个π电子(n=2),故有芳香性. 环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π电子数分别为10 和14,符合Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π电子,也可用Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π电子有10 个,相当于[10]轮烯,符合Hückel 规则(n=2),也具有芳香性.三.π电子数的计算也许你在做题目的时候对于π电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性.两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,作品编号:DG13485201600078972981创作者:玫霸*。