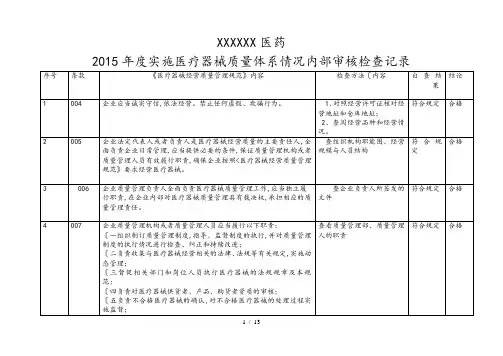
医疗器械内审记录表格
- 格式:doc
- 大小:252.00 KB
- 文档页数:46
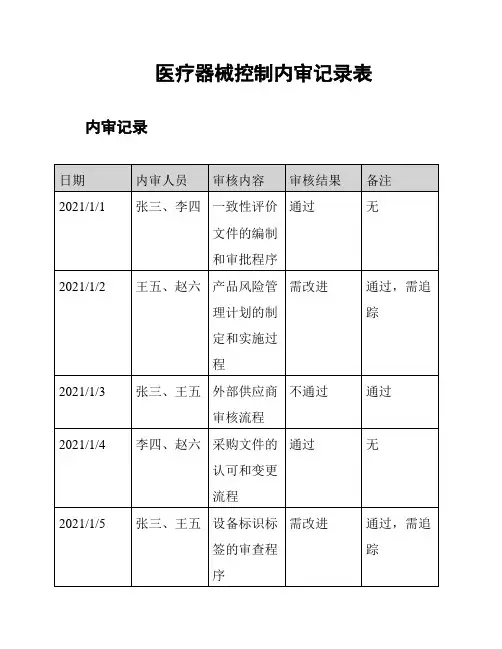
医疗器械控制内审记录表内审记录
审核结果分析
- 一致性评价文件的编制和审批程序通过了内审,符合要求。
- 产品风险管理计划的制定和实施过程需要改进,并进行追踪确认。
- 外部供应商审核流程未通过内审,需要进一步调整和改进。
- 采购文件的认可和变更流程通过了内审,符合要求。
- 设备标识标签的审查程序需要改进,并进行追踪确认。
- 不良事件处理流程通过了内审,符合要求。
- 产品召回程序通过了内审,符合要求。
备注
- 产品风险管理计划的改进进度需要及时跟进。
- 外部供应商审核流程需要进行改进,确保符合要求。
- 设备标识标签的改进进度需要及时跟进。
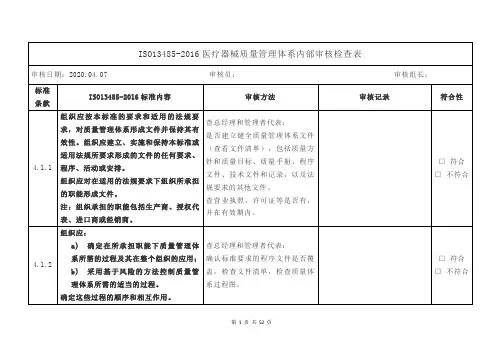
4.2. 4质量管理体系所要求的文件应予以控制。
记录是一种特殊类型的文件,应依据4.2.5的要求进行控制。
应编制形成文件的程序,以规定以下方面所需的控制:a)文件发布前得到评审和批准,以确保文件是充分的;b)必要时对文件进行评审与更新,并再次批准;c)确保文件的更改和现行修订状态得到识别d)确保在使用处可获得适用文件的有关版本;e)确保文件保持清晰、易于识别;f)确保组织所确定的策划和运行质量管理体系所需的外来文件得到识别,并控制其分发g)防止文件退化或遗失;h)防止作废文件的非预期使用,并对这些文件进行适当的标识。
组织应确保文件的更改得到原审批部门或指定的其他审批部门的评审和批准,查品管部:检查文件清单,从中抽查5份文件,核对文件的发放记录;检查文件修订的评审和批准记录;抽查5份现场使用的文件,核对其现行版本和标识;检查外来文件清单;抽查5份外来文件的最新版本(是否现行有效文件);抽查5份外来文件的发放记录和标识;抽查已经过期外来文件的保□符合□不符合7.1 产品实现产品实现的策划组织应策划和开发产品所需的过程,产品实现的策划应与质量管理体系的其他过程的要求一致在产品的实现过程中,组织应对风险管理的一个或多个过程形成文件。
应保持风险管理活动的记录(见 4.2.5)。
在对产品实现进行策划时,组织应确定以下方面的适当内容:a)产品的质量目标和要求;b)建立过程和文件(见 4.2.4)的需求,以及为特定的产品提供资源(包括基础设施和工作环境)的需求;c)特定的产品所要求的验证、确认、监视、测量、检验和试验、处理、贮存、销售和追溯活动,以及产品接收准则;d)为实现过程及其产品满足要求提供证据所需的记录(见 4.2.5).检查研发部:查看《产品实现的策划控制程序文件》,抽查一个产品的策划和开发过程;查看风险管理报告,是否符合要求;检查产品采购规范、工艺流程图、生产工艺、检验工艺、接收准则、对资源和设备的要求等。

医疗器械内审检查表XXX内部审核检查表KS/JL8.2.2-03受审核部门/场所过程要求4.2.3程序办公室部门负责人检查清单审核日期页码审核记录(不符合描述用N标记)体系文件管理有序,如:文件受控分发、收回、销毁等按规定实施。
外来文件收集到位,新法规能及时向公司各部门贯彻实施。
程序文件1.质量管理体系文件在发放前编制、审核、批准是否符合审批要求?2.是否对文件的评审、修改和更新有书面的规定?修改更新的文件是否要重新批准?3.能否提供一份受控的所有文件清单?5.作废文件的保存期限是否作了规定。
6.查作废文件记录和作废文件,是不是符合文件规定的要求。
7.受控文件是不是都加盖有红色“受控”印章?是不是有使用复印文件的现象?8.对文件领用部门和个人是不是要求其坚持清晰,不得随意涂划。
9.外来文件控制是否符合规定的要求。
程序文件1.请出示《质量记录清单》文件控制4.文件的发放是不是经过审批、文件是不是有发放号、文件领用是不是有记录。
质量记录清单及时更新,质量记录的保存期限与文件规定相符。
2.记录是不是有涂改和点窜现象,点窜是不是符合程序的要求。
4.2.43.质量记录的保存是否有适宜的贮存方法和贮存环境。
记录控制4.质量记录的检索是不是轻易?是不是编制了记录的检索目录?当有需要借阅或检索某些程序记录时,是不是在很短工夫内即可查到所需要的记录?5.质量记录的保存期限是否符合文件规定的要求?6.记录的销毁是否符合要求。
7.外来记录的控制是不是符合要求。
质量手册1.请谈谈公司的质量方针是什么?5.32.公司的质量目标是什么?能准确回答质量方针。
制定有质量目标,也进行了统计、分析。
质量方针3.是否建立了本部门的质量目标,目标是否可测量?如何评审质量目标是否达到要5.4.1求?质量目标露台县康生医疗器械内部审核检查表KS/JL8.2.2-03受考核部门/场所过程要求5.5.1限办公室部门负责人检查清单审核日期页码考核记录(不符合描述用N标记)制订有部门职责及部门负责人的岗位职责质量手册1.本部门共有多少人?如何分工?2.你部门在公司的质量管理体系中主要负责哪些过程的控制?4.查看组织机构图、部门职责要求、岗位人员任命等文件确认是不是符合要求。
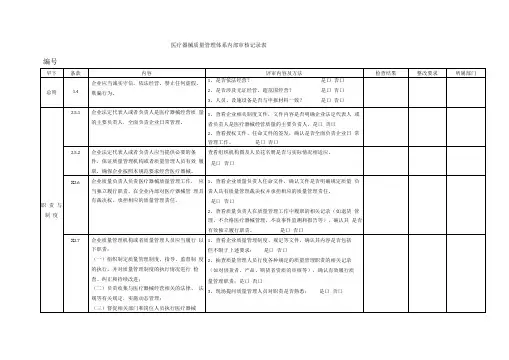
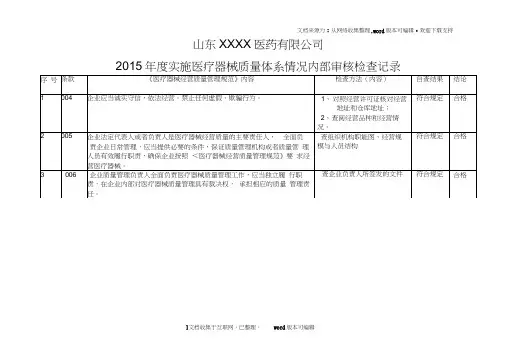

xxxx公司医疗器械内审记录第一章:总则
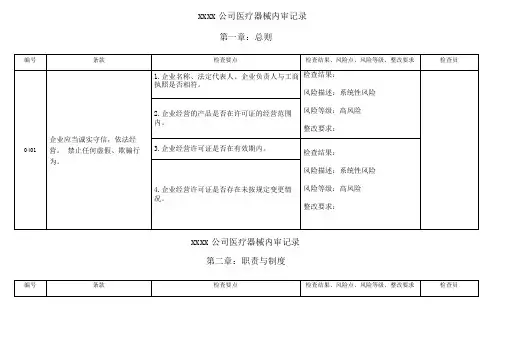
xxxx公司医疗器械内审记录第二章:职责与制度
第二章:职责与制度
xxxx公司医疗器械内审记录第二章:职责与制度
第二章:职责与制度
第二章:职责与制度
第二章:职责与制度
第二章:职责与制度
第二章:职责与制度
xxxx公司医疗器械内申记录第二章:职责与制度
第二章:职责与制度
0901
xxxx公司医疗器械内审记录第三章:人员与培训
第三章:人员与培训
第四章:设施与设备
第四章:设施与设备
第四章:设施与设备
xxxx公司医疗器械内申记录第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
第四章:设施与设备
第四章:设施与设备
第五章:采购、收货与验收
第五章:采购、收货与验收
第五章:采购、收货与验收
第六章:入库、储存与检查
第六章:入库、储存与检查
xxxx公司医疗器械内申记录第六章:入库、储存与检查
第七章:销售、出库与运输
第七章:销售、出库与运输
xxxx公司医疗器械内申记录第七章:销售、出库与运输
第八章:售后服务
第八章:售后服务
6401。
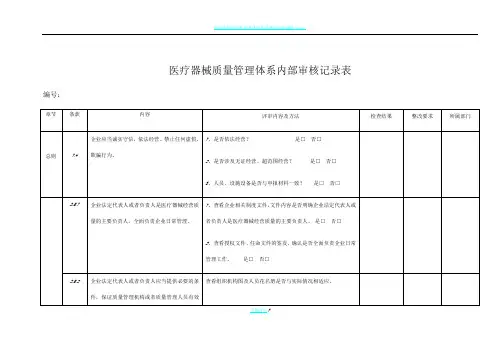
医疗器械质量管理体系内部审核记录表编号:页脚内容1页脚内容2医疗器械质量管理体系内部审核记录表编号:页脚内容3页脚内容4页脚内容5医疗器械质量管理体系内部审核记录表编号:页脚内容6页脚内容7页脚内容8医疗器械质量管理体系内部审核记录表编号:页脚内容9页脚内容10页脚内容11医疗器械质量管理体系内部审核记录表编号:页脚内容12页脚内容13医疗器械质量管理体系内部审核记录表编号:页脚内容14页脚内容15医疗器械质量管理体系内部审核记录表编号:页脚内容16页脚内容17医疗器械质量管理体系内部审核记录表编号:页脚内容18页脚内容19医疗器械质量管理体系内部审核记录表编号:页脚内容20页脚内容21医疗器械质量管理体系内部审核记录表编号:页脚内容22页脚内容23页脚内容24医疗器械质量管理体系内部审核记录表编号:页脚内容25页脚内容26页脚内容27医疗器械质量管理体系内部审核记录表编号:页脚内容28页脚内容29页脚内容30医疗器械质量管理体系内部审核记录表编号:页脚内容31医疗器械质量管理体系内部审核记录表编号:页脚内容32页脚内容33医疗器械质量管理体系内部审核记录表编号:页脚内容34页脚内容35医疗器械质量管理体系内部审核记录表编号:页脚内容36页脚内容37医疗器械质量管理体系内部审核记录表页脚内容38编号:页脚内容39页脚内容40医疗器械质量管理体系内部审核记录表编号:页脚内容41页脚内容42医疗器械质量管理体系内部审核记录表编号:页脚内容43页脚内容44医疗器械质量管理体系内部审核记录表编号:页脚内容45页脚内容46页脚内容47。

内部审核记录内审记录全套(通过FDA、NMPA、CE的审批)含以下内审记录1.首次会议签到表2.内审检查计划表3.各部门内审检查表4.末次会议签到表5.内审总结报告会议签到表表单编号:XXX 版本:XXXX内审检查计划编号:XXXXX901编制: 批准:表单编号:XXX011 版次:A/1内部审核检查表审核日期: 2019年10月19日审核部门: 采购部审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期: 2019年10月17日审核部门: 仓储部审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期:2019年10月16日审核部门: 工程部内部审核检查表审核日期: 2019年10月18日审核部门: 管代&总经理审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期:2019年10月19日审核部门: 行政部审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期:2019年10月18日审核部门: 品质部(法规)审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期:2019年10月17日审核部门: 品质部审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期: 2019年10月19日审核部门: 销售部审核员(签名): 被审查部门负责人(签名):内部审核检查表审核日期:2019年10月18日审核部门: 生产部审核员(签名): 被审查部门负责人(签名):会议签到表内部审核总结报告日期: 2019年 10月22日编号:XXXX201一.审核的目的:通过内部审核,检查质量体系是否有效运行,是否符合ISO 13485:2016、QSR820以及中国GMP,以及相关的法律法规要求。
通过审核,找出体系存在的问题点,进行分析与改善,不断对我司的质量管理体系进行完善。
二.审核范围:除财务以外的所有部门所有的质量管理过程三.审核过程简述:在审核中各个部门都主动地进行了配合,并积极参与审核,关心不合格项及后续的改善方案。
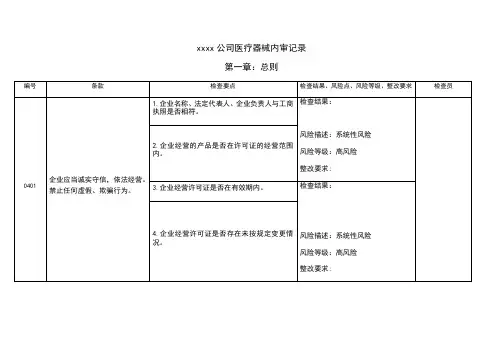
xxxx公司医疗器械内审记录第一章:总则.1.2xxxx公司医疗器械内审记录第二章:职责与制度.3.4.5xxxx公司医疗器械内审记录第二章:职责与制度.6.7.8xxxx公司医疗器械内审记录第二章:职责与制度.9.10.11xxxx公司医疗器械内审记录第二章:职责与制度.12.13xxxx公司医疗器械内审记录第二章:职责与制度.14.15.16xxxx公司医疗器械内审记录第二章:职责与制度.17.18xxxx公司医疗器械内审记录第二章:职责与制度.20.21xxxx公司医疗器械内审记录第二章:职责与制度.23.24.25xxxx公司医疗器械内审记录第二章:职责与制度.26.27.28xxxx公司医疗器械内审记录第二章:职责与制度.29xxxx公司医疗器械内审记录第三章:人员与培训.31.32.33xxxx公司医疗器械内审记录第三章:人员与培训.34.35.36xxxx公司医疗器械内审记录第四章:设施与设备.37.38.39xxxx公司医疗器械内审记录第四章:设施与设备.40.41.42xxxx公司医疗器械内审记录第四章:设施与设备.43.44xxxx公司医疗器械内审记录第四章:设施与设备.45.46.47xxxx公司医疗器械内审记录第四章:设施与设备.48.49.50。
xxxx公司医疗器械内审记录
第一章:总则
xxxx公司医疗器械内审记录第二章:职责与制度
第二章:职责与制度
xxxx公司医疗器械内审记录第二章:职责与制度
xxxx公司医疗器械内审记录第二章:职责与制度
第二章:职责与制度
第二章:职责与制度
第二章:职责与制度
xxxx公司医疗器械内审记录第二章:职责与制度
第二章:职责与制度
xxxx公司医疗器械内审记录第二章:职责与制度
xxxx公司医疗器械内审记录第三章:人员与培训
xxxx公司医疗器械内审记录第三章:人员与培训
第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
xxxx公司医疗器械内审记录第四章:设施与设备
xxxx公司医疗器械内审记录第五章:采购、收货与验收
xxxx公司医疗器械内审记录第五章:采购、收货与验收
xxxx公司医疗器械内审记录第五章:采购、收货与验收
第六章:入库、储存与检查
xxxx公司医疗器械内审记录第六章:入库、储存与检查
第六章:入库、储存与检查
xxxx公司医疗器械内审记录第七章:销售、出库与运输
xxxx公司医疗器械内审记录第七章:销售、出库与运输
xxxx公司医疗器械内审记录第七章:销售、出库与运输
xxxx公司医疗器械内审记录第八章:售后服务
第八章:售后服务。