高考化学大一轮复习讲义(研考点认知层层递进 析考题能力步步提高,含详细考点)无机非金属材料的主角硅
- 格式:doc
- 大小:464.50 KB
- 文档页数:20

高考化学大一轮复习讲义(研考点认知层层递进析考题能力步步提高含详细考点)认识有机化合物导航能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
了解常见有机化合物的结构,了解有机物分子中的官能团,能正确表示它们的结构。
了解测定有机化合物结构的化学方法和某些物理方法。
了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体(不包括手性异构体)。
能根据有机化合物命名规则命名简单的有机化合物。
考点一有机化合物的分类及官能团1、按碳的骨架分类2、按官能团分类(1)官能团:决定化合物特殊性质的原子或原子团。
(2)有机物的主要类别、官能团和典型代表物命题角度一有机物官能团的判断1、下列物质的类别与所含官能团都正确的是()①酚类COOH③醛类OCOOHA、①②③④⑤B、②③④C、②④⑤D、仅②④解析:选C ①的官能团是醇羟基,属于醇;②的官能团是羧基,属于羧酸;③的官能团是酯基,属于酯;④的官能团是醚键,属于醚;⑤的官能团是羧基,属于羧酸。
2、(xx茂名模拟)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图所示。
该物质中含有的官能团有______________________。
解析:根据图中所示结构,可以看出含有如下官能团:羧基、酯基、(酚)羟基、碳碳双键。
答案:羧基、酯基、(酚)羟基、碳碳双键命题角度二有机物的分类3、(xx兰州模拟)下列说法中正确的是()A、含的物质一定是烯烃B、烯烃中一定含C、CH≡CCH2Cl属于不饱和烃D、最简式为CH2O的物质一定是甲醛解析:选B 含有的物质可能还含有碳、氢之外的其他元素,不一定是烯烃,A错误;CH≡CCH2Cl含有不饱和键,但含有氯元素,不是烃,C错误;乙酸CH3COOH的最简式也是CH2O,D错误。
4、按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
(1)CH3CH2CH2OH________;(2) ________;(3)________;(4)HCOOC2H5________;(5)CH3CH Cl CH2CH3________;(6)________;(7)________;(8)CH3CHO________。

第四节 难溶电解质的溶解平衡1.了解难溶电解质的溶解平衡。
2.了解沉淀溶解平衡的应用及沉淀转化的实质。
(中频)溶解平衡1.含义在一定温度下的水溶液中,当沉淀溶解和生成的速率相等时,即建立了溶解平衡状态。
2.溶解平衡的建立固体溶质溶液中的溶质⎩⎪⎨⎪⎧v 溶解>v 沉淀,固体溶解v 溶解=v 沉淀,溶解平衡v 溶解<v 沉淀,析出晶体3.特点4.沉淀溶解平衡常数——溶度积(1)表达式对于溶解平衡M m A n(s) m M n+(aq)+n A m-(aq)K sp=c m(M n+)·c n(A m-)(2)意义溶度积(K sp)反映了物质在水中的溶解能力。
(3)影响因素溶度积常数只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
沉淀溶解平衡的应用1.沉淀的生成方法实例离子方程式调节pH法除去NH4Cl溶液中的FeCl3Fe3++3NH3·H2O=== Fe(OH)3↓+3NH+4沉淀剂法除去污水中的重金属离子H2S+Cu2+===CuS↓+2H+2.沉淀的溶解(1)含义减少溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,从而使沉淀溶解。
(2)方法实例方法实例离子方程式酸溶解法CaCO3溶于盐酸CaCO3+2H+===Ca2++CO2↑+H2O盐溶液溶解法 Mg(OH)2溶于NH 4Cl(溶液) Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 3.沉淀的转化(1)实质:难溶电解质溶解平衡的移动。
沉淀的溶解度差别越大,越容易转化。
例如:AgNO 3――→NaCl AgCl(白色沉淀)――→NaBr AgBr(淡黄色沉淀)――→NaI AgI(黄色沉淀)――→Na 2SAg 2S(黑色沉淀)。
(2)应用: ①锅炉除垢。
将CaSO 4转化为CaCO 3,离子方程式为CaSO 4+CO 2-3===CaCO 3+SO 2-4。
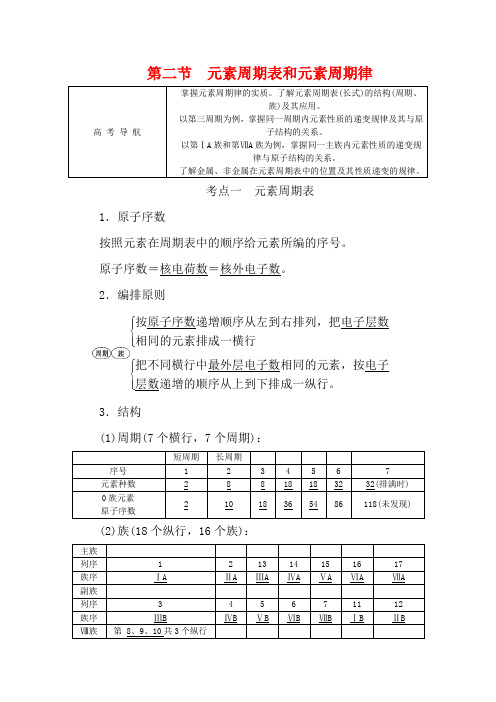
第二节 元素周期表和元素周期律高 考 导 航掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
以第三周期为例,掌握同一周期内元素性质的递变规律及其与原子结构的关系。
以第ⅠA 族和第ⅦA 族为例,掌握同一主族内元素性质的递变规律与原子结构的关系。
了解金属、非金属在元素周期表中的位置及其性质递变的规律。
考点一 元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号。
原子序数=核电荷数=核外电子数。
2.编排原则⎩⎪⎨⎪⎧按原子序数递增顺序从左到右排列,把电子层数相同的元素排成一横行⎩⎪⎨⎪⎧把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上到下排成一纵行。
3.结构(1)周期(7个横行,7个周期):短周期 长周期 序号 1 2 3 4 5 6 7 元素种数 2 8 8 18 18 32 32(排满时) 0族元素 原子序数21018365486118(未发现)(2)族(18个纵行,16个族):主族 列序 1 2 13 14 15 16 17 族序 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 副族 列序 3 4 5 6 7 11 12 族序 ⅢBⅣB ⅤB ⅥB ⅦB ⅠB ⅡB Ⅷ族第 8、9、10共3个纵行4.元素周期表中元素的分区(1)分界线:如上图所示,沿着元素周期表中 B、Si、As、Te、At与Al、Ge、Sb、Po的交界处画一条斜线,即为金属元素和非金属元素的分界线(氢元素除外)。
(2)金属元素:位于分界线的左面区域,包括所有的过渡元素和部分主族元素。
(3)非金属元素:位于分界线的右面区域,包括部分主族元素和 0族元素。
(4)分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。
5.元素周期表中的特殊位置(1)过渡元素:元素周期表中部从第ⅢB族到第ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。
(2)镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。

高三化学一轮复习知识点讲解在高三这一重要的阶段,很多学生都面临着一轮复习的压力。
而在化学这门学科中,知识点的理解和掌握也是至关重要的。
通过对化学一轮复习的知识点的深入讲解,帮助学生在复习中更好地理解和应用这些知识点。
一、化学元素和化合物的基础知识化学元素是由具有相同原子序数的原子组成的物质,目前已知的元素有118个。
而化合物是由两种或更多不同元素以化学键相连接而成的物质。
化学元素和化合物的理解是学习化学的基础。
二、化学反应的原理和类型化学反应是化学变化的过程,包括原子、离子和分子的重新组合。
根据反应发生的条件和产物的性质,化学反应可以分为氧化还原反应、酸碱中和反应、置换反应等多种类型。
理解化学反应的原理和类型,对于学生掌握化学知识和解题能力至关重要。
三、化学平衡的概念和表达式化学平衡是指化学反应达到正反应速率相等的状态。
在化学平衡中,反应物和生成物的浓度保持不变。
化学平衡的表达式由反应物和生成物的浓度比决定,称为平衡常数。
了解化学平衡的概念和表达式,有助于学生理解平衡态及其在化学反应中的应用。
四、化学键和分子结构化学键是原子之间的连接,分为离子键、共价键和金属键等。
在化学键的基础上,分子结构指的是分子中原子的排布和连接方式。
对于学生来说,掌握化学键和分子结构的理解,有助于深入理解化合物的性质和反应规律。
五、溶液与物质的溶解度溶液是由溶质和溶剂组成的稳定混合物。
而物质的溶解度是指溶液中某种物质的最大溶解量。
了解溶液的组成和物质的溶解度,有助于学生理解溶液的性质和溶解度的影响因素。
六、酸、碱和盐的性质与反应酸、碱和盐是化学中常见的物质。
酸具有酸味、酸性和酸对金属具有腐蚀性等性质;碱具有苦味、碱性和与酸中和反应等性质;而盐是由酸和碱中和反应生成的物质。
学生需要了解酸、碱和盐的性质以及它们之间的反应规律。
七、氧化还原反应氧化还原反应是一类重要的化学反应,涉及物质的氧化和还原。
在氧化反应中,物质丧失电子,而在还原反应中,物质获得电子。

第四章常见的非金属及其化合物第一节无机非金属材料的主角——硅了解碳、硅单质及其化合物的主要性质及应用。
了解碳、硅及其化合物对环境质量的影响。
了解常见无机非金属材料的性质和用途。
考点一碳、硅单质的性质及用途1.单质的存在形态、物理性质和用途2.化学性质碳、硅在参与化学反应时,一般表现还原性。
1.请将碳、硅单质与其物理性质、用途连线。
提示:①—c ②—a ③—e ④—b ⑤—d2.晶体硅用途广泛,请用化学方程式表示工业上收获高纯硅的过程。
提示:粗硅的制取:SiO 2+2C=====高温Si +2CO↑。
由粗硅制取纯硅(常用方法):Si(粗)+2Cl 2=====加热SiCl 4,SiCl 4+2H 2=====高温Si(纯)+4HCl 。
命题角度一 碳、硅的性质1.(2014·江西抚州三校联考)下列说法正确的是( )A .单质――→+O 2氧化物――→+H 2O 酸或碱――→+NaOH 或HCl 盐,碳或硅单质可以按上述关系进行转化B .若a 、b 、c 分别为Si 、SiO 2、H 2SiO 3,则可以通过一步反应实现转化:b c ―→aC .太阳能电池板中的硅在元素周期表中处于金属元素与非金属元素的交界位置D .单质硅常用于制造光导纤维解析:选 C A 项,SiO 2不与H 2O 反应,即“氧化物――→+H 2O 酸或碱”不能实现转化;B项,b ―→c,c ―→a 均不能通过一步反应实现转化;D 项,SiO 2用于制造光导纤维。
2.硅作为一种新型能源被广泛开发利用,关于其有利因素的下列说法中,你认为不正确的是( )A .硅燃烧产物对环境产生的污染,容易得到有效控制B .从Si(s)+O 2(g)=====△SiO 2(s) ΔH =-858.6 kJ/mol 可知,硅燃烧放出的热量较多C .自然界中硅的贮存量丰富,可以从自然界直接获得单质硅D .硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一解析:选 C 硅燃烧可以放出较多热量,生成二氧化硅,二氧化硅不是气体,其污染容易得到有效控制;硅为固体燃料,化学性质不活泼,运输、贮存比较容易;硅在自然界中无单质形式,只有化合物,C 错误。

考点1物质的组成分类与转化变化一、物质的分类1.无机化合物分类无机化合物⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎧氢化物:HCl 、H 2S 、H 2O 、NH 3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO 、NO 等成盐氧化物⎩⎪⎨⎪⎧碱性氧化物:Na 2O 、CaO 等酸性氧化物:CO 2、P 2O 5等两性氧化物:Al 2O 3等过氧化物:Na 2O 2、H 2O 2等酸⎩⎪⎪⎨⎪⎪⎧按电离出的H +数⎩⎪⎨⎪⎧一元酸:HCl 、HNO 3等二元酸:H 2SO 4、H 2S 等三元酸:H 3PO 4等按酸根是否含氧⎩⎪⎨⎪⎧ 无氧酸:HCl 、H 2S 等含氧酸:HClO 4、H 2SO 4等按酸性强弱⎩⎪⎨⎪⎧ 强酸:HCl 、H 2SO 4、HNO 3等弱酸:CH 3COOH 、HF 等按有无挥发性⎩⎪⎨⎪⎧ 挥发性酸:HNO 3、HCl 等难挥发性酸:H 2SO 4、H 3PO 4等碱⎩⎨⎧按水溶性⎩⎪⎨⎪⎧ 可溶性碱:NaOH 、KOH 、Ba (OH )2等难溶性碱:Mg (OH )2、Cu (OH )2等按碱性强弱⎩⎪⎨⎪⎧ 强碱:NaOH 、Ba (OH )2、KOH 等弱碱:NH 3·H 2O 等盐⎩⎪⎨⎪⎧正盐:BaSO 4、KNO 3、NaCl 等酸式盐:NaHCO 3、KHSO 4等碱式盐:Cu 2(OH )2CO 3等复盐:KAl (SO 4)2·12H 2O 等2.氧化物分类1.物质的性质与变化根据是否有新物质生成分为物理变化和化学变化。
应注意:升华、萃取、分液、蒸馏、吸附、盐析、金属导电、焰色反应、电离等都归为物理变化;脱水、蛋白质变性、水解、同素异形体互变、电解、熔融盐导电、电解质溶液导电等都是化学变化。
2.化学反应的分类四、胶体的性质与应用1.丁达尔效应可见光束通过胶体时,在与入射光垂直的角度可看见明亮的光路,可用此性质来鉴别溶液和胶体。
2.吸附性自来水含有铝和铁的化合物时,溶于水产生氢氧化铝胶体或氢氧化铁胶体,吸附水中的悬浮颗粒并沉降,从而达到净水的目的。
2023步步高大一轮复习讲义化学一、化学的基本概念与性质1.1 化学的定义化学是研究物质的组成、性质、结构、变化规律以及变化过程中所涉及的能量变化的科学。
1.2 物质的分类根据物质的组成和性质,可以将物质分为纯物质和混合物。
纯物质包括元素和化合物,而混合物由两种或两种以上的纯物质按一定比例混合而成。
1.3 化学符号和化学式化学符号是表示元素的简写,化学式是用化学符号表示化合物的组成。
1.4 物质的量和摩尔质量物质的量是物质中粒子的数量,用摩尔(mol)表示。
摩尔质量是一个物质摩尔质量的质量,单位是克。
1.5 化学方程式化学反应可以用化学方程式表示,反应物位于反应箭头的左边,生成物位于箭头的右边。
二、无机化学2.1 原子结构与元素周期表原子由带正电荷的原子核和带负电荷的电子组成。
元素周期表是一张按元素的原子序数排列的表格,可以反映元素的周期性规律。
2.2 化学键化学键是原子之间的相互作用力,包括离子键、共价键和金属键。
2.3 配位化合物配位化合物是由中心金属离子与它周围的配体离子或配体分子通过共价键或配位键结合而成。
2.4 酸碱与盐酸是能够接受电子对的电子给体,碱是能够供给电子对的电子受体。
酸与碱反应生成盐和水的反应称为酸碱中和反应。
2.5 氧化还原反应氧化还原反应是指物质的氧化态和还原态之间的转化过程。
氧化剂能够接受电子,而还原剂能够提供电子。
三、有机化学3.1 有机化学的基本概念有机化学是研究碳和碳与氢、氧、氮等元素构成的化合物的组成、性质、结构和反应的科学。
3.2 碳骨架和官能团有机化合物的碳骨架由碳原子构成,官能团是有机化合物中决定其性质和反应性质的部分。
3.3 烃类烃类是由碳和氢构成的化合物,包括烷烃、烯烃和炔烃。
3.4 卤代烃与醇卤代烃是含有卤素的有机化合物,醇是含有羟基的有机化合物。
3.5 醛、酮和羧酸醛是含有羰基的有机化合物,酮是含有羰基的有机化合物,羧酸是含有羧基的有机化合物。
四、化学反应与能量4.1 化学反应的速率化学反应的速率指的是反应物消耗或生成的物质量随时间的变化率。
第九章有机化学基础[本章为有机化学部分,为方便系统复习,我们在编写时把《化学2》中的有机化学部分与《有机化学基础》进行整合,供开设《有机化学基础》的班级使用]高考导航能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
了解常见有机化合物的结构,了解有机物分子中的官能团,能正确表示它们的结构。
了解测定有机化合物结构的化学方法和某些物理方法。
了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体(不包括手性异构体)。
能根据有机化合物命名规则命名简单的有机化合物。
考点一有机化合物的分类及官能团1.按碳的骨架分类2.按官能团分类(1)官能团:决定化合物特殊性质的原子或原子团。
(2)有机物的主要类别、官能团和典型代表物命题角度一有机物官能团的判断1.下列物质的类别与所含官能团都正确的是( )①酚类—OH②CH3CCOOHHCH3羧酸—COOH③醛类—CHO④CH3—O—CH3醚类⑤羧酸—COOHA.①②③④⑤B.②③④C.②④⑤ D.仅②④解析:选C ①的官能团是醇羟基,属于醇;②的官能团是羧基,属于羧酸;③的官能团是酯基,属于酯;④的官能团是醚键,属于醚;⑤的官能团是羧基,属于羧酸。
2.(2014·茂名模拟)迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图所示。
该物质中含有的官能团有______________________。
解析:根据图中所示结构,可以看出含有如下官能团:羧基、酯基、(酚)羟基、碳碳双键。
答案:羧基、酯基、(酚)羟基、碳碳双键命题角度二有机物的分类3.(2014·兰州模拟)下列说法中正确的是( )A.含的物质一定是烯烃B.烯烃中一定含C.CH≡CCH2Cl属于不饱和烃D.最简式为CH2O的物质一定是甲醛解析:选B 含有的物质可能还含有碳、氢之外的其他元素,不一定是烯烃,A错误;CH≡CCH2Cl含有不饱和键,但含有氯元素,不是烃,C错误;乙酸CH3COOH的最简式也是CH2O,D错误。
第三章金属及其化合物第一节钠及其化合物高考导航了解钠的主要性质及其应用。
了解钠的重要化合物的主要性质及其应用。
考点一钠的性质及应用1颜色熔点硬度密度导电导热性银白色低小比水小良好2.化学性质(1)主要化学性质:钠⎩⎪⎪⎨⎪⎪⎧与非金属单质反应⎩⎪⎨⎪⎧O2⎩⎨⎧常温:4Na+O2===2Na2O点燃:2Na+O2=====点燃Na2O2Cl2:2Na+Cl2=====点燃2NaCl与水反应:2Na+2H2O===2NaOH+H2↑与酸如HCl反应:2Na+2HCl===2NaCl+H2↑与盐溶液如CuSO4溶液反应:2Na+CuSO4+2H2O===Cu OH2↓+Na2SO4+H2↑(2)钠与水(含酚酞)反应的实验现象及解释:3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====电解2Na+Cl2↑。
(2)保存:密封保存,通常保存在煤油中。
4.钠的用途(1)制取Na2O2等化合物。
(2)钠、钾合金(液态)可用于原子反应堆的导热剂。
(3)用作电光源,制作高压钠灯。
(4)冶炼某些金属。
金属钠具有强的还原性,熔融状态下可以用于制取金属,如4Na+TiCl 4=====熔融4NaCl +Ti 。
说明:工业上在850 ℃,钠与熔融状态的KCl 反应可以制取金属钾:Na(l)+KCl(l)=====850 ℃NaCl(l)+K(g),反应发生是因为在反应温度下,体系中只有钾是气体,能从体系中逸出,利于反应正向进行,即在反应温度下,为熵增反应,该反应不能说明金属钠的还原性强于金属钾!1.金属钠着火,应如何灭火?能否用水或泡沫灭火器?提示:金属钠着火时,应该用沙土掩埋灭火,而不能用水或泡沫灭火器,因为钠与水或泡沫灭火器喷出的CO 2均能反应,会加剧火势。
2.钠与氧气反应时,反应条件与产物之间有何关系?提示:钠和氧气常温时反应生成Na 2O ,点燃或加热时反应会生成Na 2O 2。
命题角度一 Na 与氧气的反应1.(2014·郑州模拟)取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是( )①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质A .②⑤B .①②③C .①④⑤D .④⑤解析:选 C 金属钠在燃烧匙里加热时首先熔化成小球,然后燃烧,燃烧时产生黄色火焰,最后得到淡黄色的过氧化钠。
第四章常见的非金属及其化合物第一节无机非金属材料的主角——硅了解碳、硅单质及其化合物的主要性质及应用。
了解碳、硅及其化合物对环境质量的影响。
了解常见无机非金属材料的性质和用途。
考点一碳、硅单质的性质及用途1.单质的存在形态、物理性质和用途2.化学性质碳、硅在参与化学反应时,一般表现还原性。
1.请将碳、硅单质与其物理性质、用途连线。
提示:①—c ②—a ③—e ④—b ⑤—d 2.晶体硅用途广泛,请用化学方程式表示工业上收获高纯硅的过程。
提示:粗硅的制取:SiO 2+2C=====高温Si +2CO↑。
由粗硅制取纯硅(常用方法):Si(粗)+2Cl 2=====加热SiCl 4,SiCl 4+2H 2=====高温Si(纯)+4HCl 。
命题角度一 碳、硅的性质1.(2014·江西抚州三校联考)下列说法正确的是( )A .单质――→+O 2氧化物――→+H 2O 酸或碱――→+NaOH 或HCl 盐,碳或硅单质可以按上述关系进行转化B .若a 、b 、c 分别为Si 、SiO 2、H 2SiO 3,则可以通过一步反应实现转化:b c ―→aC .太阳能电池板中的硅在元素周期表中处于金属元素与非金属元素的交界位置D .单质硅常用于制造光导纤维解析:选 C A 项,SiO 2不与H 2O 反应,即“氧化物――→+H 2O 酸或碱”不能实现转化;B项,b ―→c,c ―→a 均不能通过一步反应实现转化;D 项,SiO 2用于制造光导纤维。
2.硅作为一种新型能源被广泛开发利用,关于其有利因素的下列说法中,你认为不正确的是( )A .硅燃烧产物对环境产生的污染,容易得到有效控制B .从Si(s)+O 2(g)=====△SiO 2(s) ΔH =-858.6 kJmol 可知,硅燃烧放出的热量较多C .自然界中硅的贮存量丰富,可以从自然界直接获得单质硅D .硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一解析:选 C 硅燃烧可以放出较多热量,生成二氧化硅,二氧化硅不是气体,其污染容易得到有效控制;硅为固体燃料,化学性质不活泼,运输、贮存比较容易;硅在自然界中无单质形式,只有化合物,C 错误。
命题角度二 硅的制备3.获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动,信息产业的核心材料是高纯度单晶硅。
下面是高纯度单晶硅的生产方法之一:SiO 2――→C Si(粗硅)――→HCl 、Cl 2SiHCl 3(沸点31.5 ℃)――→H 2Si ――→气相沉积法高纯硅――→ 单晶硅近代用得较多的另一种方法(方法二):用金属硅化物(Mg 2Si)与盐酸作用制得硅烷(SiH 4);再热分解硅烷可得高纯硅。
(1)从方法一生产单晶硅的过程看,由碳还原得到的硅还要进一步处理的原因是________________________________________________________________________。
(2)写出方法二中,生产高纯硅的两个化学方程式:①________________________________________________________________________;②________________________________________________________________________。
解析:(1)根据方法一的生产流程,可得反应式:SiO 2+2C=====高温Si(粗硅)+2CO↑,所得的粗硅中含有大量的其他杂质(如C 、SiO 2等),没有实际应用价值,将粗硅用HCl 、Cl 2处理转化为沸点低的SiHCl 3,反应方程式为Si +Cl 2+HCl=====高温SiHCl 3,低沸点的SiHCl 3通过蒸馏极易分离提纯,然后将纯的SiHCl 3在高温下用H 2还原即可得到纯度高的Si 蒸气:SiHCl 3+H 2=====高温Si +3HCl ,再进行气相沉淀即可制得高纯度的硅,从而得到单晶硅。
(2)Mg 2Si 与盐酸作用制得SiH 4,根据原子守恒可知另一种生成物为MgCl 2,其反应方程式为Mg 2Si +4HCl===2MgCl 2+SiH 4↑,再将SiH 4进行热分解即可得到高纯硅和H 2,其反应方程式为SiH 4=====△Si +2H 2。
答案:(1)由C 还原SiO 2得到的单质Si 中,杂质含量过高,将它用HCl 、Cl 2处理得到低沸点的SiHCl 3,便于蒸馏提纯,然后再还原得到高纯硅(2)①Mg 2Si +4HCl===2MgCl 2+SiH 4↑②SiH 4=====△Si +2H 24.(2014·湖北孝感高三质检)在工业中利用镁制取硅2Mg +SiO 2=====△2MgO +Si ,同时有副反应发生:2Mg +Si=====△Mg 2Si ,Mg 2Si 遇盐酸迅速反应生成SiH 4(硅烷),SiH 4在常温下是一种不稳定、易分解、可自燃的气体。
如图是进行Mg 与SiO 2反应的实验装置:(1)由于氧气的存在对该实验有较大影响,实验中应通入气体X 作为保护气,试管中的固体药品可选用________(填序号)。
a .石灰石b .锌粒c .纯碱(2)实验开始时,必须先通入X 气体一段时间,再加热反应物,其理由是________________________________________________________________________。
当反应开始后,移走酒精灯反应能继续进行,其原因是________________________________________________________________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。
可观察到闪亮的火星,产生此现象的原因用化学方程式表示为①________________________,②______________________________。
解析:(1)从给出的试剂看,可产生的气体只有CO 2和H 2,CO 2与Mg 能反应,故不能做保护气,因此保护气为H 2。
制取H 2的试剂是稀H 2SO 4和锌粒,浓H 2SO 4为气体干燥剂。
(2)装置内的O 2不被排出,O 2和H 2混合在加热条件下会发生爆炸;移走酒精灯反应继续进行,说明Mg 与SiO 2的反应是放热反应。
(3)Mg 2Si 与盐酸会发生复分解反应生成MgCl 2和SiH 4,并放出大量的热,SiH 4常温下可自燃。
答案:(1)b(2)防止在加热条件下H 2和O 2混合发生爆炸 SiO 2和Mg 粉的反应是放热反应(3)①Mg 2Si +4HCl===2MgCl 2+SiH 4↑②SiH 4+2O 2===SiO 2+2H 2O1.判断正误,正确的划“√”,错误的划“×”(1)(2013·江苏高考)甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲――→丁乙丁甲丙,若甲为焦炭,则丁可能是O 2。
( )(2)(2013·广东高考)高温下用焦炭还原SiO 2制取粗硅。
( )(3)(2013·新课标全国卷Ⅰ)黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成。
( )(4)(2012·新课标全国卷)单质硅是将太阳能转变为电能的常用材料。
( ) 解析:(1)按照题中转化关系,若甲为焦炭,丁是O 2,则乙是CO ,丙是CO 2,合理。
(3)制备黑火药的原料为S 、KNO 3、C ,三者比例为1∶2∶3。
(4)单质硅常用于太阳能电池。
答案:(1)√ (2)√ (3)√ (4)√2.(2011·山东高考)某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A .在自然界中只以化合态的形式存在B .单质常用作半导体材料和光导纤维C .最高价氧化物不与酸反应D .气态氢化物比甲烷稳定解析:选A 该短周期非金属元素为Si ,硅在自然界中只以化合态形式存在,A 正确;单质硅可用作半导体材料,而光导纤维的主要成分是SiO 2,B 错误;Si 的最高价氧化物为SiO 2,其可以与氢氟酸反应,C 错误;由于非金属性Si <C ,因此气态氢化物的稳定性:SiH 4<CH 4,D 错误。
考点二 碳、硅的氧化物1.一氧化碳(1)物理性质:无色气体,有毒,不溶于水。
(2)化学性质:①燃烧:2CO +O 2=====点燃2CO 2。
②还原CuO :CO +CuO=====△Cu +CO 2。
2.二氧化碳和二氧化硅的比较[深化拓展](1)盛放NaOH 溶液的试剂瓶不能使用玻璃塞,盛放氢氟酸不能使用玻璃瓶只能使用塑料瓶,因为玻璃中含有的SiO 2可以与NaOH 溶液、氢氟酸反应。
(2)SiO 2是H 2SiO 3的酸酐,但它不溶于水,不能直接将它与水作用制备H 2SiO 3。
(3)非金属氧化物的熔、沸点一般较低,但SiO 2的熔、沸点却很高。
(4)酸性氧化物一般不与酸作用,但SiO 2却能与氢氟酸作用。
命题角度一 二氧化硅的结构和性质1.(2014·河北邯郸模拟)用一种试剂证明生石灰中含有石灰石和石英,下列试剂适宜的是( )A .盐酸B .硫酸C .NaOH 溶液D .氯化钠溶液解析:选 A 向生石灰中加入盐酸,如果有无色无味的气体生成,证明含有石灰石;如果有不溶于盐酸的固体残渣剩余,说明含有石英。
2.玻璃的主要成分是SiO 2,以下物质必须贮存在带有橡胶塞的玻璃试剂瓶中的是____________________。
①KOH 溶液 ②饱和Na 2CO 3溶液(碱性溶液) ③盐酸④水玻璃(Na 2SiO 3的水溶液) ⑤NaOH 溶液 ⑥氢氟酸⑦澄清石灰水 ⑧硝酸解析:SiO 2是酸性氧化物,能与碱反应,若用玻璃塞的试剂瓶盛碱性溶液,SiO 2会与碱反应,生成的硅酸盐能粘住瓶塞而不易打开。
SiO 2与硝酸和盐酸不反应,而氢氟酸能腐蚀玻璃,不能用玻璃试剂瓶盛装。
答案:①②④⑤⑦3.指出下列反应中SiO 2所表现的化学性质或作用,在A ~E 选项中选择正确答案填入括号内。
①SiO 2+2NaOH===Na 2SiO 3+H 2O( )②SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑( )③SiO 2+2C=====高温Si +2CO↑( )④SiO 2+3C=====高温SiC +2CO↑( )⑤SiO 2+4HF===SiF 4↑+2H 2O( )A .作为玻璃的成分被消耗而使玻璃被腐蚀B .氧化性C .酸性氧化物的通性D .将挥发性的酸酐从其盐中置换出来E .未参加氧化还原反应解析:将所给选项结合实际一一对应查找,A 用来雕刻玻璃,应有氢氟酸(HF)参与反应;B 中氧化性是指反应中SiO 2中Si 得电子,化合价降低;D 中挥发性的酸酐,应为CO 2而不是CO ,表现酸性氧化物通性是SiO 2与碱的反应。