2020高考化学通用版冲刺大三轮复习讲义:专题一 重温理论体系框架 Word版含答案
- 格式:docx
- 大小:1.24 MB
- 文档页数:14

本章知识系统及重要化学方程式再书写1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式。
①Na 和H 2O 的反应2Na +2H 2O===2Na ++2OH -+H 2↑;②Na 在空气中燃烧2Na +O 2=====点燃Na 2O 2;③Na 2O 2和H 2O 的反应2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑;④Na 2O 2和CO 2的反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2;⑤向NaOH 溶液中通入过量CO 2OH -+CO 2===HCO -3;⑥将Na 2CO 3溶液与石灰乳混合CO 2-3+Ca(OH)2===CaCO 3↓+2OH -; ⑦向Na 2CO 3稀溶液中通入过量CO 2CO 2-3+CO 2+H 2O===2HCO -3; ⑧将NaHCO 3溶液和NaOH 溶液等物质的量混合HCO -3+OH -===CO 2-3+H 2O ; ⑨将NaHCO 3溶液与澄清石灰水等物质的量混合HCO -3+Ca 2++OH -===CaCO 3↓+H 2O ; ⑩将NaHCO 3溶液与少量澄清石灰水混合2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O。
2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式。
①Al和NaOH溶液的反应2Al+2OH-+2H2O===2AlO-2+3H2↑;②Al(OH)3和NaOH溶液的反应Al(OH)3+OH-===AlO-2+2H2O;③Al(OH)3和盐酸的反应Al(OH)3+3H+===Al3++3H2O;④Al2O3和NaOH的反应Al2O3+2OH-===2AlO-2+H2O;⑤Al2O3和盐酸的反应Al2O3+6H+===2Al3++3H2O;⑥NaAlO2和过量盐酸的反应AlO-2+4H+===Al3++2H2O;⑦向NaAlO2溶液中通入过量CO2气体AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3;⑧将NaAlO2溶液与NaHCO3溶液混合AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3;⑨将NaAlO2溶液与AlCl3溶液混合3AlO-2+Al3++6H2O===4Al(OH)3↓;⑩将AlCl3溶液与NaHCO3溶液混合Al3++3HCO-3===Al(OH)3↓+3CO2↑。

(2)化合物C 在一定条件下可发生分子间成环反应生成含3个六元环的有机物,其化学方程式为。
(3)写出1种满足下列条件的B 的同分异构体的结构简式:(任写1种)。
①含有两个—NH 2的芳香族化合物;②核磁共振氢谱有三种吸收峰。
(4)结合上述流程写出以乙醇为有机原料制备的合成路线流程图(无机试剂任选)。
答案(1)2-氯苯甲醛(或邻氯苯甲醛)(2)(3)(4)CH 3CH 2OH ――→O 2/Cu△CH 3CHO ――→NaCNNH 4Cl―――→H +/H 2O―――→一定条件B 组1.(2018·广东江门高考模拟)槟榔碱在医疗上常用于治疗青光眼,其中一种合成路线如下:(2)化合物C 在一定条件下可发生分子间成环反应生成含3个六元环的有机物,其化学方程式为。
(3)写出1种满足下列条件的B 的同分异构体的结构简式:(任写1种)。
①含有两个—NH 2的芳香族化合物;②核磁共振氢谱有三种吸收峰。
(4)结合上述流程写出以乙醇为有机原料制备的合成路线流程图(无机试剂任选)。
答案(1)2-氯苯甲醛(或邻氯苯甲醛)(2)(3)(4)CH 3CH 2OH ――→O 2/Cu△CH 3CHO ――→NaCNNH 4Cl―――→H +/H 2O―――→一定条件B 组1.(2018·广东江门高考模拟)槟榔碱在医疗上常用于治疗青光眼,其中一种合成路线如下:(2)化合物C 在一定条件下可发生分子间成环反应生成含3个六元环的有机物,其化学方程式为。
(3)写出1种满足下列条件的B 的同分异构体的结构简式:(任写1种)。
①含有两个—NH 2的芳香族化合物;②核磁共振氢谱有三种吸收峰。
(4)结合上述流程写出以乙醇为有机原料制备的合成路线流程图(无机试剂任选)。
答案(1)2-氯苯甲醛(或邻氯苯甲醛)(2)(3)(4)CH 3CH 2OH ――→O 2/Cu△CH 3CHO ――→NaCNNH 4Cl―――→H +/H 2O―――→一定条件B 组1.(2018·广东江门高考模拟)槟榔碱在医疗上常用于治疗青光眼,其中一种合成路线如下:(2)化合物C 在一定条件下可发生分子间成环反应生成含3个六元环的有机物,其化学方程式为。

2020年高考化学第一轮复习知识梳理提纲(精华版)化学反应及能量变化实质:有电子转移(得失与偏移)特征:反应前后元素的化合价有变化还原性 化合价升高 弱氧化性↑ ↑ 还原剂 氧化反应 氧化产物 氧化剂 还原反应 还原产物 ↓ ↓氧化性 化合价降低 弱还原性氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。
有电子转移(得失或偏移)的反应都是氧化还原反应。
概念: 氧化剂:反应中得到电子(或电子对偏向)的物质(反应中所含元素化合价降低物)还原剂:反应中失去电子(或电子对偏离)的物质(反应中所含元素化合价升高物)氧化产物:还原剂被氧化所得生成物;还原产物:氧化剂被还原所得生成物。
失电子,化合价升高,被氧化双线桥:氧化剂 + 还原剂 = 还原产物 + 氧化产物 得电子,化合价降低,被还原 电子转移表示方法 单线桥: 电子 还原剂 + 氧化剂 = 还原产物 + 氧化产物 二者的主 表示意义、箭起止 要区别: 电子数目等 依据原则:氧化剂化合价降低总数=还原剂化合价升高总数 找出价态变化,看两剂分子式,确定升降总数; 方法步骤:求最小公倍数,得出两剂系数,观察配平其它。
有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等,列出守恒关系式求解。
变化 变化 反应物→ 概念及转化关系配平 氧化还原反应→产物①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律) ②、由反应条件的难易比较; ③、由氧化还原反应方向比较;(氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物) ④、根据(氧化剂、还原剂)元素的价态与氧化还原性关系比较。
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
①、活泼的非金属,如Cl 2、Br 2、O 2 等;②、元素(如Mn 等)处于高化合价的氧化物,如MnO 2、KMnO 4等 氧化剂: ③、元素(如S 、N 等)处于高化合价时的含氧酸,如浓H 2SO 4、HNO 3 等 ④、元素(如Mn 、Cl 、Fe 等)处于高化合价时的盐,如KMnO 4、KClO 3、FeCl 3、K 2Cr 2O 7⑤、过氧化物,如Na 2O 2、H 2O 2等。

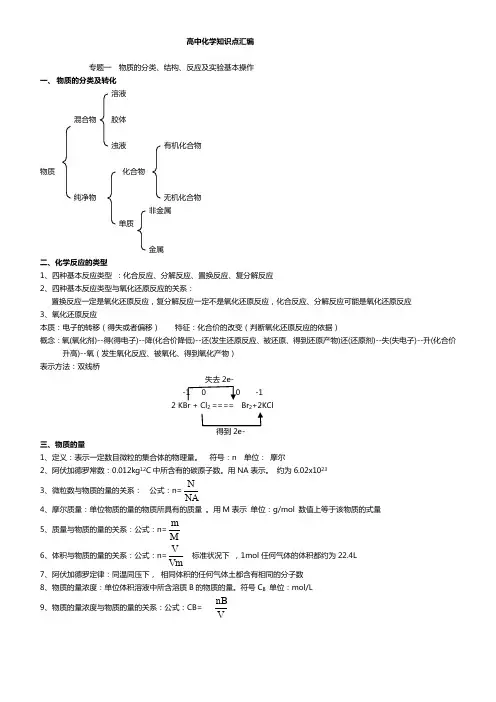
高中化学知识点汇编专题一 物质的分类、结构、反应及实验基本操作一、 物质的分类及转化 溶液混合物 胶体浊液 有机化合物物质 化合物纯净物 无机化合物 非金属 单质金属 二、化学反应的类型1、四种基本反应类型 :化合反应、分解反应、置换反应、复分解反应2、四种基本反应类型与氧化还原反应的关系:置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合反应、分解反应可能是氧化还原反应 3、氧化还原反应本质:电子的转移(得失或者偏移) 特征:化合价的改变(判断氧化还原反应的依据)概念:氧(氧化剂)--得(得电子)--降(化合价降低)--还(发生还原反应、被还原、得到还原产物)还(还原剂)--失(失电子)--升(化合价升高)--氧(发生氧化反应、被氧化、得到氧化产物)表示方法:双线桥失去2e- -1 0 0 -12 KBr + Cl 2 ==== Br 2+2KCl得到2e- 三、物质的量1、定义:表示一定数目微粒的集合体的物理量。
符号:n 单位: 摩尔2、阿伏加德罗常数:0.012kg 12C 中所含有的碳原子数。
用NA 表示。
约为6.02x10233、微粒数与物质的量的关系: 公式:n=NAN4、摩尔质量:单位物质的量的物质所具有的质量 。
用M 表示 单位:g/mol 数值上等于该物质的式量5、质量与物质的量的关系:公式:n=M m6、体积与物质的量的关系:公式:n=VmV标准状况下 ,1mol 任何气体的体积都约为22.4L7、阿伏加德罗定律:同温同压下, 相同体积的任何气体土都含有相同的分子数 8、物质的量浓度:单位体积溶液中所含溶质B 的物质的量。
符号C B 单位:mol/L 9、物质的量浓度与物质的量的关系:公式:CB=VnB物质的量浓度与质量分数的关系:公式:10、物质的量浓度的配制:配制前要检查容量瓶是否漏水步骤:①. 计算m=c×v×M ②.称量③. 溶解④.转移(洗涤2---3次洗涤液转入容量瓶)⑤.定容⑥.摇匀⑦. 装瓶贴签四、分散系溶液胶体浊液1、分散质大小(nm)<1nm 1nm~100nm >100nm2、胶体的性质:丁达尔现象(光亮的通路)用于区分溶液与胶体3、电解质:在水溶液中或者熔化状态下能导电的化合物酸:HCl、H2SO4、HNO3、H3PO4、H2SO3等电解质碱:NaOH、KOH、Ba(OH)2、Ca(OH)2、Cu(OH)2、Mg(OH)2、Al(OH)3、Fe(OH)3等盐:Na2CO3、NaHCO3、CaCO3、BaSO4、Na2SO4、NaCl、AgCl活泼金属氧化物:Na2O、CaO、Al2O3、ZnO4、非电解质:在水溶液中和熔化状态下都不能导电的化合物非金属氧化物:CO、CO2、NO、NO2、P2O5、SO2、SO3非电解质多数有机物:蔗糖、酒精、甲烷非酸性的非金属氢化物:NH3五、物质的分离与提纯1、过滤法:适用于分离一种组分可溶,另一种不溶的固态混合物如:粗盐的提纯2、蒸发结晶:混合物中各组分物质在溶剂中溶解性的差异3、蒸馏法:适用于分离各组分互溶,但沸点不同的液态混合物。





一、氧化还原反应判断下列说法是否正确,正确的打“√”,错误的打“×”,错误的指明原因。
(1)在氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )(2)有单质参加或生成单质的反应一定属于氧化还原反应( )(3)某元素由游离态变成化合态时,该元素可能被氧化也可能被还原()(4)阳离子只能得到电子被还原,阴离子只能失去电子被氧化()(5)化合反应均为氧化还原反应()(6)氧化还原反应中的反应物,不是氧化剂就是还原剂()(7)含有最高价元素的化合物不一定具有强氧化性( )(8)物质氧化性的强弱不仅与物质的结构有关,还与反应物的浓度有关( )(9)在Cl +H O HCl+HClO中,氧化剂与还原剂均是C l ,其物质的量之比为1∶1()222(10)3Cu +8HNO (稀)===3Cu(NO ) +2NO ↑+4H O 中,氧化剂与还原剂之比为 8∶3()33 22答案 (1)× 反例:Cl 的歧化反应2(2)× 反例:同素异形体的相互转化 (3)√(4)×反例:Fe ++(5)× 反例:Na O +H O===2NaOH22(6)× 反例:Na O 与 H O 的反应中,水既不是氧化剂,也不是还原剂2 22(7)√ (8)√ (9)√(10)× 反应中 8 个硝酸分子,只有两个参加氧化还原反应二、物质结构与元素周期律1.物质的构成原子、分子、离子都能直接构成物质。
(1)原子间通过共价键构成分子,如:N 、CO 、HCl 、H SO 、NH 、H O 。
222432注意 ①惰性气体是单原子分子,不存在共价键。
②NH ·H O 是共价分子,为纯净物;氨水是混合物。
32(2)原子间通过共价键形成空间网状结构的一类物质,无分子,如:金刚石、SiO 等,只能称2化学式。
(3)原子形成离子,阴、阳离子通过离子键形成的一类物质,无分子,如:NaCl 、Na O 、KOH 、2 2NH Cl ,只能称化学式。
4(4)金属单质形成的晶体中有金属阳离子和自由移动的电子,没有阴离子。
2.物质结构决定物质的性质3.周期表的信息解读(四个关系式) (1)电子层数=周期数。
(2)质子数=原子序数。
(3)最外层电子数=主族序数。
2 3 可被氧化为 Fe(4)主族元素的最高正价=族序数(O 、F 除外),负价=主族序数-8。
4.利用“三看”规律比较微粒半径大小(1)“一看”是电子层数。
当电子层数不同时,电子层数越多,半径越大。
(2)“二看”核电荷数。
当电子层数相同时,核电荷数越大,半径越小。
如:r (O- - + + +)。
(3)“三看”核外电子数。
当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
5.离子化合物和共价化合物与化学键的关系判断下列说法是否正确,正确的打“√”,错误的打“×”,错误的指明原因。
(1)H O 与 NH 3 4含有相同的电子数、质子数() (2)最外层电子数为 2 的元素一定在第ⅡA 族()(3)硅、锗位于金属与非金属的交界线处,二者均可以制作半导体材料( )(4)第ⅠA 族元素的金属性一定比同周期的第ⅡA 族的强( )(5)第三周期元素的离子半径从左至右逐渐减小()(6)气态氢化物的热稳定性:H O>NH >SiH ()234(7)碳酸的酸性强于次氯酸,因而碳的非金属性强于氯( )(8)非金属元素原子不可能形成离子化合物()(9)同主族元素非金属性越强,其简单阴离子的还原性越强( )(10)三氟化硼分子中,B 原子最外层满足 8 电子结构()(11)第ⅠA 族元素与第ⅦA 族元素结合时,所形成的化学键都是离子键( )(12)NaCl 晶体不导电,说明晶体中不含离子( )(13)SiO 分子中含有一个硅原子和两个氧原子()2(14)最外层电子数相同的元素,其化学性质一定相同( )答案(1)√ (2)× 反例:He (3)√ (4)√ (5)× 反例:r (Cl )>r(Al)(6)√(7)× 应比较最高价含氧酸的酸性2 23 )>r (F )>r (Na )>r (Mg )>r (Al + +3 -+(8)×反例:NH Cl4(9)×简单阴离子的还原性越弱(10)×BF的电子式3(11)×反例:HCl(12)×NaCl晶体中没有自由移动的离子(13)×SiO晶体中不存在分子2(14)×反例:He、Mg最外层都是两个电子三、化学反应速率及化学平衡1.化学反应速率2.化学平衡1.判断下列说法是否正确,正确的打“√”,错误的打“×”(1)已知乙酸与乙醇的酯化反应为放热反应,加入少量浓硫酸并加热,该反应的反应速率和平 衡常数均增大( )(2)在恒温条件下,增大压强,化学反应速率一定加快()(3)在一定条件下,增加反应物的量,化学反应速率一定加快( )(4)某温度时 FeO(s)+CO(g) Fe(s)+CO (g)达到平衡时 n (CO)∶n (CO )=4∶1。
则该反应此 22温度时的平衡常数 K =0.25()(5)正反应为吸热反应的可逆反应达到平衡时,升高温度,正反应速率增大,逆反应速率减小, 平衡向正反应方向移动( )(6)加入催化剂加快了反应速率,改变了反应吸收或放出的热量()(7)在一定条件下,平衡向正反应方向移动,正反应速率变大()(8)在 FeCl +3KSCNFe(SCN) +3KCl 平衡体系中,加入 KCl 固体,颜色变浅()33(9)平衡向正反应方向移动,反应物的转化率都增大()答案(1)× (2)×(3)× (4)√ (5)× (6)×(7)× (8)× (9)×2.识图解答下列问题(1)将 2 mol CH 和 5 mol H O(g)通入恒压容器中发生反应 CH (g)+H O(g)42423H (g)。
CH 的平衡转化率与温度、压强的关系如图:24CO(g)+①压强为 p ,平衡时若容器的体积为 1 L ,则 100 ℃时该反应的平衡常数 K =______________。
1 ②若图中的 p <p ,A 、B 、C 三点的平衡常数 K 、K 、K 的大小关系是____________________。
12ABC(2)一定温度下,将CO 和 H 按照物质的量之比 1∶2 充入容积为 2 L 的密闭容器中,发生 CO(g)2+2H (g) CH OH(g) ΔH <0,保持温度和体积不变,反应过程中 CO 的物质的量随时间变 23化如下图所示。
①0~10 min 内 H 的平均反应速率为________;该反应的平衡常数 K =________。
2②15 min 时,若保持温度不变,再向容器中充入 CO 和 CH OH 各 0.3 mol ,平衡将________(填3“向左”“向右”或“不”)移动。
若改变外界反应条件,导致 n (CO)发生如图所示的变化, 则改变的条件可能是________(填字母)。
a .增大 CO 浓度b .升温c .减小容器体积d .加入催化剂答案(1)①6.75 ②K <K <KABC(2)①0.02 mol·L ·min 25 ②不 c解析 (1)① CH (g)+H O(g) 42CO(g)+3H (g)2开始/mol转化/mol平衡/mol21151411331×3 K = =6.75。
1×4②在相同压强下升高温度,CH 的转化率升高,说明该反应为吸热反应,因而温度越高,平4衡常数越大。
故 K <K <K 。
ABC(2)①由图可知,CO 、H 的起始浓度分别 0.2 mol·L ,0.4 mol·L 2CO(g)+2H (g)CH OH(g)23 1 ,初始/mol·L平衡/mol·L 1 10.20.4 00.10.20.1v (H20.2 mol·L )= =0.02 mol·L ·min 10 min0.1 K = =25。
0.1×0.22②Q = =25。
0.1+ ×0.2故平衡不移动。
四、电解质溶液1.离子方程式书写注意事项(1)易溶、易电离的物质(可溶性强电解质,包括强酸、强碱、可溶性盐)以实际参加反应的离 子符号表示;非电解质、弱电解质、气体、单质、氧化物以及难溶盐均用化学式表示。
1 1 -- 31 - - - - 1 -1 1- - 2 0.30.1+ 0.3 22(2)HCO 、HS 、HSO 3 3等弱酸的酸式酸根不能拆开写。
(3)浓硫酸不写离子符号;溶液中铵盐与碱反应加热放出 NH ,不加热写成 N H ·H O ;生成物332中有微溶物析出时,微溶物写成化学式。
(4)盐类水解离子方程式一般用“ ”,不用“↑”和“↓”;若为完全进行的水解反应, 用“===”,“↑”和“↓”;沉淀转化离子方程式用“===”,不用“↓”,可在难溶物后 注“(s)”。
(5)多步连续化学反应,如 AlCl 与 NaOH ,NaAlO 与盐酸,Na CO 与盐酸,CO (SO )通入322322NaOH 溶液中等,此类反应可用分步书写再相加的方法,写出过量时的离子方程式。
2.弱电解质的电离平衡3.离子浓度大小关系分析判断的基本解题框架 步骤一步骤二判断下列说法是否正确,正确的打“√”,错误的打“×”,错误的指明原因。
(1)任何温度下,根据水溶液中 c (H )和 c (OH )的相对大小都可判断溶液的酸碱性( (2)pH =4 的醋酸加水稀释过程中,所有离子浓度都降低( ))- - - +-(3)在NaHCO溶液中加入NaOH溶液,不会影响离子的种类()3c Ag ·c Cl(4)AgCl(s)溶解平衡常数表达式为K =( )c AgCl(5)沉淀转化只能是K 大的沉淀转化为K小的沉淀()sp sp(6)25℃时Cu(OH)在水中的溶解度大于其在Cu(NO ) 溶液中的溶解度()232(7)中和等体积、等pH的盐酸和醋酸消耗的NaOH的量相同()(8)制备无水AlCl、FeCl、CuCl均不能采用将溶液直接蒸干的方法()332(9)某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b<a+1()(10)常温下,pH=5.6的CH COOH与CH COONa混合溶液中,c(Na)>c(CH COO)()333(11)常温下,pH=7的氯化铵和氨水的混合溶液中,离子浓度顺序为c(NH)=c(Cl)>c(OH)4=c(H)( )(12)常温下N aHSO===Na+H+SO,pH=1的NaHSO溶液中:c(H)=c(SO)+c(OH)( )4444(13)锅炉中沉积的CaSO可用饱和Na CO溶液浸泡,再将不溶物用稀盐酸溶解除去()423(14)常温下,在NaHS溶液中滴入少量CuCl溶液,产生黑色沉淀,水的电离程度增大()2(15)常温下,等体积的盐酸和CH COOH的pH相同,由水电离出的c(H)相同()3(16)0.2 mol·L CH COONa与0.1mol·L盐酸等体积混合后的溶液中(pH<7):c(CH COO)>33c(Cl)>c(CH COOH)>c(H)()3(17)向0.10mol·L1NaHSO溶液中通入NH至溶液pH=7:则c(Na)>c(SO)>c(NH3334)() (18)NH HSO溶液中各离子浓度的大小关系是c(H)>c(SO)>c(NH)>c(OH)()4444(19)0.1mol·L1c OH氨水中加入CH COONH固体,比值变大()c NH·H O32(20)用标准NaOH溶液滴定未知浓度的CH COOH溶液到终点时,c(Na)=c(CH COO )()33(21)25℃时,用0.01mol·L盐酸滴定20mL某浓度的氨水时,应选用酚酞作为指示剂()c Cl(22)向含AgCl、AgBr的浊液中加入少量AgNO,溶液中不变()c Br答案(1)√(2)×c(H)减小,c(OH)增大(3)√(4)×固体物质不写入平衡常数表达式(5)×反例:BaSO在饱和Na CO溶液中可转化为BaCO4233(6)√(7)×醋酸的浓度大于盐酸,消耗NaOH的量较多(8)√(9)√(10)×由于溶液显酸性,CH COOH的电离程度大于3CH COONa的水解程度,因而3c(CH COO)>c(Na)3+-sp+-+--+22++-+--+11----+-2+-+2+-+---34+-1--3-+--+(11)√ (12)√ (13)√(14)× HS+Cu ===CuS ↓+H ,水的电离程度减小 (15)√(16)√(17)√ (18)√(19)× CH COONH 电离的 NH ,抑制氨水的电离,c (OH )减小,c (NH ·H O)增大,因而34432比值减小(20)× 滴定终点为 CH COONa ,CH COO 水解,因而 c (Na )>c (CH COO ) 3 3 3(21)× 盐酸滴定氨水,终点呈酸性,应选用甲基橙作指示剂(22)√五、电化学原理1.原电池、电解池的区别2.离子交换膜3.电解原理的应用(1)电镀:待镀件作阴极、镀层金属作阳极、含镀层金属阳离子的溶液作电镀液。