开发海水中的卤素资源(精)
- 格式:doc
- 大小:42.00 KB
- 文档页数:2


《开发海水中的卤素资源》知识梳理二一、基础知识:1、氟溴碘卤素单质都有颜色,溴是色液体,有性,故保存采用水封法;碘为色固体,易。
溴和碘都易溶于溶剂,溴水中滴加CCl4静置后,溶液出现,下层液体呈色;若在碘水中滴加苯(苯是一种难溶于水且密度比水小的有机溶剂)静置后,溶液出现,层液体呈紫红色。
I2遇变蓝。
F2把氯、溴、碘从氢化物或盐溶液中置换出来,因F2会与发生反应。
HF能腐蚀,故应保存在瓶。
2、卤原子结构卤素原子结构的共同点是最外层有个电子,所以在化学反应中易电子,具有性。
它们的区别是随着核电荷数的增加,电子层数,原子半径,原子核对最外层电子的吸引力逐渐,因此,非金属性也逐渐。
结构决定性质。
3、卤素递变规律⑴元素非金属性:F Cl Br I ⑵单质氧化性:F2Cl2Br2 I2⑶阴离子还原性:I-Br-Cl-F-⑷氯化氢稳定性:HF HCl HBr HI⑸氢卤酸酸性:HI HBr HCl HF⑹单质的颜色:逐渐⑺单质的密度、熔沸点:逐渐⑻卤化银的颜色:逐渐二、化学方程式:1、溴和水反应2、碘和氢氧化钠溶液反应3、氟气与水反应:4、铁粉与碘粉共热反应:5、氯水与溴化钠溶液反应:6、溴水与碘化钾溶液反应:7、氯水与碘化钾溶液反应:8、溴化钠溶液与硝酸银溶液反应:9、碘化钾溶液与硝酸银溶液反应:10、溴化银见光分解:11、碘化银见光分解:三、氧化还原反应1、下列化学反应基本类型中,一定是氧化还原反应的是( )A .化合反应 B. 分解反应 C. 复分解反应 D. 置换反应2、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A. Fe+CuSO 4−→−FeSO 4+CuB. Fe 2O 3+3CO −→−∆2Fe+3CO 2 C. AgNO 3+NaCl −→−AgCl↓+NaNO 3 4−→−∆K 2MnO 4 +MnO 2 +O 2↑ 3、在下列变化中,需要加入合适的氧化剂才能实现的是( )A. HCl→H 2B. CO 2→COC. FeCl 3→FeCl 2D. SO 2→SO 34、下列变化需要加入还原剂才能实现的是( )A .MnO 4- →Mn 2+B .HCl→Cl 2C .Fe→Fe 3+D .KClO 3→O 25、对于反应MnO 2 + 4HCl(浓) −→−∆ MnCl 2 + 2H 2O + Cl 2↑,下列说法不正确的是( )A .该反应是氧化还原反应B .MnO 2是氧化剂C .HCl 是还原剂D .若生成7.1 g Cl 2,转移0.1 mol 电子6、对反应:C+2H 2SO 4(农)−→−∆ 2SO 2↑+CO 2↑+2H 2O,下列说法不正确的是( )A.浓H 2SO 4作氧化剂B. C 元素被氧化元素的化合价降低 D. 转移的电子数为2e7、苹果汁是人们喜爱的饮料。
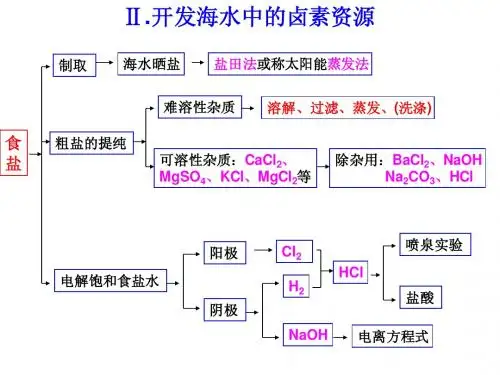


第二单元开发海水中的卤素资源一、教材分析本单元是在学习原子结构的基础上,通过研究开发海水中的化学资源,重点学习有关元素化合物的知识。
通过以食盐为原料的化工产品的学习,认识盐酸、烧碱、氯气、漂粉精等重要的氯碱工业产品;通过海水中提取镁、溴、碘和氯气性质的研究,探索氯、溴、碘的性质和递变规律;通过粗盐提纯、气体制取和卤素性质实验的研究,培养学生的实验动手和实验设计能力;通过氧化—还原反应、气体摩尔体积、电离方程式和离子方程式等化学基本概念和基本理论的学习,为以后的化学学习打下重要的基础。
二、本章内容的核心观念元素观、物质结构与性质、分类观、氧化—还原转价观、守恒观三、把核心观念转化成一些基本理解本单元涉及的卤素及其化合物、氧化—还原反应、离子反应、气体摩尔体积及实验操作和设计等有关知识是中学化学中的重点。
将元素及其化合物的知识与基本概念、基本理论、化学计算、实验操作技能联系起来,达到加深、巩固对元素及其化合物知识的理解。
四、基本理解可以采用“问题”驱动,通过实验设计来促进学生的基本理解1、海水晒盐的原理。
食盐的用途。
粗盐为什么易潮解?如何进行粗盐的提纯?2、探究电解饱和食盐水的原理:如何知道阴阳两级产生的是什么气体?怎么进行检验?得到的产品有什么用途?3、探究盐酸和氯化氢的性质。
实验室制备氯化氢气体,在发生气体过程中那些装置是必需的?4、氯气的物理性质和化学性质。
如何用实验来探究氯水的主要成分?5、决定物质体积大小的因素是什么?为什么相同质量的固体、液体体积会不同?为什么标准状况下相同物质的量的气体的体积几乎相同?6、“同温同压”与“标准状况”有什么联系和区别?阿伏加德罗定律的运用7、在学习海水晒盐的基础上如何进行海水提溴和海水提碘?氯溴碘在结构上有什么相似性?性质上有什么相似性及递变规律?如何进行卤离子的检验?8、得氧失氧的氧化还原反应与无氧参与的氧化还原反应的共同特征是什么?9、氧化还原反应的实质是什么?如何分析卤素单质以及化合物的氧化性和还原性的判断。

第二章开发海水中的卤素资源2.1 以食盐为原料的化工产品①为什么10 g粗盐要量取约30 mL水左右水来溶解?答:根据食盐在常温下的溶解度约为36 g/100 g水进行计算,可得出要溶解10 g食盐至少需水约28mL,水太少则不能溶解食盐,水太多则使蒸发过程太长。
②为什么用少量水洗涤结晶物能除去其中少量的可溶性杂质?答:因可溶性杂质量小,故能溶解,而食盐量大,只损失很少量。
3.盐酸盐酸:纯净的盐酸是无色液体,工业上用的盐酸常因含有杂质(主要是铁的化合物)而显黄色。
常用的浓盐酸含氯化氢37%,密度为1.19 g/crn3。
盐酸是一种强酸,它具有酸的通性。
4.氯化氢(1)氯化氢的性质氯化氢是无色、有刺激性气味的气体,密度约为相同条件下空气的1.26倍,氯化氢极易溶于水,0℃时1体积水大约能溶解500体积的氯化氢。
【实验回顾1】取一瓶氯化氢气体,观察它的颜色和状态,打开集气瓶上的玻璃片,嗅闻它的气味,并观察瓶口有什么现象发生。
然后用一条湿润的蓝色石蕊试纸接近瓶口,观察现象。
【现象及原理】湿润的蓝色石蕊试纸接近瓶口时试纸变红色,瓶口有白雾。
这是由于挥发出来的氯化氢与空气中少量的水蒸气作用形成盐酸小液滴的缘故。
【实验回顾2】在圆底烧瓶里充满氯化氢气体如图所示,用带有玻璃导管和滴管(滴管里预先吸入水)的双孔塞塞紧瓶口,倒置烧瓶,使玻璃管伸进盛有紫色石蕊溶液的烧杯里,挤压滴管的胶头,使水射入烧瓶中。
【现象及原理】烧杯里的溶液即由玻璃管喷入烧瓶,形成美丽的红色喷泉。
因为HCl 极易溶于水,烧瓶中的HCl溶于胶头滴管射入的少量水中,烧瓶压强减小,大气将烧杯里的水从玻璃导管喷入烧瓶中。
HCl溶于水形成盐酸,显酸性。
固体Zn+H SO(稀)→ZnSO+H↑固体和4①②③5.氢氧化钠的用途氢氧化钠是基本的化工原料,有着广泛的用途,可用于造纸、制肥皂等,对工农业生产和人类生活的有着重要意义。
6.电离与电离方程式(1)电解质在水溶液中或熔化状态下能导电的化合物。





高中化学《2开发海水中的卤素资源...1课题:溴、碘的性质及提取一、课程标准、教材分析及学生分析【课程标准】1.认识化学在海水的开发和利用中的实际应用,了解海水综合利用的一般原理和流程;2.以自然资源海水中提取溴和碘,了解化学方法在实现物质间转化中的作用。
【教材分析】本节内容安排在苏教版化学一的专题二:从海水中获得的化学物质的第一单元最后一节中,在这之前专题二的第一单元介绍了氯及其化合物,以及制备氯的方法和从得失电子、化合价升降的角度分析氧化还原反应。
本课时内容分为从海水、海带中提取溴、碘单质的流程和溴、碘的性质两部分。
【学生分析】学生对氯气及其化合物的性质有一定掌握,对氧化还原反应已经有了一定的认识,从化合价角度分析氧化还原反应并不难被学生所接受,很多学生已经具备一定的科学探究的方法和思路,这些为本节课的学习打下了较好的基础。
作为四星级高中,震泽中学的生源在本地区处于比较优质的水平,学生有综合运用知识的可能和能力。
二、教学目标【知识与技能】1.了解从海水或海产品中提取溴、碘单质的基本原理和方法;2.认识溴、碘及其化合物在生产和生活中的应用;能列举重要用途;3.知道溴、碘单质的性质及离子的检验方法。
【过程与方法】1.结合反应原理分析提取溴和碘的过程,体会实验设计的方法;2.通过将溴碘离子转化为单质进行富集、分离、转化的过程,体会转化的方法在物质分离中的应用,并运用所学的化学知识对化工生产流程的原理、步骤和安全防护进行简单的解释。
【情感态度与价值观】21.认识到海水是人类的宝贵资源,增强环保意识;2.通过对溴碘的提取及应用的了解,感受化学与人类生产、生活的紧密联系,认识化学学科的价值,培养热爱化学的情感,投身化学的志趣。
3.深切感受化学知识的力量,并对与化学有关的社会、工业生产问题进行思考和决策,培养学生的社会责任感、经济效益及化学工业中风险意识。
三、教学重难点重点:溴、碘的提取流程和原理;溴、碘的性质。
《开发海水中的卤素资源》知识梳理二
一、基础知识:
1、氟溴碘
卤素单质都有颜色,溴是色液体,有性,故保存采用水封法;碘为色固体,易。
溴和碘都易溶于溶剂,溴水中滴加CCl4静置后,溶液出现,下层液体呈色;若在碘水中滴加苯(苯是一种难溶于水且密度比水小的有机溶剂)静置后,溶液出现,层液体呈紫红色。
I2遇变蓝。
F2把氯、溴、碘从氢化物或盐溶液中置换出来,因F2会与发生反应。
HF能腐蚀,故应保存在瓶。
2、卤原子结构
卤素原子结构的共同点是最外层有个电子,所以在化学反应中易电子,具有性。
它们的区别是随着核电荷数的增加,电子层数,原子半径,原子核对最外层电子的吸引力逐渐,因此,非金属性也逐渐。
结构决定性质。
3、卤素递变规律
⑴元素非金属性:F Cl Br I ⑵单质氧化性:F2Cl2Br2 I2
⑶阴离子还原性:I-Br-Cl-F-⑷氯化氢稳定性:HF HCl HBr HI
⑸氢卤酸酸性:HI HBr HCl HF
⑹单质的颜色:逐渐⑺单质的密度、熔沸点:逐渐
⑻卤化银的颜色:逐渐
二、化学方程式:
1、溴和水反应
2、碘和氢氧化钠溶液反应
3、氟气与水反应:
4、铁粉与碘粉共热反应:
5、氯水与溴化钠溶液反应:
6、溴水与碘化钾溶液反应:
7、氯水与碘化钾溶液反应:
8、溴化钠溶液与硝酸银溶液反应:
9、碘化钾溶液与硝酸银溶液反应:
10、溴化银见光分解:
11、碘化银见光分解:
三、氧化还原反应
1、下列化学反应基本类型中,一定是氧化还原反应的是()
A.化合反应 B. 分解反应 C. 复分解反应 D. 置换反应
2、下列反应不属于四种基本反应类型,但属于氧化还原反应的是()
−∆2Fe+3CO2
A. Fe+CuSO4−→
−FeSO4+Cu B. Fe2O3+3CO−→
−∆K2MnO4 +MnO2 +O2↑
C. AgNO3+NaCl−→
−AgCl↓+NaNO3 D.2KMnO4−→
3、在下列变化中,需要加入合适的氧化剂才能实现的是()
A. HCl→H2
B. CO2→CO
C. FeCl3→FeCl2
D. SO2→SO3
4、下列变化需要加入还原剂才能实现的是()
A.MnO4- →Mn2+ B.HCl→Cl2 C.Fe→Fe3+ D.KClO3→O2
5、对于反应MnO2 + 4HCl(浓) −→
−∆MnCl2 + 2H2O + Cl2↑,下列说法不正确的是()A.该反应是氧化还原反应B.MnO2是氧化剂
C.HCl是还原剂D.若生成7.1 g Cl2,转移0.1 mol电子
6、对反应:C+2H2SO4(农)−→
−∆2SO2↑+CO2↑+2H2O,下列说法不正确的是()
A.浓H2SO4作氧化剂
B. C元素被氧化
C.S元素的化合价降低
D. 转移的电子数为2e
7、苹果汁是人们喜爱的饮料。
由于饮料中含有Fe2+,现榨的苹果汁在空气中很快会由淡绿色变为棕黄色,即Fe2+转变为Fe3+。
若榨苹果汁时加入维生素C,就能有效防止这种现象的发生。
这说明维生素C具有()
A.氧化性 B. 还原性 C. 酸性 D. 碱性
8、下列反应中,属于氧化还原反应,但水既不作氧化剂也不作还原剂的是()
A. SO2+H2O −→
−HCl+HClO
−H2SO3 B. Cl2+H2O−→
C. 3Fe+4H2O(g) −→
−2NaOH+H2↑
−Fe3O4+4 H2↑ D. 2Na+2H2O−→
−∆Cu+H2O,下列说法中正确的是()
9、关于氧化还原反应CuO+H2−→
A. CuO是还原齐,H2是氧化剂
B. CuO是氧化剂,H2是还原剂
C. 反应中Cu的化合价没有改变
D. 反应中H的化合价没有改变
10、标出下列反应中电子转移的方向和数目
Cl2+2KI→2KCl+I22Na+2H2O→2NaOH+H2↑
3Cu+8HNO3(稀) →3Cu(NO3)2+2NO↑+4H2O
3NO2+H2O→2HNO3+NO↑3Cl2+8NH3→N2+6NH4Cl
11、分析下面的氧化还原反应,标出反应中电子转移的方向和数目,并填空:
2KMnO4 + 16HCl→ 2KCl + 2MnCl2 +5 Cl2↑+ 8H2O
⑴氧化剂是,被氧化的元素是;当有1mol KMnO4参加反应,则有
g HCl参加反应,g HCl被氧化。
⑵如在反应中生成1mol单质硫,则在反应中转移电子总数。