Ⅱ.开发海水中的卤素资源
- 格式:ppt
- 大小:390.00 KB
- 文档页数:8

《开发海水中的卤素资源》知识梳理二一、基础知识:1、氟溴碘卤素单质都有颜色,溴是色液体,有性,故保存采用水封法;碘为色固体,易。
溴和碘都易溶于溶剂,溴水中滴加CCl4静置后,溶液出现,下层液体呈色;若在碘水中滴加苯(苯是一种难溶于水且密度比水小的有机溶剂)静置后,溶液出现,层液体呈紫红色。
I2遇变蓝。
F2把氯、溴、碘从氢化物或盐溶液中置换出来,因F2会与发生反应。
HF能腐蚀,故应保存在瓶。
2、卤原子结构卤素原子结构的共同点是最外层有个电子,所以在化学反应中易电子,具有性。
它们的区别是随着核电荷数的增加,电子层数,原子半径,原子核对最外层电子的吸引力逐渐,因此,非金属性也逐渐。
结构决定性质。
3、卤素递变规律⑴元素非金属性:F Cl Br I ⑵单质氧化性:F2Cl2Br2 I2⑶阴离子还原性:I-Br-Cl-F-⑷氯化氢稳定性:HF HCl HBr HI⑸氢卤酸酸性:HI HBr HCl HF⑹单质的颜色:逐渐⑺单质的密度、熔沸点:逐渐⑻卤化银的颜色:逐渐二、化学方程式:1、溴和水反应2、碘和氢氧化钠溶液反应3、氟气与水反应:4、铁粉与碘粉共热反应:5、氯水与溴化钠溶液反应:6、溴水与碘化钾溶液反应:7、氯水与碘化钾溶液反应:8、溴化钠溶液与硝酸银溶液反应:9、碘化钾溶液与硝酸银溶液反应:10、溴化银见光分解:11、碘化银见光分解:三、氧化还原反应1、下列化学反应基本类型中,一定是氧化还原反应的是( )A .化合反应 B. 分解反应 C. 复分解反应 D. 置换反应2、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A. Fe+CuSO 4−→−FeSO 4+CuB. Fe 2O 3+3CO −→−∆2Fe+3CO 2 C. AgNO 3+NaCl −→−AgCl↓+NaNO 3 4−→−∆K 2MnO 4 +MnO 2 +O 2↑ 3、在下列变化中,需要加入合适的氧化剂才能实现的是( )A. HCl→H 2B. CO 2→COC. FeCl 3→FeCl 2D. SO 2→SO 34、下列变化需要加入还原剂才能实现的是( )A .MnO 4- →Mn 2+B .HCl→Cl 2C .Fe→Fe 3+D .KClO 3→O 25、对于反应MnO 2 + 4HCl(浓) −→−∆ MnCl 2 + 2H 2O + Cl 2↑,下列说法不正确的是( )A .该反应是氧化还原反应B .MnO 2是氧化剂C .HCl 是还原剂D .若生成7.1 g Cl 2,转移0.1 mol 电子6、对反应:C+2H 2SO 4(农)−→−∆ 2SO 2↑+CO 2↑+2H 2O,下列说法不正确的是( )A.浓H 2SO 4作氧化剂B. C 元素被氧化元素的化合价降低 D. 转移的电子数为2e7、苹果汁是人们喜爱的饮料。

开发海水中的卤素资源(7.3、7.4)【关键词】1、氧化还原反应的概念2、氯气的性质、制法和用途3、氯化氢的性质、制法和用途4、氟氯溴碘的原子结构、性质递变规律、制法和用途氧气能发生哪些反应?为什么氧气在这些反应中只做氧化剂?氧气是如何制备的?画出实验室制备氧气的装置图。
一、氧化还原反应的概念1、什么是氧化还原反应?氧化还原反应的本质是什么?2、氧化剂、还原剂、氧化产物年、还原产物、被氧化、被还原、还原反应、氧化反应、电子转移的数目及方向二、、氯气画出氯的原子结构示意图,写出氯气的电子式。
写出氯离子的电子式。
氯气的物理性质:。
请推测氯气的化学性质:氯元素在自然界只有化合态存在,以氯离子的形式存在于海水中。
想一想应该如何制备氯气?氯气的工业制法:三、氯化氢氯化氢属于(填“电解质”或“非电解质”)。
盐酸的电离方程式:HCl的电子式:HCl的物理性质HCl的制法四、卤族元素原子结构的异同卤素单质物理性质、化学性质的比较卤素单质的制备:HX的性质比较:课后练习一、氧化还原反应1、下列说法正确的是()A、在化学反应中某元素由化合态变为游离态,该元素一定被还原了B、失电子能力难的原子获得电子的能力一定强C、金属单质在反应中只作为还原剂D、非金属单质在反应中办作为氧化剂。
2、盐酸具有的化学性质是()A、只有还原性B、只有酸性C、只有氧化性D、有酸性、氧化性、还原性3、下列粒子不具有氧化性的是()A、Cl--B、Cl2C、H+D、O24、下列变化需要加入还原剂才能实现的是()A、MnO4→ MnO2B、Cl--→Cl2C、H2S →SO2D、Fe2+→Fe5、在反应2KClO3→2KCl + 3O2↑中,电子转移的总数是()A、2个B、6个C、12个D、5个6、在黑火药发生爆炸时,可发生如下反应:2KNO3 + 3C + S →K2S + N2↑+ 3CO2↑,则被氧化的元素为A、氧B、碳C、氮和硫D、氮和碳7、在反应8NH3 + 3Cl2 = 6NH4Cl + N2中,若有56克N2生成,则发生氧化反应的物质的质量是()A、68gB、71gC、102gD、272g8、下列反应一定属于氧化还原反应的是()A、化合反应B、置换反应C、分解反应D、复分解反应9、下列Cl2既表现氧化性又表现还原性的反应是()A、Cl2 + 2NaOH →NaCl +NaClO +H2OB、2HClO →2HCl + O2↑C、Cl2 + 2Na →2NaClD、MnO2 + 4HCl →MnCl2 + Cl2↑+ 2H2O10、在反应2KMnO4→K2MnO4 + MnO2 + O2↑中,还原产物是()A、K2MnO4B、MnO2C、O2D、KMnO411、根据反应式:① 2Fe3+ + 2I-→ 2Fe2+ + I2 ② Br2 + 2Fe2+→ 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是()A、Br-、Fe2+ 、Cl-B、I- 、Fe2+ 、Br-C、Br- 、I- 、Fe2+D、Fe2+ 、I- 、Br-12、在3Cl2 + 6KOH →KClO3 + 5KCl + 3H2O的反应中,氧化剂和还原剂的质量比为()A、1:5B、5:1C、1:1D、2:113、在反应Fe2O3 + 3CO === 2Fe + 3CO2中,是氧化剂,是还原剂;元素被氧化,元素被还原;是氧化产物,是还原产物。

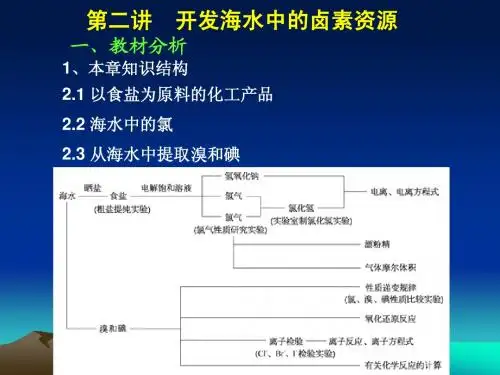
第二单元开发海水中的卤素资源一、教材分析本单元是在学习原子结构的基础上,通过研究开发海水中的化学资源,重点学习有关元素化合物的知识。
通过以食盐为原料的化工产品的学习,认识盐酸、烧碱、氯气、漂粉精等重要的氯碱工业产品;通过海水中提取镁、溴、碘和氯气性质的研究,探索氯、溴、碘的性质和递变规律;通过粗盐提纯、气体制取和卤素性质实验的研究,培养学生的实验动手和实验设计能力;通过氧化—还原反应、气体摩尔体积、电离方程式和离子方程式等化学基本概念和基本理论的学习,为以后的化学学习打下重要的基础。
二、本章内容的核心观念元素观、物质结构与性质、分类观、氧化—还原转价观、守恒观三、把核心观念转化成一些基本理解本单元涉及的卤素及其化合物、氧化—还原反应、离子反应、气体摩尔体积及实验操作和设计等有关知识是中学化学中的重点。
将元素及其化合物的知识与基本概念、基本理论、化学计算、实验操作技能联系起来,达到加深、巩固对元素及其化合物知识的理解。
四、基本理解可以采用“问题”驱动,通过实验设计来促进学生的基本理解1、海水晒盐的原理。
食盐的用途。
粗盐为什么易潮解?如何进行粗盐的提纯?2、探究电解饱和食盐水的原理:如何知道阴阳两级产生的是什么气体?怎么进行检验?得到的产品有什么用途?3、探究盐酸和氯化氢的性质。
实验室制备氯化氢气体,在发生气体过程中那些装置是必需的?4、氯气的物理性质和化学性质。
如何用实验来探究氯水的主要成分?5、决定物质体积大小的因素是什么?为什么相同质量的固体、液体体积会不同?为什么标准状况下相同物质的量的气体的体积几乎相同?6、“同温同压”与“标准状况”有什么联系和区别?阿伏加德罗定律的运用7、在学习海水晒盐的基础上如何进行海水提溴和海水提碘?氯溴碘在结构上有什么相似性?性质上有什么相似性及递变规律?如何进行卤离子的检验?8、得氧失氧的氧化还原反应与无氧参与的氧化还原反应的共同特征是什么?9、氧化还原反应的实质是什么?如何分析卤素单质以及化合物的氧化性和还原性的判断。

高一化学第一学期2.开发海水中的卤素资源教学设计(五)本章知识结构二、本节教材分析(一)教学目标知识与技能:1.理解实际生产中应适当控制卤水密度的原因。
2.理解粗盐提纯中除去其中难溶性杂质和可溶性杂质的原理,学会溶解、过滤、洗涤、蒸发的操作,提高动手实验的能力。
3.知道氯碱工业的基本反应和主要产品,认识电解在化学工业中的作用和氯碱工业的重要性,掌握氯化氢(盐酸)和氢氧化钠的性质。
4.学会实验室制氯化氢气体的方法及其实验装置的装配和操作。
5.理解电离方程式及书写。
过程与方法:通过卤水密度的控制,学习分析数据解决简单化学问题的方法。
对实验室气体制取和收集的方法有进一步了解。
通过实验活动,提高实验设计能力和创新精神。
(2)电解饱和食盐水化学方程式:2NaCl+2H2O−−−→通电2NaOH+H2↑+C12↑现象:两极产生气体的体积相同,在溶液中滴入酚酞试剂,阴极附近溶液变红,说明阴极生成了NaOH。
阳极:电极材料炭棒,产生黄绿色的C12,用淀粉碘化钾试纸检验,试纸变蓝,原理C12+2KI→2KCl+I2,碘单质遇淀粉显蓝色。
阴极:电极材料铁棒,产生无色的氢气,点燃发出淡蓝色火焰,验纯方法:搜集一试管的气体,管口向下移至火焰处,听到轻微的爆鸣声。
【教学建议】只要求学生掌握电解饱和食盐水的化学方程式,不涉及有关电解质和电解的概念和原理等。
电解饱和食盐水及产物检验的实验可由教师播放视频帮助学生回顾。
要求学生观察现象并进行描述、填空,教师可以提问并进行归纳。
主要观察阳极和阴极产生气体的颜色和量的多少,以及在哪个区域使酚酞试液变红。
同时要求掌握检验氯气和氢气的方法。
3.盐酸(1)工业制法工业上常用氯气在氢气中燃烧的方法来制取氯化氢气体如右图,氯气在氢气中燃烧时,有毒的氯气被过量的氢气所包围,使氯气充分反应。
注意:在生产上,往往采取使用一种过量的原料而使有害的或价格较昂贵的原料充分反应。
(2)性质盐酸:纯净的盐酸是无色液体,工业上用的盐酸常因含有杂质(主要是铁的化合物)而显黄色。






高中化学《2开发海水中的卤素资源...1课题:溴、碘的性质及提取一、课程标准、教材分析及学生分析【课程标准】1.认识化学在海水的开发和利用中的实际应用,了解海水综合利用的一般原理和流程;2.以自然资源海水中提取溴和碘,了解化学方法在实现物质间转化中的作用。
【教材分析】本节内容安排在苏教版化学一的专题二:从海水中获得的化学物质的第一单元最后一节中,在这之前专题二的第一单元介绍了氯及其化合物,以及制备氯的方法和从得失电子、化合价升降的角度分析氧化还原反应。
本课时内容分为从海水、海带中提取溴、碘单质的流程和溴、碘的性质两部分。
【学生分析】学生对氯气及其化合物的性质有一定掌握,对氧化还原反应已经有了一定的认识,从化合价角度分析氧化还原反应并不难被学生所接受,很多学生已经具备一定的科学探究的方法和思路,这些为本节课的学习打下了较好的基础。
作为四星级高中,震泽中学的生源在本地区处于比较优质的水平,学生有综合运用知识的可能和能力。
二、教学目标【知识与技能】1.了解从海水或海产品中提取溴、碘单质的基本原理和方法;2.认识溴、碘及其化合物在生产和生活中的应用;能列举重要用途;3.知道溴、碘单质的性质及离子的检验方法。
【过程与方法】1.结合反应原理分析提取溴和碘的过程,体会实验设计的方法;2.通过将溴碘离子转化为单质进行富集、分离、转化的过程,体会转化的方法在物质分离中的应用,并运用所学的化学知识对化工生产流程的原理、步骤和安全防护进行简单的解释。
【情感态度与价值观】21.认识到海水是人类的宝贵资源,增强环保意识;2.通过对溴碘的提取及应用的了解,感受化学与人类生产、生活的紧密联系,认识化学学科的价值,培养热爱化学的情感,投身化学的志趣。
3.深切感受化学知识的力量,并对与化学有关的社会、工业生产问题进行思考和决策,培养学生的社会责任感、经济效益及化学工业中风险意识。
三、教学重难点重点:溴、碘的提取流程和原理;溴、碘的性质。