常见有机化合物的紫外-可见吸收光谱
- 格式:ppt
- 大小:2.89 MB
- 文档页数:110







第二章紫外-可见吸收光谱【教学内容】1. 紫外-可见吸收光谱概述2. 紫外-可见光谱的仪器原理3.紫外-可见吸收光谱的原理4.常用术语5 有机化合物紫外-可见光谱的吸收峰6 吸收谱带的四种类型7 常见有机化合物生色团的紫外吸收峰8 紫外-可见光谱的影响因素9.紫外-可见光谱的定性和定量应用【掌握内容】1.掌握紫外-可见光谱的基本概念12.掌握有机化合物中电子跃迁的基本类型。
3.掌握紫外-可见光谱的定性分析方法4.掌握紫外-可见光谱的定量分析方法【熟悉内容】熟悉紫外-可见光谱仪的基本原理【了解内容】了解无机化合物的紫外-可见吸收光谱【教学重点和难点】教学重点:紫外-可见吸收光谱的基本概念、定性和定量分析方法【教学目标】掌握紫外-可见光谱的基本概念,紫外-可见光谱的定性和定量分析方法。
【教学手段】课堂讲授,辅以多媒体幻灯图片【教学过程】1 紫外-可见吸收光谱概述紫外—可见分光光度法是利用某些物质分子能够吸收200 ~ 800 nm光谱区的辐射来进行分析测定的方法。
这种分子吸收光谱源于价电子或分子轨道上电子的电子能级间跃迁,广泛用于无机和有机物质的定量测定,辅助定性分析(如配合IR)。
1.1 分子吸收光谱的产生在分子中,除了电子相对于原子核的运动外,还有核间相对位移引起的振动和转动。
这三种运动能量都是量子化的,并对应有一定能级。
下图为分子的能级示意图。
图1. 分子中电子能级、振动能级和转动能级示意图分子总能量:E分子= E电子+ E振动+ E转动当用频率为ν的电磁波照射分子,而该分子的较高能级与较低能级之差△E恰好等于该电磁波的能量hν时,即有:△ E = hν(h为普朗克常数)此时,在微观上出现分子由较低能级跃迁到较高的能级;在宏观上则透射光的强度变小。
用一连续-辐射的电磁波照射分子,将照射前后光强度的变化转变为电信号,并记录下来,然后以波长为横坐标,以电信号(吸光度A)为纵坐标,就可以得到一张光强度变化对波长的关系曲线图-紫外吸收光谱图,如下:A称为吸光度(absorbance),吸收度或光密度(OD,optical density),a称为吸收系数(absorotiviry),是化合物分子的特性,它与浓度(c)和光透过介质的厚度(b)无关。
紫外和可见光吸收光谱1.紫外光谱及其产生⑴紫外光的波长范围紫外光的波长范围为4-400nm。
200-400为近紫外区,4-200nm为远紫外区。
由于波长很短的紫外光会被空气中氧和二氧化碳吸收,研究远紫外区的吸收光谱很困难,一般的紫外光谱仅仅是用来研究近紫外区的吸收。
⑵紫外光谱当把一束光通过有机化合物时,某一波长的光可能吸收很强,而对其他波长的光可能吸收很弱,或者根本不吸收。
当化合物吸收一定波长的紫外光时,电子发生跃迁,所产生的吸收光谱叫做紫外吸收光谱,简称紫外光谱。
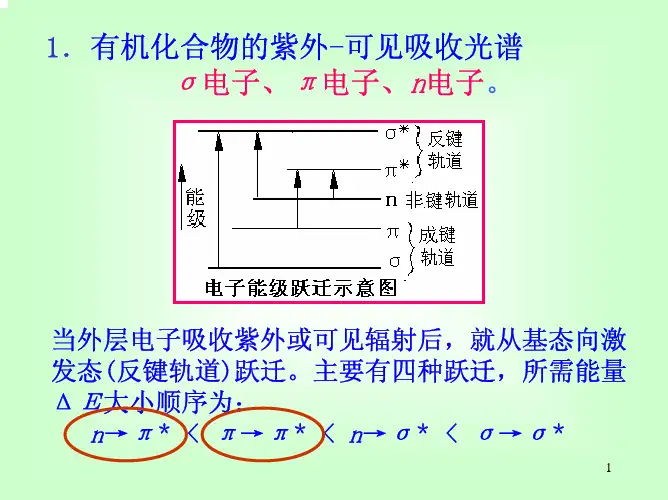
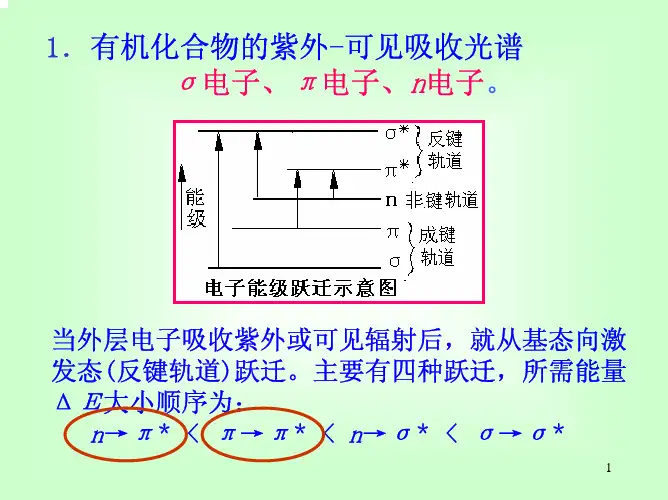
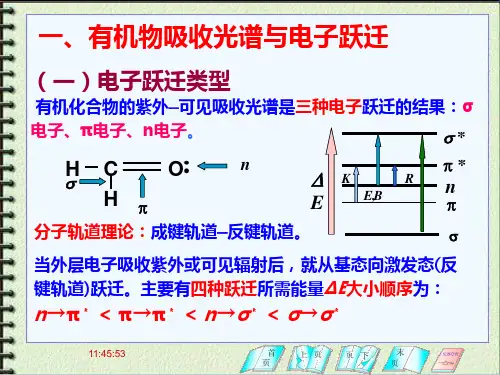
⑶电子跃迁的种类在有机化合物分子中,由于化合物的价电子有三种类型,即σ键电子、π键电子和未成键的 n 电子,在电子吸收光谱中,电子跃迁主要是经下三种。
①σ-σ*跃迁σ电子是结合得最牢固的价电子,在基态下,电子在成键轨道中,能级最低,而σ*态是最高能级。
σ-σ*跃迁需要相当高的辐射能量。
在一般情况下,仅在200nm以下约~150nm才能观察到,即在一般紫外光谱仪工作范围之外,只能用真空紫外光谱仪才可观察出来(在无氧和二氧化碳的情况下)。
所以测紫外光谱时,常常用烷烃作溶剂。
② n电子的跃迁n 电子是指象N,S,O,X 等原子上未共用的电子。
它的跃迁有两种方式。
第一种方式:n-π* 跃迁未共用电子激发跃入π*轨道,产生吸收带,称为R带(基团型的,Radikalartig德文),由n-π*引起的,在200 nm以上。
如:醛酮分子中羰基在275-295nm处有吸收带,为C=O中n-π*跃迁吸收带。
第二种方式是n→σ*跃迁,这种跃迁所需的能量大于n-π*,故醇醚均在远紫外区才出现吸收带。
~ 200nm。
如甲醇λmax183nm。
③π→π*跃迁乙烯分子中π电子吸收光能量,跃迁到π*轨道。
吸收带在远紫外区。
当双键上氢逐个被烯基取代后,由于共轭作用,π→π*能级减小。
吸收带向长波递增。
由共轭双键产生的吸收带称为K带,其特征是摩尔消光系数大于104。
在近紫外区吸收,CH2=CH2 λmax162nm,CH2=CH-CH=CH2 λmax217nm。