有机化合物紫外光谱解析
- 格式:ppt
- 大小:971.00 KB
- 文档页数:4




第一部分:Vc 、苯甲酸、水杨酸三种有机物紫外吸收曲线制作一、技能目标1、熟练使用T6型紫外-可见光分光光度计;2、掌握有机物紫外吸收曲线的制作方法;3、掌握应用紫外吸收曲线进行有机物定性分析的方法; 二、实验原理紫外吸收光谱法是根据有机化合物对特定波长光的吸收作用来进行定量分析的,当用一束具有连续波长的紫外光照射有机化合物时,紫外光中某些波长的光辐射就可为该化合物的分子所吸收,发生(π→π*或n →n *)跃迁,透过有机化合物的入射光减弱的程度与该化合物的浓度成正比,其定量关系式:kcl II A ==0lg ;若以波长为横坐标,吸光度为纵坐标作图,就可获得该化合物的紫外吸收光谱图; 三、实验仪器和试剂试剂:1.0mg/LVc ,1mg/Ll 苯甲酸,1mg/L 水杨酸,蒸馏水 仪器:T6型紫外-可见光分光光度计,石英比色皿(一套),100ml 容量瓶1个,1ml 移液管1支,洗耳球1个,100ml 烧杯1个,500ml 烧杯1个,吸水纸、擦镜纸若干 四、实验内容与步骤(1)、仪器开机预热15~20min ;(2)、按照测定方法设定测量参数; (3)、将三种标准储备液和未知液均配成浓度为10μg/ml 的待测溶液(配制方法自定); (4)、以蒸馏水位参比,于波长200~350nm 范围内测定三种溶液的吸光度,记录吸光度值于表格中(表格自己设计); (5)、根据数据在坐标纸上分别绘出三种物质的吸收曲线,并确定出最大吸收波长,在图上注明;Vc 的紫外吸收曲线λ/nm A λ/nm A 苯甲酸的紫外吸收曲线λ/nm A λ/nm A 水杨酸的紫外吸收曲线λ/nm A λ/nm A第二部分:紫外分光光度法测定未知物含量一、技能目标1、熟练使用T6型紫外-可见分光光度计;2、掌握应用紫外吸收曲线进行有机物定性分析的方法;3、掌握标准曲线法测定步骤。
二、实验原理当用一束具有连续波长的紫外光照射有机化合物时,紫外光中某些波长的光辐射就可为该化合物的分子所吸收,发生(π→π*或n →n *)跃迁,透过有机化合物的入射光减弱的程度与该化合物的浓度成正比,其定量关系式:kcl II A ==0lg ;三、仪器和试剂1、试剂:1.0mg/LVc 、1.0mg/L 苯甲酸、1.0mg/L 水杨酸、未知样浓度4~6μg/ml (Vc 、苯甲酸、水杨酸中的一种)、蒸馏水2、仪器:T6紫外分光光度计、石英比色皿一套、100ml 容量瓶1个、10ml 比色管6只,比色管架一个,1ml 吸量管1支、10ml 吸量管1支、洗耳球1个、100ml 烧杯1个,500ml 烧杯1个,洗瓶1个、吸水纸、擦镜纸、标签纸若干。


有机化学基础知识点紫外可见光谱与共轭体系的分析在有机化学中,紫外可见光谱(UV-Vis光谱)是一种常用的分析方法,可以用于研究物质的电子结构和化学性质。
而共轭体系是有机分子中的一种特殊结构,具有很强的紫外可见光吸收性质。
本文将介绍紫外可见光谱的基本原理以及共轭体系在紫外可见光谱中的应用。
一、紫外可见光谱的基本原理紫外可见光谱是通过测量物质对紫外光和可见光的吸收来研究物质的电子结构和化学性质的方法。
根据分子的电子能级理论,当分子受到光的辐射作用时,电子会从基态跃迁到激发态。
而分子的激发态和基态之间的能量差正好对应紫外光和可见光的能量范围,因此可以通过测量物质对紫外光和可见光的吸收情况来获取有关分子的信息。
在紫外可见光谱中,常用的量化参数是吸光度(A),用来表示溶液或物质对光的吸收强度。
吸光度与物质的摩尔吸光系数(ε)、溶液的浓度(c)以及光程长度(l)有关。
根据比尔-估尔定律,吸光度与摩尔吸光系数、浓度和光程长度之间成正比关系。
二、紫外可见光谱中的共轭体系共轭体系是指分子中存在着连续的多个单键和双键的交替排列。
共轭体系中的π电子系统能够形成一个共轭π电子体系,具有较低的能量。
这使得共轭体系具有吸收紫外光和可见光的能力。
共轭体系中,当分子受到光的激发时,π电子会跃迁到更高的能级。
共轭体系的π电子能级分布与电子能带结构密切相关,可通过紫外可见光谱来研究和解释。
在共轭体系中,能级之间的跃迁能够产生吸收峰,吸收峰的位置与共轭体系的结构和电子密度分布有关。
通过对共轭体系的紫外可见光谱进行分析,可以得到很多有关分子结构和性质的信息。
例如,共轭体系的分子通常会表现出较大的摩尔吸光系数,即吸光度较高。
此外,共轭体系中的共轭程度越高,吸收峰的波长越长。
这使得紫外可见光谱成为研究共轭体系的有力工具。
三、共轭体系的应用共轭体系在有机化学和材料科学中具有广泛的应用。
通过对共轭体系的紫外可见光谱进行分析,可以研究和判断新合成的有机化合物的结构和性质,例如共轭聚合物、染料分子等。

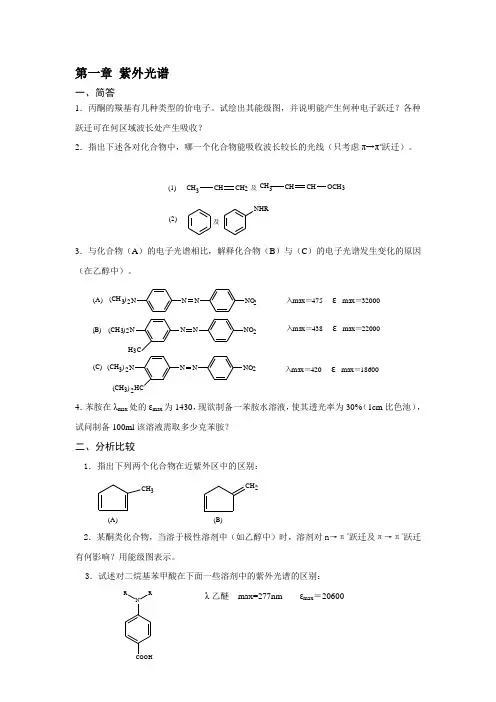
第一章 紫外光谱一、简答1.丙酮的羰基有几种类型的价电子。
试绘出其能级图,并说明能产生何种电子跃迁?各种跃迁可在何区域波长处产生吸收?2.指出下述各对化合物中,哪一个化合物能吸收波长较长的光线(只考虑π→π*跃迁)。
(2)(1)及NHR3CHCHOCH 3CH 及CH 3CH CH23.与化合物(A )的电子光谱相比,解释化合物(B )与(C )的电子光谱发生变化的原因(在乙醇中)。
(C)(B)(A)入max =420 εmax =18600入max =438 εmax =22000入max =475 εmax =320003N NNNO HC32(CH )2N NNNO H C 32(CH )2232(CH )(CH )23NNNNO4.苯胺在λmax 处的εmax 为1430,现欲制备一苯胺水溶液,使其透光率为30%(1cm 比色池),试问制备100ml 该溶液需取多少克苯胺?二、分析比较1.指出下列两个化合物在近紫外区中的区别:CH CH 32(A)(B)2.某酮类化合物,当溶于极性溶剂中(如乙醇中)时,溶剂对n →π*跃迁及π→π*跃迁有何影响?用能级图表示。
3.试述对二烷基苯甲酸在下面一些溶剂中的紫外光谱的区别:λ乙醚 max=277nm εmax =20600NRRCOOHλEtOH max=307nm εmax =19000λHCl max=307nm εmax =970三、试回答下列各问题1.某酮类化合物λhexanemax =305nm ,其λEtOH max=307nm,试问,该吸收是由n→π*跃迁还是π→π*跃迁引起的?2. 1,1二苯乙烯(A )在环己烷中的UV 光谱与蒽(B )的UV 光谱有相当大的区别。
在浓硫酸中这两个化合物UV 光谱非常相似,见表1-5,而在稀硫酸中又与环己烷中的UV 光谱相同,试问在浓硫酸中这两个化合物发生了什么变化?表1-1 化合物(A )和(B )在不同溶剂中的λma四.计算下述化合物的λmax :1. 计算下列化合物的λmax :2.计算全反式西红柿烯(结构如下)的λmax 及εmax :3.计算一叶萩碱在乙醇中的λmax :NOO4.计算下列化合物的λmax :(D)(C)(B)(A)2NH COOH3OH COCH O 33OOCH CH O五、结构判定1.由某挥发油中分得一种成分,其UVλhexane max=268nm,由其它方法初步确定该化合物的结构可能为A 或B ,试问可否用UV 光谱做出判断?(A)(B)2. 一化合物初步推断其结构不是A 就是B ,经测定UV λEtOH max=352nm,试问其结构为何?O O(A)(B)3. 2-(环己-1-烯基)-2-丙醇在硫酸存在下加热处理,得到主要产物的分子式为C 9H 14,产物经纯化,测紫外光谱λmax =242nm (εmax =10100),推断这个主要产物的结构,并讨论其反应过程。

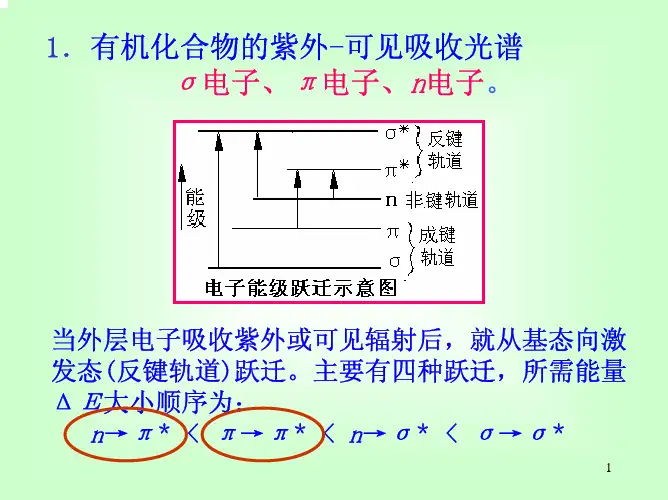
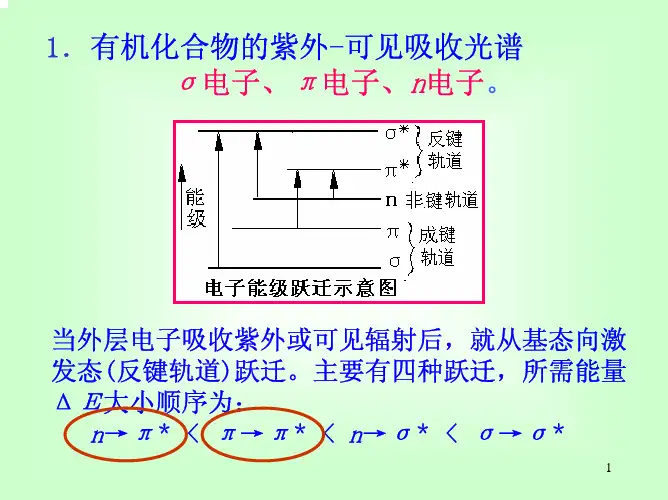
紫外光谱的解析一、紫外光谱的基本原理1. 概念•紫外光谱(UV)是分子吸收紫外•可见光区(200•800nm)的电磁波而产生的吸收光谱。
它反映了分子中的电子跃迁情况。
当分子吸收紫外光时,分子中的价电子从低能级跃迁到高能级。
•例如,在一些有机化合物中,存在着π电子和n电子(非键电子)。
这些电子可以发生π• π跃迁、n• π跃迁等。
其中,π• π跃迁通常所需能量较高,对应的吸收波长相对较短,多在200nm左右;而n• π跃迁所需能量较低,吸收波长相对较长,一般在270• 350nm范围。
2. Lambert - Beer定律•这是紫外光谱分析的基本定律,其表达式为 A = εbc。
其中,A是吸光度,表示物质对光的吸收程度;ε是摩尔吸光系数,它与物质的性质有关,反映了物质对特定波长光的吸收能力,单位为L/(mol·cm);b是光程长度,即样品池的厚度,单位为cm;c是溶液中物质的摩尔浓度,单位为mol/L。
•例如,在测定某一化合物的浓度时,如果已知其摩尔吸光系数和光程长度,通过测量吸光度就可以计算出溶液中的物质浓度。
假设某物质的摩尔吸光系数为1000L/(mol·cm),光程长度为1cm,测得吸光度为0.5,根据Lambert• Beer定律,可算出该物质的浓度c = A/(εb)=0.5/(1000×1)= 5×10⁻⁴mol/L。
二、紫外光谱中的特征吸收带1. R带• R带是由n•π跃迁产生的吸收带。
其特点是吸收强度较弱,摩尔吸光系数一般在10• 100L/(mol·cm)范围内,吸收峰波长较长,多在270• 350nm。
•在醛、酮、硝基化合物等分子中常常可以观察到R带。
例如,丙酮分子中的羰基(C = O)上的n电子可以发生n• π跃迁,在约279nm处有一个R带吸收峰。
2. K带• K带是由共轭体系中的π• π跃迁产生的吸收带。
其吸收强度较大,摩尔吸光系数通常大于10000L/(mol·cm),吸收峰波长与共轭体系的大小有关。