有机化合物的紫外光谱
- 格式:ppt
- 大小:11.54 MB
- 文档页数:7

常见有机化合物的紫外吸收光谱1. 饱和烃饱和单键碳氢化合物只有σ电子,因而只能产生σ→σ*跃迁。
由于σ电子最不容易激发,需要吸收很大的能量,才能产生σ→σ*跃迁,因而这类化合物在200nm以上无吸收。
所以它们在紫外光谱分析中常用作溶剂使用,如正已烷、环乙烷、庚烷等。
2.不饱和脂肪烃◆含孤立不饱和键的烃类化合物。
具有孤立双键或三键的烯烃或炔烃,它们都产生π→π*跃迁,但多数在200nm以上无吸收。
如已烯吸收峰在171nm,乙炔吸收峰在173nm,丁烯在178nm。
若烯分子中氢被助色团如-OH、-NH2、-Cl等取代时,吸收峰发生红移,吸收强度也有所增加。
◆含共轭体系的不饱和烃。
具有共轭双键的化合物,相间的π键相互作用生成大π键,由于大π键各能级之间的距离较近,电子易被激发,所以产生了K吸收带,其吸收峰一般在217~280nm。
K吸收带的波长及长度与共轭体系的长短、位置、取代基种类等有关,共轭双键越多,波长越长,甚至出现颜色。
因此可据此判断共轭体系的存在情况。
◆芳香化合物。
苯的紫外吸收光谱是由π→π*跃迁组成的三个谱带,即E1、E2、具有精细结构的B吸收带。
当苯环上引入取代苯时,E2吸收带和B吸收带一般产生红移且强度加强。
稠环芳烃母体吸收带的最大吸收波长大于苯,这是由于它有两个或两个以上共轭的苯环,苯环数目越多,λmax越大。
例如苯(255nm)和萘(275nm)均为无色,而并四苯为橙色,吸收峰波长在460nm。
并五苯为紫色,吸收峰波长为580nm。
◆杂环化合物。
在杂环化合物中,只有不饱和的杂环化合物在近紫外区才有吸收。
以O、S或NH取代环戊二烯的CH2的五元不饱和杂环化合物,如呋喃、噻吩和吡咯等,既有π→π*跃迁引起的吸收谱带,又有n→π*跃迁引起的谱带。

有机化合物的紫外吸收光谱实验报告实验目的:1. 了解有机化合物紫外吸收光谱的基本原理以及使用方法。
2. 掌握实验操作的基本技能,正确操作分光光度计。
3. 通过实验,了解有机化合物的分子结构与紫外吸收光谱之间的关系,为分析有机分子结构提供基础。
实验原理:有机化合物的紫外吸收光谱可以为有机分子结构的研究提供很大的帮助。
在紫外光谱中,通常对于各种功能团体都存在特定的波长范围的吸收峰。
通过分析有机化合物在特定波长的紫外吸收峰的大小以及形状,我们就能够推断出分子中存在的功能团体。
实验步骤:1. 准备实验所需物品:分光光度计、苯甲酸溶液、四乙酸酯溶液、环己酮溶液等。
2. 打开分光光度计,调试好仪器,使其能夠正常工作。
3. 取一定量苯甲酸溶液,加入分光光度计比色皿中,并做好参照物质的设置。
4. 按照波长扫描模式,设定扫描范围,并进行扫描。
5. 记录下吸收峰的最大吸收波长及吸光度值,并对红外光谱进行分析解释。
6. 重复上述实验步骤,分别对于四乙酸酯溶液和环己酮溶液进行的操作。
7. 对实验结果进行分析,分别阐明各个实验组操作中存在的异同之处,并对每种化合物的分子结构和吸收峰进行解释。
实验结果分析:通过实验,我们得到了三种不同有机化合物的紫外吸收光谱,并对各个实验组操作中存在的异同之处进行了分析。
对于苯甲酸、四乙酸酯和环己酮这三种化合物,它们的特定吸收峰分别对应的波长区间如下:1. 苯甲酸:250nm至270nm2. 四乙酸酯:270nm至290nm3. 环己酮: 230nm至255nm可以看出,这三种化合物的吸收峰波长的区间是不同的,这表现出不同化合物分子结构之间的差异。
我们还可以通过分析各个吸收峰的峰值和峰形,来推断出分子中存在的官能团体,这也有利于我们理解化合物分子结构和有机分子之间的结构相互关系。
结论:通过实验,我们对于有机化合物的紫外吸收光谱有了更深入的了解。
通过观察分析不同化合物的吸收峰,我们可以推断出分子结构中所存在的官能团体以及它们在分子中位置的不同,从而为分析有机分子结构和进行有机合成提供帮助。

实验3 有机化合物的紫外吸收光谱及溶剂性质对吸收光谱的影响一、实验原理具有不饱和结构的有机化合物,如芳香族化合物,在紫外区(200~400 nm)有特征的吸收,为有机化合物的鉴定提供了有用的信息。
紫外吸收光谱定性的方法是比较未知物与已知纯样在相同条件下绘制的吸收光谱,或将绘制的未知物吸收光谱与标准谱图(如Sadtler紫外光谱图)相比较,若两光谱图的λmax和κmax相同,表明它们是同一有机化合物。
极性溶剂对有机物的紫外吸收光谱的吸收峰波长、强度及形状有一定的影响。
溶剂极性增加,使n→π*跃迁产生的吸收带蓝移,而π→π*跃迁产生的吸收带红移。
二、仪器与试剂1.仪器722型紫外一可见分光光度计,带盖石英吸收池2只(1cm)。
2.试剂(1)苯、乙醇、正己烷、氯仿、丁酮。
(2)异亚丙基丙酮分别用水、氯仿、正己烷配成浓度为0.4 g·L-1的溶液。
三、实验步骤1.苯的吸收光谱的测绘在1 cm的石英吸收池中,加人两滴苯,加盖,用手心温热吸收池底部片刻,在紫外分光光度计上,以空白石英吸收池为参比,从220~360 nm范围内进行波长扫描,绘制吸收光谱。
确定峰值波长。
2.乙醇中杂质苯的检查用l cm石英吸收池,以乙醇为参比溶液,在230~280 nm波长范围内测绘乙醇试样的吸收光谱,并确定是否存在苯的B吸收带?3.溶剂性质对紫外吸收光谱的影响(1)在3支5 mL带塞比色管中,各加入0.02 mL,丁酮,分别用去离子水、乙醇、氯仿稀释至刻度,摇匀。
用1 cm石英吸收池,以各自的溶剂为参比,在220~350 nm波长范围内测绘各溶液的吸收光谱。
比较它们的λmax的变化,并加以解释。
(2)在3支10 mL带塞比色管中,分别加入0.20 mL异亚丙基丙酮,并分别用水、氯仿、正己烷稀释至刻度,摇匀。
用1 cm石英吸收池,以相应的溶剂为参比,测绘各溶液在200~350 nm范围内的吸收光谱,比较各吸收光谱λmax的变化,并加以解释。


第一部分:Vc 、苯甲酸、水杨酸三种有机物紫外吸收曲线制作一、技能目标1、熟练使用T6型紫外-可见光分光光度计;2、掌握有机物紫外吸收曲线的制作方法;3、掌握应用紫外吸收曲线进行有机物定性分析的方法; 二、实验原理紫外吸收光谱法是根据有机化合物对特定波长光的吸收作用来进行定量分析的,当用一束具有连续波长的紫外光照射有机化合物时,紫外光中某些波长的光辐射就可为该化合物的分子所吸收,发生(π→π*或n →n *)跃迁,透过有机化合物的入射光减弱的程度与该化合物的浓度成正比,其定量关系式:kcl II A ==0lg ;若以波长为横坐标,吸光度为纵坐标作图,就可获得该化合物的紫外吸收光谱图; 三、实验仪器和试剂试剂:1.0mg/LVc ,1mg/Ll 苯甲酸,1mg/L 水杨酸,蒸馏水 仪器:T6型紫外-可见光分光光度计,石英比色皿(一套),100ml 容量瓶1个,1ml 移液管1支,洗耳球1个,100ml 烧杯1个,500ml 烧杯1个,吸水纸、擦镜纸若干 四、实验内容与步骤(1)、仪器开机预热15~20min ;(2)、按照测定方法设定测量参数; (3)、将三种标准储备液和未知液均配成浓度为10μg/ml 的待测溶液(配制方法自定); (4)、以蒸馏水位参比,于波长200~350nm 范围内测定三种溶液的吸光度,记录吸光度值于表格中(表格自己设计); (5)、根据数据在坐标纸上分别绘出三种物质的吸收曲线,并确定出最大吸收波长,在图上注明;Vc 的紫外吸收曲线λ/nm A λ/nm A 苯甲酸的紫外吸收曲线λ/nm A λ/nm A 水杨酸的紫外吸收曲线λ/nm A λ/nm A第二部分:紫外分光光度法测定未知物含量一、技能目标1、熟练使用T6型紫外-可见分光光度计;2、掌握应用紫外吸收曲线进行有机物定性分析的方法;3、掌握标准曲线法测定步骤。
二、实验原理当用一束具有连续波长的紫外光照射有机化合物时,紫外光中某些波长的光辐射就可为该化合物的分子所吸收,发生(π→π*或n →n *)跃迁,透过有机化合物的入射光减弱的程度与该化合物的浓度成正比,其定量关系式:kcl II A ==0lg ;三、仪器和试剂1、试剂:1.0mg/LVc 、1.0mg/L 苯甲酸、1.0mg/L 水杨酸、未知样浓度4~6μg/ml (Vc 、苯甲酸、水杨酸中的一种)、蒸馏水2、仪器:T6紫外分光光度计、石英比色皿一套、100ml 容量瓶1个、10ml 比色管6只,比色管架一个,1ml 吸量管1支、10ml 吸量管1支、洗耳球1个、100ml 烧杯1个,500ml 烧杯1个,洗瓶1个、吸水纸、擦镜纸、标签纸若干。




实验九有机化合物的紫外吸收光谱及溶剂效应实验目的:(1)学习有机化合物结构与其紫外光谱之间的关系;(2)了解不同极性溶剂对有机化合物紫外吸收带位置、形状及强度的影响。
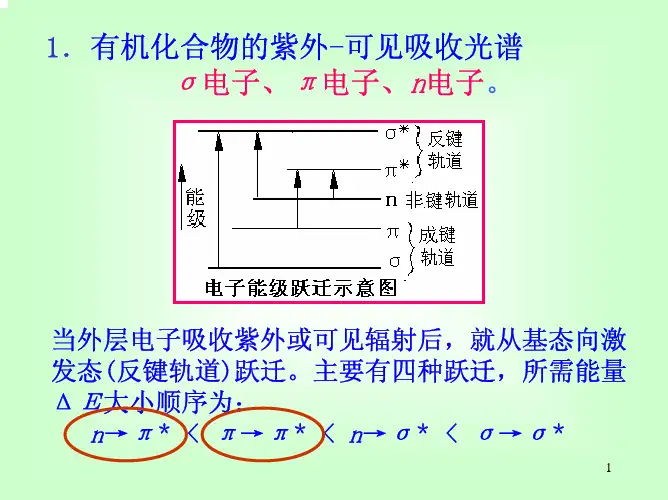
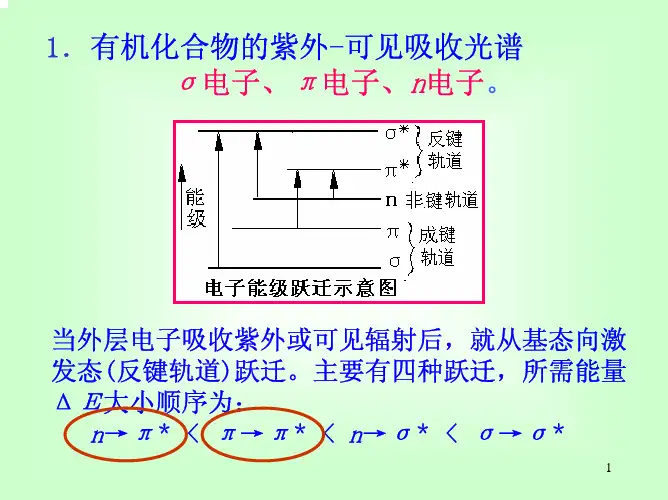
(3)学习紫外—可见分光光度计的使用方法实验原理:与紫外-可见吸收光谱有关的电子有三种,即形成单键的σ电子、形成双键的π电子以及未参与成键的n电子。
跃迁类型有:σ→σ*,n→σ* ,n→π*,π→π* 四种。
在以上几种跃迁中,只有π-π*和n-π*两种跃迁的能量小,相应波长出现在近紫外区甚至可见光区,且对光的吸收强烈,是我们研究的重点。
影响有机化合物紫外吸收光谱的因素有内因和外因两个方面。
内因是指有机物的结构,主要是共轭体系的电子结构。
随着共轭体系增大,吸收带向长波方向移动(称作红移),吸收强度增大。
紫外光谱中含有π键的不饱和基团称为生色团,如有C=C、C=O、NO2、苯环等。
含有生色团的化合物通常在紫外或可见光区域产生吸收带;含有杂原子的饱和基团称为助色团,如OH、NH2、OR、Cl等。
助色团本身在紫外及可见光区域不产生吸收带,但当其与生色团相连时,因形成n→π*共轭而使生色团的吸收带红移,吸收强度也有所增加。
影响有机化合物紫外吸收光谱的外因是指测定条件,如溶剂效应等。
所谓溶剂效应是指受溶剂的极性或酸碱性的影响,使溶质吸收峰的波长、强度以及形状发生不同程度的变化。
这是因为溶剂分子和溶质分子间可能形成氢键,或极性溶剂分子的偶极使溶质分子的极性增强,从而引起溶质分子能级的变化,使吸收带发生迁移。
例如异丙叉丙酮的溶剂的溶剂效应如表1所示。
随着溶剂极性的增加K带红移,而R带向短波方向移动(称作蓝移或紫移)。
这是因为在极性溶剂中π→π * 跃迁所需能量减小,吸收波长红移(向长波长方向移动)如图(a)所示;而n→π * 跃迁所需能量增大,吸收波长蓝移(向短波长方向移动),溶剂效应示意图如(b)所示。
图1 电子跃迁类型σπ *σ *nπ∆C*—C-△E n>△E p C=0 △E n>△E p图2溶剂极性效应(a)π→π * 跃迁(b)n→π * 跃迁B吸收带,在不同极性溶剂中,其强度和形状均受到影响、在非极性溶剂正庚烷中,可清晰看到苯酚B吸收带的精细结构,但在极性溶剂乙醇中,苯酚B吸收带的精细结构消失,仅存在一个宽的吸收峰,而且其吸收强度也明显减弱。